Гліколіз

Гліко́ліз або шлях Ембдена—Меєргофа—Парнаса (від дав.-гр. γλυκός — солодкий та λύσης — розщеплення) — ланцюг із десяти реакцій, внаслідок яких глюкоза C6H12O6 перетворюється на піруват, C3H3O-
3 з утворенням АТФ (аденозинтрифосфату) та НАДН (відновленого нікотинамідаденіндинуклеотиду).
У аеробних організмів гліколіз йде перед циклом трикарбонових кислот та ланцюгом переносу електронів. Вони разом вивільняють більшу частину енергії, яка міститься в глюкозі. За аеробних умов піруват потрапляє в мітохондрії, де повністю окиснюється до СО2 та Н2О.
За недостатності кисню (це буває в м'язах, які активно скорочуються) піруват перетворюється на лактат. У деяких анаеробних організмах, наприклад, дріжджів, піруват перетворюється не на лактат, а на етанол. Утворення етанолу та лактату з глюкози — це приклади бродіння.
Історія дослідження[ред. | ред. код]
Серед метаболічних шляхів гліколіз відкрили першим і він найдослідженіший.[1][2] 1897 року брати Ганс[en] та Едуард Бюхнери виготовляли безклітинні екстракти дріжджів для лікування. Очевидно, вони при цьому не могли скористатися отруйними для людини антисептиками (наприклад, фенолом), тому спробували поширений у кулінарії консервант — сахарозу. З'ясувалося, що в дріжджових екстрактах ця речовина швидко зброджувалась до етилового спирту. Так було вперше встановлено, що бродіння може відбуватись поза межами живих клітин[3]. 1907 року за це відкриття Едуарда Бюхнера відзначили Нобелівською премією з хімії[4].
Вивчення позаклітинного бродіння лишалося одним із основних завдань біохімії аж до 1940-х років. Перебіг цього метаболічного шляху в клітинах дріжджів описали Отто Варбург, Ганс фон Ейлер-Хельпін та Артур Гарден (два останні отримали Нобелівську премію з хімії 1929 року[5]). Гліколіз у м'язах дослідили Густав Ембден[en] та Отто Меєргоф[2] (Нобелівська премія з медицини та фізіології 1922 року[6]). Свій внесок у дослідження гліколізу зробили Карл Нойберг[en], Яків Парнас, Герті та Карл Корі[3].
Завдяки вивченню гліколізу було зроблено «побічні» відкриття: винайшли численні методи очищення ферментів, з'ясували центральну роль АТФ та інших фосфорильованих сполук у метаболізмі, відкрили коензими, такі як НАД[2].
Поширення й значення[ред. | ред. код]
Гліколіз є майже універсальним шляхом катаболізму глюкози для всіх клітинних організмів. Ймовірно, він виник на ранніх етапах розвитку життя на Землі, ще до того, як в атмосфері накопичився кисень внаслідок діяльності фотосинтезуючих істот[2][7]. В еволюційному плані послідовність гліколітичних реакцій — надзвичайно давній шлях. Його ферменти у хребетних тварин, дріжджів та рослин дуже споріднені як за амінокислотними послідовностями, так і за тривимірною структурою. Секвенування ДНК з геномів численних організмів показало, що тільки в деяких архей та паразитичних бактерій відсутні один або кілька ферментів гліколізу, попри те сам шлях зберігається, імовірно, у модифікованій формі[2].
В евкаріотичних клітинах реакції гліколізу відбуваються у цитозолі. У більшості таких клітин саме цей метаболічний шлях з-поміж інших посідає перше місце за кількістю атомів карбону, що зазнають у ньому перетворень[2].
У більшості аеробних евкаріотичних організмів гліколіз створює субстрат до подальшого окиснення в мітохондріях, де за наявності кисню запасається значна кількість енергії у вигляді АТФ. Втім для деяких типів клітин, які не мають мітохонондрій або перебувають далеко від капілярів, зокрема в еритроцитах ссавців та клітинах кришталика, гліколіз є головним джерелом енергії. Для скелетних м'язів та інших тканин в умовах дуже великого навантаження або гіпоксії гліколіз вигідний не лише тому, що дає можливість одержати енергію за умов нестачі кисню, а ще й тому, що відбувається дуже швидко і забезпечує синтез АТФ у 10,5 разів швидше, ніж аеробне окиснення органічних речовин[8]. Серед м'язових волокон виділяють групу волокон IIB, які містять мало мітохондрій, оточені невеликою кількістю капілярів та здатні до сильних швидких скорочень протягом невеликого часу. Такі волокна отримують більшу частину енергії за рахунок гліколізу. Клітини мозкового шару нирок, лімфоцити, клітини шкіри також є суттєво залежними від гліколізу.[9]
Для головного мозку ссавців (за винятком випадків голодування[10]) характерне активне використання гліколізу навіть за наявності кисню під час ембріонального нейрогенезу, а також при рості дендритів та формуванні синаптичних контактів у дорослому мозку[11]. Гліколіз також є важливим джерелом енергії для сперматозоїдів. Сперматозоїди різних видів ссавців мають різну ефективність гліколізу: сперматозоїди людини здатні виживати та рухатися в анаеробному середовищі, тоді як клітини мурчака та свині знерухомлюються й без кисню гинуть; сперматозоїди биків та макак резусів займають проміжне положення.[12]
У рослин від гліколізу залежать, головним чином, тканини, спеціалізовані на зберіганні крохмалю (наприклад, бульби картоплі) та водяні рослини (настурція лікарська)[2].
Іншими шляхами окиснення глюкози є пентозофосфатний шлях та шлях Ентнера — Дудорова. Останній є заміною гліколізу в деяких грам-негативних та, дуже рідко, грам-позитивних бактерій і має багато спільних із ним ферментів[13].
Реакції гліколізу[ред. | ред. код]

Традиційно гліколіз поділяють на дві стадії: підготовчу, яка вимагає поглинання енергії (п'ять перших реакцій), та стадію віддавання енергії (п'ять останніх реакцій)[14][1][15][2]. Інколи четверту та п'яту реакції виділяють в окрему проміжну стадію[10][16].
На першій стадії відбувається фосфорилювання глюкози у шостому положенні, ізомеризація одержаного глюкозо-6-фосфату до фруктозо-6-фосфату та повторне фосфорилювання вже у першому положенні. Внаслідок цього утворюється фруктозо-1,6-бісфосфат. Фосфатні групи на моносахариди переносяться з АТФ. Це необхідно для активації молекул — збільшення вмісту в них вільної енергії[17]. Потім фруктозо-1,6-бісфосфат розщеплюється до двох фосфотріоз, які можуть вільно перетворюватись одна на одну.
На другій стадії (віддавання енергії) фосфотріоза (гліцеральдегід-3-фосфат) окиснюється та фосфорилюється неорганічним фосфатом. Утворюється продукт, що в серії екзергонічних реакцій, спряжених із синтезом чотирьох молекул АТФ, перетворюється на піруват. Отже, під час гліколізу відбувається три принципові перетворення:
Перша стадія[ред. | ред. код]
Фосфорилювання глюкози[ред. | ред. код]
Перша реакція гліколізу — фосфорилювання глюкози з утворенням глюкозо-6-фосфату, що каталізується ферментом гексокіназою. Донором фосфатної групи є молекула АТФ. Реакція відбувається тільки за наявності іонів Mg2+, тому що справжнім субстратом для гексокінази є не АТФ4-, а комплекс MgАТФ2-. Магній екранує негативний заряд фосфатної групи, таким чином полегшуючи здійснення нуклеофільної атаки на останній атом фосфору гідроксильною групою глюкози[18].
Внаслідок фосфорилювання відбувається не лише активація молекули глюкози, а й її «ув'язнення» всередині клітини: плазматична мембрана має білки-переносники для глюкози, але не для її фосфорильованої форми. Тому велика заряджена молекула глюкозо-6-фосфату не може пройти крізь мембрану, хоча її концентрація у цитоплазмі більша, аніж у позаклітинній рідині[18][19][10].
Фермент гексокіназа є майже у всіх організмів, основним його субстратом є глюкоза. Проте він може каталізувати фосфорилювання інших гексоз: D-фруктози, D-манози тощо. У людини є чотири ізоформи гексокінази (від I до IV). Один з ізоферментів — гексокіназа IV або глюкокіназа — відрізняється від інших форм особливостями кінетики та регулюванням своєї активності[18].
Ізомеризація глюкозо-6-фосфату[ред. | ред. код]
У другій реакції гліколізу відбувається ізомеризація глюкозо-6-фосфату до фруктозо-6-фосфату під впливом ферменту глюкозофосфатізомерази (гексозофосфатізомерази). Спочатку відбувається відкриття шестичленного піранозного кільця глюкозо-6-фосфату, тобто перехід цієї речовини у лінійну форму, після чого карбонільна група з першого положення переноситься в друге через проміжну ендіольну форму[18]. Тобто альдоза перетворюється на кетозу. Утворена лінійна молекула фруктозо-6-фосфату замикається у п'ятичленне фуранозне кільце[20].
Через незначну зміну вільної енергії реакція є оборотною. Ізомеризація глюкозо-6-фосфату є необхідною умовою для подальшого гліколізу, оскільки наступна реакція — ще одне фосфорилювання — потребує гідроксильної групи в першому положенні[18].
Фосфорилювання фруктозо-6-фосфату[ред. | ред. код]
Після стадії ізомеризації починається друга реакція фосфорилювання, за якої фруктозо-6-фосфат перетворюється на фруктозо-1,6-бісфосфат[en] завдяки приєднанню фосфатної групи АТФ. Реакцію каталізує фермент фосфофруктокіназа-1[en] (скорочено ФФК-1). Існує також фермент ФФК-2[en], який каталізує утворення фруктозо-2,6-бісфосфату[en] іншим метаболічним шляхом [21].
У цитоплазмі ця реакція є незворотною. Вона першою достеменно визначає розщеплення речовин по гліколітичному шляху, оскільки глюкозо-6-фосфат та фруктозо-6-фосфат можуть вступати в інші метаболічні перетворення, а фруктозо-1,6-бісфосфат використовується лише для гліколізу. Саме утворення фруктозо-1,6-бісфосфату є визначальною стадією гліколізу[21].
У рослин, деяких бактерій та найпростіших є також форма фосфофруктокінази, що використовує як донор фосфатної групи пірофосфат, а не АТФ. ФФК-1 як алостеричний фермент[en] зазнає складного регулювання. До позитивних модуляторів належать продукти розщеплення АТФ — АДФ та АМФ, рибулозо-5-фосфат[en] (проміжний продукт пентозофосфатного шляху), у деяких організмів — фруктозо-2,6-бісфосфат. Негативним модулятором є АТФ[21].
Розщеплення фруктозо-1,6-бісфосфату на дві фосфотріози[ред. | ред. код]
Фруктозо-1,6-бісфосфат розщеплюється до двох фосфотріоз: гліцеральдегід-3-фосфат та дигідроксиацетонфосфат під впливом фруктозо-1,6-фосфатальдолази (частіше просто альдолаза). Назва ферменту альдолази походить від зворотної реакції альдольної конденсації[22]. Механізм проходження реакції зображений на схемі:
Хоча стандартна зміна вільної енергії під час розщеплення фруктозо-1,6-бісфосфату є позитивною й має велике абсолютне значення, в реальній клітині через низьку концентрацію фосфотріоз реакція легко проходить в обидва боки[23].
Описаний механізм реакції характерний тільки для альдолази класу I, поширеної у рослин та тварин. У клітинах бактерій та грибів є альдолаза класу II. Вона каталізує реакцію іншим шляхом[23].
Механізм реакції альдольного розщеплення демонструє важливість ізомеризації і в другій реакції гліколізу. Якби такому перетворенню підлягала альдоза (глюкоза), то утворилася б одна двокарбонова та одна чотирикарбонова сполука. Кожна з них мала б метаболізуватися своїм власним шляхом. Натомість трикарбонові сполуки, утворені при розщепленні кетози (фруктози), можуть легко перетворюватись одна на одну[24] і метаболізуються один шляхом.
Ізомеризація фосфотріоз[ред. | ред. код]
У подальших реакціях гліколізу бере участь тільки одна із фосфотріоз, утворених з фруктозо-1,6-бісфосфату, а саме гліцеральдегід-3-фосфат. Проте інший продукт — дигідроксиацетонфосфат — швидко і зворотно може перетворюватись на гліцеральдегід-3-фосфат (каталізує цю реакція тріозофосфатізомераза)[23].
Механізм реакції схожий на ізомеризацію глюкозо-6-фосфату у фруктозо-6-фосфат. Рівновага реакції зміщена в бік утворення дигідроксиацетонфосфату (96 %), проте через постійне витрачання гліцеральдегід-3-фосфату весь час відбувається зворотне перетворення[24].
Після перетворення двох «половинок» глюкози на гліцеральдегід-3-фосфат атоми карбону, що походять від її C-1, C-2 та C-3, стають хімічно тотожними C-6, C-5 та C-4 відповідно. Ця реакція завершує підготовчу стадію гліколізу[25].
Друга стадія[ред. | ред. код]
Окиснення гліцеральдегід-3-фосфату[ред. | ред. код]
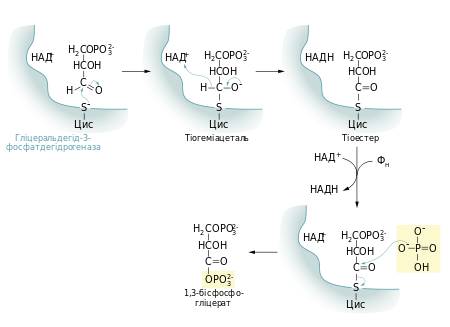
Першою реакцією стадії віддачі енергії гліколізу є окиснення гліцеральдегід-3-фосфату із одночасним його фосфорилюванням. Це здійснює фермент гліцеральдегід-3-фосфатдегідрогеназа. Альдегід перетворюється не на вільну кислоту, а на змішаний ангідрид із фосфатною кислотою (1,3-бісфосфогліцерат). Сполуки такого типу — ацилфосфати — мають дуже велику від'ємну зміну вільної енергії гідролізу (ΔG0 = −49,3 кДж/моль)[26].
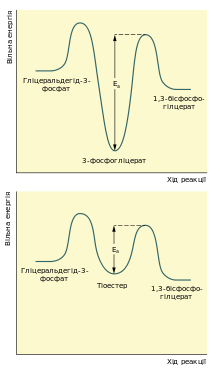
Реакцію перетворення гліцеральдегід-3-фосфату до 1,3-бісфосфогліцерату можна розглядати як два окремі процеси: окиснення альдегідної групи НАД+ та приєднання фосфатної групи до утвореної карбонової кислоти. Перша реакція термодинамічно вигідна (ΔG0 = −50 кДж/моль), друга, навпаки, невигідна. Зміна вільної енергії для другої реакції майже така сама, тільки ця зміна додатна. Якби вони відбувались послідовно одна за одною, то друга реакція вимагала б надто великої енергії активації, щоб перебігати в клітині з достатньою швидкістю. Але обидва процеси є спряженими тому, що проміжна сполука — 3-фосфогліцерат — ковалентно зв'язана із залишком цистеїну тіоестерним зв'язком в активному центрі ферменту. Такий тип зв'язку дозволяє «законсервувати» частину енергії, яка виділяється під час окиснення гліцеральдегід-3-фосфату, та використати її для реакції із ортофосфатною кислотою[27].
Для цієї стадії гліколізу необхідний кофермент НАД+. Його концентрація в клітині (менше 10−5М) значно менша, ніж кількість глюкози, що метаболізується за декілька хвилин. Тому в клітині постійно відбувається повторне окиснення НАД+[26].
Перенесення фосфатної групи 1,3-бісфосфогліцерату на АДФ[ред. | ред. код]
У наступній реакції великий запас енергії ацилфосфату використовується для синтезу АТФ. Ферменти фосфогліцераткіназа 1-го та 2-го типу (назва від зворотної реакції) каталізують перенесення фосфатної групи із 1,3-бісфосфогліцерату на АДФ з утворенням АТФ та 3-фосфогліцерату[28].
Такий тип синтезу АТФ, за якого використовується розчинна сполука з високим потенціалом перенесення фосфатної групи, називають сусбстратним фосфорилюванням на противагу окисному фосфорилюванню. Останнє відбувається під час аеробного окиснення у внутрішній мембрані мітохондрій[29][28].
Шоста та сьома реакції гліколізу спряжені між собою і 1,3-бісфосфогліцерат є спільним проміжним продуктом. Перша з них сама по собі була б ендергонічною, проте витрати енергії компенсуються другою реакцією — виражено екзергонічною[28]. Сумарне рівняння цих двох процесів можна записати так:
Слід зауважити, що для однієї молекули глюкози ця реакція відбувається двічі, оскільки з однієї молекули глюкози були утворені дві молекули гліцеральдегід-3-фосфату. Отже, на цьому етапі синтезуються дві молекули АТФ, і це компенсує енергетичні затрати першої стадії гліколізу.
Ізомеризація 3-фосфогліцерату[ред. | ред. код]
У восьмій реакції гліколізу фермент фосфогліцератмутаза у присутності іонів магнію каталізує перенесення фосфатної групи 3-фосфогліцерату з третього положення в друге. Внаслідок цього утворюється 2-фосфогліцерат. Реакція відбувається у два етапи. На першому з них фосфатна група, початково приєднана до залишку гістидину в активному центрі ферменту, переноситься на C-2 3-фосфогліцерату і утворюється 2,3-бісфосфогліцерат. На другому етапі фосфатна група у третьому положенні синтезованої сполуки переноситься на гістидин. Таким чином регенеруються фосфорильований фермент та продукується 2-фосфогліцерат[28][30].
Початкове фосфорилювання фосфогліцератмутази здійснюється реакцією із 2,3-бісфосфогліцерату, незначної концентрації якого достатньо для активації ферменту[28].
Дегідратація 2-фосфогліцерату[ред. | ред. код]
Наступна реакція — утворення енолу в результаті дегідратації (відщеплення води) 2-фосфогліцерату — веде до утворення фосфоенолпірувату (скорочено ФЕП). Процес каталізує фермент енолаза[en].
Це друга реакція утворення речовини із високим потенціалом перенесення фосфатної групи в процесі гліколізу. Зміна вільної енергії при гідролізі фосфатного естеру звичайного спирту значно нижча порівняно з такою зміною при гідролізі енолфосфату, зокрема для 2-фосфогліцерату ΔG0 = −17,6 кДж/моль, а для фосфоенолпірувату ΔG0 = −61,9 кДж/моль[31].
Перенесення фосфатної групи із ФЕП на АДФ[ред. | ред. код]
Останню реакція гліколізу — перенесення фосфатної групи з фосфоенолпірувату на АДФ — каталізує піруваткіназа[en] за наявності іонів K+ та Mg2+ або Mn2+. Продуктом цієї реакції є піруват, який спочатку утворюється в енольній формі, після чого швидко й неферментативно таутомеризується в кетонну форму[31].
Реакція має велику від'ємну зміну вільної енергії, головним чином, завдяки екзергонічому процесу таутомеризації[32]. Близько половини енергії (30,5 кДж/моль), що виділяється при гідролізі ФЕП (61,9 кДж/моль), використовується на субстратне фосфорилювання. Решта (31,5 кДж/моль) слугує рушійною силою, що штовхає реакцію в бік утворення пірувату та АТФ. За клітинних умов реакція є незворотною [31].
Сумарний вихід гліколізу[ред. | ред. код]
| Зміна вільної енергії в реакціях гліколізу в еритроцитах[33] | ||
|---|---|---|
| Реакція | ΔG0 (кДж/моль) |
ΔG (кДж/моль) |
| Глюкоза + АТФ → глюкозо-6-фосфат + АДФ | −16,7 | −33,4 |
| Глюкозо-6-фосфат ↔ фруктозо-6-фосфат | 1,7 | від 0 до 25 |
| Фруктозо-6-фосфат + АТФ → фруктозо-1,6-бісфосфат + АДФ | −14,2 | −22,2 |
| Фруктозо-1,6-бісфосфат ↔ гліцеральдегід-3-фосфат + дигідроксиацетонфосфат | 28,3 | від −6 до 0 |
| Дигідроксиацетонфосфат ↔ гліцеральдегід-3-фосфат | 7,5 | від 0 до 4 |
| Гліцеральдегід-3-фосфат + Фн + НАД+ ↔ 1,3-бісфосфогліцерат + НАДН + H+ | 6,3 | від −2 до 2 |
| 1,3-Бісфосфогліцерат + АДФ ↔ 3-фосфогліцерат + АТФ | −18,8 | від 0 до 2 |
| 3-Фосфогліцерат ↔ 2-фосфогліцерат | 4,4 | від 0 до 0,8 |
| 2-Фосфогліцерат ↔ фосфоенолпіруват + H2O | 7,5 | від 0 до 3,3 |
| Фосфоенолпіруват + АДФ → піруват + АТФ | −31,4 | −16,7 |
| Жовтим виділені реакції, незворотні в реальних умовах клітини | ||
Загальне рівняння гліколізу має такий вигляд:
Сумарна кількість енергії, що виділяється внаслідок розщеплення глюкози до пірувату становить 146 кДж/моль, на синтез двох молекул АТФ витрачається 61 кДж/моль, решта (85 кДж/моль) перетворюється на тепло[34].
При повному окисненні глюкози до вуглекислого газу та води виділяється 2 840 кДж/моль[35]. Якщо порівняти це із загальним виходом екзергонічних реакцій гліколізу (146 кДж/моль), стає зрозуміло, що 95 % енергії глюкози залишається «ув'язненою» у молекулах пірувату. Хоча реакції гліколізу є універсальними майже для всіх організмів, подальша доля його продуктів — пірувату та НАДН — відрізняється у різних живих істот та залежить від умов.
В аеробних організмів за достатньої концентрації кисню НАД+ регенерується шляхом передачі електронів в електронтранспортний ланцюг, який в еукаріот розташований у внутрішній мембрані мітохондрій. Кінцевим акцептором електронів при цьому є кисень. Піруват зазнає окисного декарбоксилювання, перетворюється у ацетил-КоА і надходить у цикл Кребса, де відбувається його подальше окиснення. Відщеплені електрони також потрапляють в електронтранспортний ланцюг.
З іншого боку в анаеробних умовах відновлений НАДН не може передати свої електрони на кисень. Тому є два варіанти їхнього перенесення:
- безпосередньо назад на молекулу пірувату як у процесі молочнокислого бродіння;
- на продукти його перетворення,, наприклад, на ацетальдегід у випадку спритового бродіння.
Анаеробний метаболізм глюкози дає значно менше енергії, ніж аеробний[32].
Включення інших вуглеводів у процес гліколізу[ред. | ред. код]
Окрім глюкози у процесі гліколізу зазнають перетворень ще чимало вуглеводів. Найважливішими з них є полісахариди крохмаль та глікоген, дисахариди сахароза, лактоза, мальтоза та трегалоза, а також моносахариди — фруктоза, галактоза та маноза[36].
Полісахариди[ред. | ред. код]

Полісахариди, що включаються в процес гліколізу, можуть мати різне походження, від чого залежить їхня доля. Крохмаль та глікоген, що потрапляють в організм тварин із їжею, піддаються гідролізу до мономерів (глюкози) у травній системі. У людини їхнє розщеплення починається у ротовій порожнині, продовжується у дванадцятипалій кишці і завершується утворенням глюкози біля стінок тонкого кишківника. Тут вона і всмоктується в кров, звідки може поглинатись клітинами і використовуватись у процесі гліколізу[36].
Ендогенні запасні полісахариди рослин (крохмаль), тварин і грибів (глікоген) включаються в гліколіз іншим шляхом. Вони зазнають не гідролізу, а фосфоролізу. Його здійснюють ферменти фосфорилаза крохмалю та глікогенфосфорилаза відповідно. Вони каталізують атаку фосфатної кислоти на глікозидний α1→4 зв'язок між останнім та передостаннім залишками глюкози з нередукуючого кінця. Продуктом реакції є глюкозо-1-фосфат. Глюкозо-1-фосфат перетворюється фосфоглюкомутазою на глюкозо-6-фосфат, який є проміжним метаболітом гліколізу. Механізм такого перетворення схожий на ізомеризацію 3-фосфогліцерату до 2-фосфогліцерату. Фосфороліз внутрішньоклітинних полісахаридів вигідний тим, що дозволяє зберегти частину енергії глікозидних зв'язків завдяки утворенню фосфорильованого моносахариду. Таким чином заощаджується одна молекула АТФ на одну молекулу глюкози[37].
Дисахариди[ред. | ред. код]
Як і полісахариди, дисахариди перед всмоктуванням мають бути гідролізовані до моносахаридів. У людини процес каталізують ферменти зовнішнього боку клітин епітелію тонкого кишківника. Сахарозу розщеплює сахараза, мальтозу — мальтаза, трегалозу — трегалаза, лактозу — лактаза.
Лактоза — це дисахарид молока, яке більшість ссавців вживають лише у ранньому дитинстві. Експресія гена лактази суттєво знижується у дорослих ссавців, в тому числі й в людини. Це призводить до непереносності лактози — неперетравлений дисахарид стає поживою для мікроорганізмів, товстого кишківника. Вони розмножуються, виділяють велику кількість газів (водню та метану), молочної кислоти, що підвищує осмотичність вмісту кишки. Виникає здуття, метеоризм, біль і діарея. Від несприйнятливості лактози не страждають популяції людей на півночі Європи та в деяких районах Африки. Вони набули корисної здатності синтезувати фермент лактазу впродовж усього життя[38][39].
Моносахариди[ред. | ред. код]
У більшості організмів нема окремих шляхів для утилізації фруктози, галактози та манози. Всі ці сполуки перетворюються на фосфорильовані похідні й піддаються гліколізу. Фруктоза потрапляє в організм людини з фруктами та внаслідок розщеплення сахарози в більшості тканин, крім печінки, наприклад у м'язах та нирках. Вона фосфорилюється гексокіназою до фруктозо-6-фосфату із використанням однієї молекули АТФ. У печінці шлях перетворення інший: спочатку фруктокіназа переносить фосфатну групу на C-1 фруктози, потім утворений фруктозо-1-фосфат розщеплюється фруктозо-1-фосфатальдолазою до гліцеральдегіду та дигідроксиацетонфосфату. Обидві тріози перетворюються у гліцеральдгед-3-фосфат: перша — під впливом тріозокіназа, друга — під впливом гліколітичного ферменту тріозофосфатізомераза[38][40].
Галактоза утворюється внаслідок розщеплення молочного цукру. Вона надходить до печінки і там перетворюється на глюкозо-6-фосфат за чотири кроки:
- галактокіназа каталізує фосфорилювання у першому положенні;
- на утворений галактозо-1-фосфат переноситься уридильна група із УДФ-глюкози за участю ферменту галактозо-1-фосфатуридилтрансферази. Продуктами цієї реакції є глюкозо-1-фосфат та УДФ-галактоза.
- глюкозо-1-фосфат під впливом фосфоглюкомутази перетворюється на глюкозо-6-фосфат і поступає в гліколіз;
- УДФ-галактоза використовується для регенерації УДФ-глюкози, що каталізується УДФ-галактоза-4-епімеразою[41].
Нестача будь-якого з ферментів перетворення галактози на глюкозу викликає захворювання галактоземію. Брак різних ферментів матиме різні наслідки. Наприклад, коли «не працює» галактокіназа, розвиваються катаракти у немовлят. Причиною стає відкладання у кришталику ока метаболіту галактози — галактитолу. Решта симптомів порівняно легкі й усуваються обмеженням вживання лактози та галактози. Порушення функціонування трансферази та епімерази призводить до серйозніших наслідків: дефектів у розвитку нервової системи, ушкодження печінки, що може бути летальним[38][39].
Джерело манози — різні полісахариди та глікопротеїни їжі. Вона фосфорилюється у шостому положенні гексокіназою, після чого може бути ізомеризована до фруктозо-6-фосфату фосфоманозоізомеразою[38].
Регуляція гліколізу[ред. | ред. код]
Вивчаючи бродіння у дріжджів, Луї Пастер помітив, що швидкість поглинання і загальна кількість використаної клітинами глюкози значно збільшуються за анаеробних умов порівняно з аеробними. Це явище одержало назву ефекту Пастера. Причини феномену стали зрозумілими після детальнішого вивчення катаболізму.
Виявилося, що за наявності кисню відбувається повне окиснення глюкози до вуглекислого газу та води. Це супроводжується синтезом 30—32 молекул АТФ на одну молекулу глюкози. За відсутності кисню бродіння дає тільки 2 молекули АТФ на молекулу глюкози. Отже, в анаеробних умовах клітині потрібно спожити у 15 разів більше глюкози, щоб отримати таку саму кількість АТФ[42].
Ефект Пастера свідчить про те, що швидкість гліколізу залежить від умов. Тобто процес регулюється залежно від метаболічних потреб клітини. Це дозволяє підтримувати концентрацію АТФ на приблизно стабільному рівні і забезпечувати за необхідності будівельні блоки для інших метаболічних шляхів. Моментальна регуляція може відбуватись завдяки зміні активності трьох ферментів: гексокінази, фосфофруктокінази та піруваткінази. Всі вони каталізують незворотні реакції і не беруть участі у процесі глюконеогенезу. Довготриваліші зміни швидкості гліколізу забезпечують гормони глюкагон, адреналін, інсулін, а також зміни експресії генів гліколітичних ферментів[42][43].
Гексокіназа[ред. | ред. код]

У людини є чотири різні за властивостями ізоформи ферменту гексокінази (I—IV).
Гексокіназа II, яка переважає в м'язовій тканині, має високу спорідненість до свого субстрату — глюкози. Вже при концентрації 0,1 мілімоль/л, що в 40—50 разів менше за вміст глюкози у крові, фермент наполовину насичується. Завдяки цьому гексокіназа II може працювати з максимальною інтенсивністю. Разом із гексокіназою I, також наявною у м'язах, гексокіназа II алостерично й оборотно інгібується продуктом реакції, яку вона каталізує, — глюкозо-6-фосфатом. Отже, коли гліколіз сповільнюється на подальших стадіях, у клітині накопичується глюкозо-6-фосфат. Він пригнічує реакцію власного утворення, і глюкоза більше не затримується в клітині[44][45].
У печінці інший ізоферментний склад гексокінази. Там переважає гексокіназа IV, яку ще називають глюкокіназою. Вона відрізняється від інших ізоформ трьома особливостями:
- має низьку спорідненість до глюкози, константа Міхаеліса становить 10 мілімоль/л, що перевищує нормальний вміст глюкози в крові;
- її активність не пригнічується глюкозо-6-фосфатом;
- існує спеціальний регуляторний білок, наявний тільки в клітинах печінки. Він гальмує гексокіназу IV, заякорюючи її в ядрі, де вона відділена від інших ферментів гліколізу. Цей білок діє ефективніше за наявності фруктозо-6-фосфату. Натомість, великі концентрації глюкози послаблюють його ефект[46].
Набір таких властивостей дозволяє гексокіназі IV ефективно регулювати рівень глюкози в крові. За звичайних умов, коли він не перевищує норми (4—5 мілімоль/л), гексокіназа неактивна, загальмована регуляторним білком у ядрі і не може каталізувати фосфорилювання. Тому печінка не конкурує з іншими органами за глюкозу, а новоутворені в глюконеогенезі молекули можуть вільно надходити в кров. Коли ж рівень глюкози в крові зростає (наприклад після вживання їжі, багатої на вуглеводи), глюкоза швидко транспортується за допомогою переносника GLUT2 у гепатоцити і спричиняє дисоціацію гексокінази й регуляторного білка. Після цього фермент може каталізувати реакцію фосфорилювання[46].
Гексокіназа IV також регулюється на рівні біосинтезу білка. Її кількість у клітині збільшується, коли зростають енергетичні потреби, про що може свідчити низька концентрація АТФ, висока концентрація АМФ тощо.
Фосфофруктокіназа[ред. | ред. код]



ФФК-1 — найважливіший регуляторний фермент гліколізу. Він не лише каталізує незворотне перетворення, а й є першим ензимом, що однозначно спрямовує метаболіти на гліколітичне розщеплення (глюкозо-6-фосфат та фруктозо-6-фосфат можуть використовуватись в інших метаболічних шляхах)[47][45]. Як алостеричний фермент ФФК-1, крім активного центру, містить також центри зв'язування позитивних та негативних модуляторів (активаторів та інгібіторів), до них належать:
- АТФ, АДФ, АМФ. АТФ є не тільки субстратом, а й інгібітором для ФФК-1. Коли споживання цієї молекули відбувається повільніше, ніж її синтез, вона приєднується до алостеричного центру ферменту і знижує спорідненість ФФК-1 до фруктозо-6-фосфату. Концентрація АДФ та АМФ підвищується у разі інтенсивного використання АТФ. Вони діють як активатори, послаблюючи вплив АТФ на ФФК-1. У такий спосіб регулюється активність фосфофруктокінази в усіх тканинах[48].
- Кислотність. У м'язах активність ФФК-1 залежить від кислотності середовища. Внаслідок інтенсивного анаеробного розщеплення глюкози під час великих навантажень, у м'язових волокнах накопичується лактат. Це призводить до зниження pH до рівня, що загрожує ушкодженням тканини. В таких умовах ФФК-1 знижує свою активність, призупиняючи гліколіз. У печінці відсутній такий механізм регуляції цього ферменту, оскільки там не відбувається синтезу молочної кислоти[49].
- Цитрат є проміжним метаболітом циклу трикарбонових кислот. Його високий вміст у цитоплазмі свідчить про те, що клітина отримує потрібну енергію від окиснення ліпідів та білків[50] і про достатню кількість біосинтетичних попередників. Отже, нема потреби у розщепленні глюкози для синтезу АТФ чи отримання «будівельних блоків» для процесів анаболізму, тому цитрат діє як інгібітор фосфофруктокінази, підсилюючи вплив на неї АТФ[50].
- Фруктозо-2,6-бісфосфат (Ф-2,6-БФ) стимулює ФФК-1 у печінці, його дія пов'язана з регулюванням рівня глюкози в крові. Концентрація Ф-2,6-БФ залежить від активності біфункціонального ферменту ФФК-2/ФБФ-2 (фосфофруктокіназа-2/фруктозо-2,6-бісфосфатаза). Це може здійснювати як фосфорилювання фрутозо-6-фосфату з утворенням Ф-2,6-БФ (кіназна активність), так і гідроліз останнього (фосфатазна активність). «Перемикання» активностей ФФК-2/ФБФ-2 відбувається шляхом його фосфорилювання/дефосфорилювання. Фосфорильована форма працює як фосфатаза, дефосфорильована — як кіназа. Гормон інсулін, що зменшує рівень глюкози в крові, через низку посередників стимулює кіназну активність біфункціонального ферменту. Внаслідок цього концентрація Ф-2,6-БФ зростає, і ця сполука активує ФФК-1, а отже і проходження гліколізу. З іншого боку, глюкагон, навпаки, активує фосфотазну активність ФФК-2/ФБФ-2. Це справляє протилежний вплив на гліколітичне розщеплення глюкози[50]. На активність біфункціонального ферменту також впливає ксилулозо-5-фосфат (проміжний продукт пентозофосфатного шляху), який стимулює кіназну активність і цим пришвидшує гліколіз. Ця регуляторна молекула важлива для активації синтезу жирних кислот в гепатоцитах, коли в крові підвищується рівень глюкози[50].
Деякі з модуляторів активності ФФК-1 впливають також на фермент фруктозо-1,6-бісфосфатазу, яка каталізує у глюконеогенезі реакцію перетворення фруктозо-1,6-бісфосфату на фруктозо-6-фосфат. Але вони діють протилежним чином: її інгібує АМФ і Ф-2,6-БФ. Отже активація гліколізу в клітині супроводжується пригніченням глюконеогенезу і навпаки. Це необхідно для запобіганню зайвим затратам енергії у так званих субстратних циклах[en][44].
Піруваткіназа[ред. | ред. код]
У ссавців знайдено щонайменше три ізоферменти піруваткінази, що експресуються в різних тканинах. Ці ізоферменти мають багато спільного. Наприклад, усі вони пригнічуються високими концентраціями ацетил-КоА, АТФ та довголанцюговими жирними кислотами — показники того, що клітина добре забезпечена енергією [51], а також аланіном (амінокислота, що синтезується з пірувату)[45]. Фруктозо-1,6-бісфосфат активує різні ізоферменти піруваткінази[45]. Проте печінкова ізоформа (піруваткіназа L) відрізняється від м'язової (піруваткінази M) наявністю ще одного способу регуляції — шляхом ковалентної модифікації фосфатною групою. У відповідь на низький рівень глюкози в крові підшлунковою залозою виділяється глюкагон, що активує цАМФ-залежну протеїнкіназу. Цей фермент фосфорилює піруваткіназу L, внаслідок чого остання втрачає свою активність. Отже гліколітичне розщеплення глюкози у печінці уповільнюється й глюкозу можуть використовувати інші органи[51].
Гліколіз у ракових клітинах[ред. | ред. код]

1928 року Отто Варбург виявив, що у майже всіх типів ракових клітин гліколіз та поглинання глюкози відбуваються приблизно в 10 разів інтенсивніше ніж у здорових, навіть за великих концентрацій кисню. Ефект Варбурга[en] став основою для розробки кількох методів виявлення та лікування раку[42].
Усі ракові клітини, принаймні на початкових етапах розвитку пухлини, ростуть за умов гіпоксії, тобто нестачі кисню, через відсутність сітки капілярів. Якщо вони розташовані на відстані більше 100—200 мкм від найближчої кровоносної судини, то мають «покладатися» тільки на гліколіз без подальшого окиснення пірувату для отримання АТФ. Імовірно, що майже у всіх ракових клітинах у процесі злоякісної трансформації відбуваються такі зміни: перехід на отримання енергії тільки шляхом гліколізу та пристосування до умов підвищеної кислотності, що виникають внаслідок виділення молочної кислоти у міжклітинну рідину. Чим агресивніша пухлина, тим швидше в ній відбувається гліколіз[52].
Пристосування ракових клітин до нестачі кисню великою мірою відбувається завдяки транскрипційному фактору, індукованому гіпоксією (HIF-1). Він стимулює підвищення експресії як мінімум восьми генів гліколітичних ферментів, а також транспортерів глюкози GLUT1 та GLUT3, активність яких не залежить від інсуліну. Ще одним ефектом HIF-1 є виділення клітинами судинного ендотеліального фактору росту[en]. Він стимулює утворення кровоносних судин у пухлині[52]. HIF-1 також виділяється м'язами під час тренувань, що передбачають велику інтенсивність навантаження. У цьому випадку він має аналогічний ефект: підсилює здатність до анаеробного синтезу АТФ та стимулює ріст капілярів[53].
У деяких випадках підвищена інтенсивність гліколізу може бути застосована для виявлення пухлини за допомогою позитрон-емісійної томографії (ПЕТ). Пацієнту в кров вводять аналог глюкози 2-флюоро-2-дезоксиглюкозу[en] (ФдГ), мічений ізотопом 18F. Ця речовина поглинається клітинами і є субстратом для першого ферменту гліколізу — гексокінази, проте не може бути перетворена фосфоглюкоізомеразою, тому накопичується в цитоплазмі. Швидкість накопичення залежить від інтенсивності захоплення аналога глюкози та його фосфорилювання. Обидва процеси значно швидше відбуваються в ракових клітинах, ніж у здорових. При розпаді 18F виділяються позитрони, які фіксуються спеціальними сенсорами[54].
Особливості катаболізму глюкози у злоякісних пухлинах застосовують не лише для діагностики, а й для розробки нових протиракових препаратів. Серед них: інгібітори гексокінази (2-дезоксиглюкоза[en], лонідамін[en], 3-бромпіруват[en]), іматиніб (Gleevec) (він пригнічує певну тирозинкіназу, яка стимулює синтез гексокінази) тощо[54].
Примітки[ред. | ред. код]
- ↑ а б Campbell et al, 2008, с. 167.
- ↑ а б в г д е ж и Nelson et al, 2008, с. 528.
- ↑ а б Berg et al, 2007, с. 434.
- ↑ Нобелівська премія з хімії 1907 року [Архівовано 14 травня 2012 у Wayback Machine.] на сайті Nobelprize.org — Процитовано 5 квітня 2012.
- ↑ Нобелівська премія з хімії 1929 року [Архівовано 28 березня 2014 у Wayback Machine.] на сайті Nobelprize.org — Процитовано 5 квітня 2012
- ↑ Нобелівська премія з медицини та фізіології 1922 року [Архівовано 2012-10-15 у Wayback Machine.] на сайті Nobelprize.org — Процитовано 5 квітня 2012.
- ↑ Alberts et al, 2007, с. 88.
- ↑ Marieb EN, Hoehn K (2006). Human Anatomy & Physiology (вид. 7th). Benjamin Cummings.
- ↑ N. V. Bhagavan (26 вересня 2001), Medical Biochemistry, Academic Press, с. 225—235, ISBN 978-0-08-051139-9
- ↑ а б в Berg et al, 2007, с. 435.
- ↑ Goyal, Manu S.; Hawrylycz, Michael; Miller, Jeremy A.; Snyder, Abraham Z.; Raichle, Marcus E. (2014). Aerobic Glycolysis in the Human Brain Is Associated with Development and Neotenous Gene Expression. Cell Metabolism. 19 (1): 49—57. doi:10.1016/j.cmet.2013.11.020. ISSN 1550-4131.
- ↑ Vinay Pasupuleti (2007), Role of glycolisis and respiration in sperm metabolism and motility, A thesis for Master degree submitted to Kent State University, архів оригіналу за 20 серпня 2016, процитовано 16 липня 2016
{{citation}}: Cite має пусті невідомі параметри:|7=та|6=(довідка) - ↑ Prescott, 2002, с. 179.
- ↑ Губський, 2007, с. 191.
- ↑ Prescott, 2002, с. 176.
- ↑ Alberts et al, 2007, с. 89.
- ↑ а б Nelson et al, 2008, с. 530.
- ↑ а б в г д Nelson et al, 2008, с. 532.
- ↑ Campbell et al, 2008, с. 168.
- ↑ Berg et al, 2007, с. 437.
- ↑ а б в Nelson et al, 2008, с. 533.
- ↑ Berg et al, 2007, с. 438.
- ↑ а б в Nelson et al, 2008, с. 534.
- ↑ а б Berg et al, 2007, с. 439.
- ↑ Nelson et al, 2008, с. 535.
- ↑ а б Nelson et al, 2008, с. 536.
- ↑ Berg et al, 2007, с. 442.
- ↑ а б в г д Nelson et al, 2008, с. 537.
- ↑ Berg et al, 2007, с. 443.
- ↑ Berg et al, 2007, с. 445.
- ↑ а б в Nelson et al, 2008, с. 538.
- ↑ а б Berg et al, 2007, с. 446.
- ↑ Nelson et al, 2008, с. 553.
- ↑ Nelson et al, 2008, с. 531.
- ↑ Nelson et al, 2008, с. 527.
- ↑ а б Nelson et al, 2008, с. 543.
- ↑ Nelson et al, 2008, с. 544.
- ↑ а б в г Nelson et al, 2008, с. 545.
- ↑ а б Berg et al, 2007, с. 451.
- ↑ Berg et al, 2007, с. 449.
- ↑ Berg et al, 2007, с. 450.
- ↑ а б в Nelson et al, 2008, с. 539.
- ↑ Berg et al, 2007, с. 452.
- ↑ а б Nelson et al, 2008, с. 583.
- ↑ а б в г Berg et al, 2007, с. 454.
- ↑ а б Nelson et al, 2008, с. 584—585.
- ↑ Nelson et al, 2008, с. 585.
- ↑ Nelson te al, 2008, с. 586.
- ↑ Berg et al, 2007, с. 453.
- ↑ а б в г Nelson, 2008, с. 586.
- ↑ а б Naelson et al, 2008, с. 589.
- ↑ а б Nelson et al, 2008, с. 540.
- ↑ Berg et al, 2007, с. 458.
- ↑ а б Nelson et al, 2008, с. 541.
Джерела[ред. | ред. код]
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5. Архів оригіналу за 22 липня 2011. Процитовано 6 травня 2012. (англ.)
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5. (англ.)
- Campbell NA, Reece JB (2008). Biology (вид. 8th). Benjamin Cammings. ISBN 978-0321543257. Архів оригіналу за 3 березня 2011. Процитовано 6 травня 2012. (англ.)
- Marieb EN, Hoehn K (2006). Human Anatomy & Physiology (вид. 7th). Benjamin Cummings. ISBN 978-0805359091. (англ.)
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1. (англ.)
- Prescott L.M. (2002). Microbiology (вид. 5th). McGraw−Hill. ISBN 0-07-282905-2. (англ.)
- Губський Ю.І. (2007). Біологічна хімія. Київ-Вінниця: Нова книга. с. 191. ISBN 978-966-382-017-0.
Посилання[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Гліколіз |
- Glycolysis / Gluconeogenesis [Архівовано 15 травня 2012 у Wayback Machine.] у базі даних KEGG Pathway (англ.)
- Glycolytic Enzymes Molecule of the Month на сайті Protein Data Base (англ.)
- Деталізована анімація гліколітичних реакцій [Архівовано 29 лютого 2012 у Wayback Machine.] Donald Nicholson. (англ.)
- Спрощена анімація гліколітичних реакцій [Архівовано 21 травня 2012 у Wayback Machine.] Cell Biology Laboratory. (англ.)
- Гліколіз [Архівовано 10 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||
|
|
|
Ця стаття належить до добрих статей української Вікіпедії. |