Хлорати
| Хлорати | |
 | |
 | |
| Маса | 1,4E−25 кг[1] |
|---|---|
| Спряжена кислота | Хлоратна кислота |
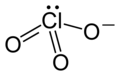
| Хімічна формула | ClO₃⁻ |
| Канонічна формула SMILES | [O-]Cl(=O)=O[1] |
| | |

Хлора́ти — група хімічних сполук, солі хлоратної кислоти HClO3. Дані сполуки є білими, легкорозчинними кристалами. При спіканні проявляють сильні окисні властивості і дещо менші у розчинах. Хлорати мають здатність до детонації і є токсичними речовинами.
Застосовуються як окисники в піротехніці, у синтезі ClO2 та як гербіциди.
Хлорат-аніон має структуру тригональної піраміди (d(Cl-О) = 0,1452-0,1507 нм, кут O-Cl-O = 106°). Аніон ClO–
3 не утворює ковалентних зв'язків через атом О і не схильний утворювати координаційні зв'язки.
Будова та фізичні властивості[ред. | ред. код]

Хлорати є, як правило, кристалічними речовинами, розчинними у воді та деяких полярних органічних розчинниках. В твердому стані при кімнатній температурі досить стабільні. При нагріванні в присутності каталізатору розкладаються з виділенням кисню.
З горючими речовинами можуть утворювати вибухові суміші. Хлорати є сильними окисниками як у розчині, так і в твердому стані: суміші безводних хлоратів із сіркою, вугіллям та іншими відновниками, вибухають при швидкому нагріванні і ударі. Хлорати металів змінної валентності зазвичай нестійкі і схильні до вибухового розпаду. Всі хлорати лужних металів розкладаються з виділенням великої кількості тепла на хлориди і кисень, з проміжним утворенням перхлоратів.
Хлорати більшості металів отримані у вигляді гідратів, в безводному стані виділені хлорати лужних та лужноземельних металів, Ag, Tl(I), Pb(II), а також NH4ClO3, N(CH3)4ClO3.
Одержання[ред. | ред. код]
У промислових масштабах хлорати (в першу чергу, натрію та меншою мірою калію) добувають шляхом електролізу водних розчинів відповідних хлоридів:
Менш поширені хлорати, наприклад, хлорати важких металів, добувають реакцією обміну:
Практично втратив своє значення давній спосіб отримання хлоратів, який полягає у пропусканні хлору крізь розчини гідроксидів металів. Реакцію проводять із гарячими розчинами, в іншому випадку замість хлоратів утворюватимуться гіпохлорити.
Хімічні властивості[ред. | ред. код]
При нагріванні хлорати розкладаються; продукти реакції залежать від умов: просте нагрівання спричинює диспропорціонують з утворенням хлоридів та перхлоратів, а в присутності каталізатору (MnO2) утворюються хлорид металу та виділяється кисень:
При взаємодії солей з концентрованою хлоридною кислотою виділяється хлор:
Реакція хлоратів із відновниками (на кшталт метанолу або діоксиду сірки) є основою для синтезу оксиду хлору(IV):
Застосування[ред. | ред. код]
Основним застосуванням хлоратів є синтез оксиду хлору(IV) для відбілювання тканин і паперу. Деякі хлорати, наприклад, хлорат амонію NH4ClO3, використовуються як окисники у виробництві твердих пропелентів та очистці урану.
Хлорат калію широко використовується у виготовленні піротехніки, сірників, косметики тощо. Над більш поширеним хлоратом натрію він має перевагу у значно меншій гігроскопічності. Хлорат кальцію застосовується як гербіцид.
Також із хлоратів добувають невеликі кількості кисню для потреб лабораторій.
Див. також[ред. | ред. код]
Посилання[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Хлорати |
Джерела[ред. | ред. код]
- Wintzer P. Chlorine Oxides and Chlorine Oxygen Acids // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 21—34. — DOI: (англ.)
- Луцевич Д. Д. Довідник з хімії / За ред. акад. Б. С. Зіменковського. — Львів : НВФ «Українські технології», 2003. — 282 c.
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)







