Епігенетичне перепрограмування
Епігенетичне перепрограмування — стирання та ремоделювання епігенетичних позначок в молекулах ДНК, таких як сайти метилювання ДНК, — під час природнього розвитку організму, або в культурі клітин задля перетворення одного типу клітин на інший.[1] Такий контроль також часто пов'язаний з модифікаціями гістонів, що, загалом, змінює активність певних генів, на рівні епігенома (див. Епігеноміка).
Феномен клітинного перепрограмування — здатність перетворювати один тип клітин в інший — викликав зміну парадигм в галузі молекулярної біології, що має далекосяжні наслідки для регенеративної медицини, моделювання захворювань і розуміння біології розвитку та клітинної ідентичності видів.

Тіло людини містить, за деякими оцінками, 400 основних типів клітин[en] у 60 підтипах тканин[2] — але кожен тип клітин має однакову геномну послідовність ДНК — їх відрізняють саме зміни в епігеномі.
Першою людиною, яка успішно продемонструвала перепрограмування, був Джон Гердон, який у 1962 році продемонстрував, що диференційовані соматичні клітини можуть бути перепрограмовані назад у ембріональний стан, коли йому вдалося отримати плаваючих пуголовків після перенесення диференційованих кишкових епітеліальних клітин у без’ядерні жаб’ячі яйця.[3] За це досягнення він отримав Нобелівську премію з медицини 2012 року разом із Сін'я Яманакою.[4] Яманака був першим, хто продемонстрував (у 2006 році), що цей процес перенесення ядра соматичної клітини або процес перепрограмування ооцитів (див. нижче), який виявив Гердон, можна повторити (на мишах) за допомогою певних факторів (Oct4, Sox2, Klf4 та c -Myc) для створення індукованих плюрипотентних стовбурових клітин (iPSC).[5] Також, з тією ж метою використовувалися інші комбінації генів, включаючи LIN25[6] і білок Homeobox NANOG[6][7]; та комбінації хімічних речовин[8].

Розуміння клітинної ідентичності починається з класифікації різних типів клітин і ліній їх розвитку. Клітини в організмі є високоспеціалізованими, вони виконують різні функції, життєво важливі для загальної фізіології.
Тіло людини містить, за деякими оцінками, 400 основних типів клітин[en] у 60 підтипах тканин[2] — але кожен тип клітин має однакову геномну послідовність ДНК — їх відрізняють саме зміни в епігеномі.
Клітинна ідентичність глибоко переплетена з концепцією клітинної диференціації, коли стовбурові клітини стають спеціалізованими для виконання певних функцій в організмі. Процес диференціації організований точними генетичними та епігенетичними регуляторними механізмами, які гарантують, що кожен тип клітин зберігає свої унікальні характеристики. Ця концепція є наріжним каменем біології розвитку.
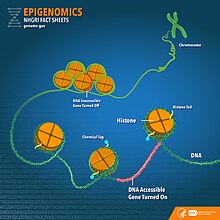
Основа клітинної ідентичності виходить за межі генетичної інформації, закодованої в послідовності ДНК. Епігенетика та епігеноміка є ключовими аспектами, які керують клітинною диференціацією. Епігенетичні модифікації, такі як метилювання ДНК, модифікації гістонів і роль некодуючих РНК, відіграють ключову роль у визначенні моделей експресії генів.
Розуміння концепції епігенетичної спадковості[en] є життєво важливим для оцінки ролі епігенетичних модифікацій у підтримці клітинної ідентичності через покоління. Епігенетичні зміни можуть передаватися від одного покоління до наступного і на них можуть впливати фактори навколишнього середовища та способу життя, потенційно впливаючи на здоров’я майбутніх поколінь.
Масштабні (від 10% до 100% епігенетичних позначок) і швидкі (від годин до кількох днів) перепрограмування відбуваються на трьох етапах життя ссавців. Майже 100% епігенетичних ознак перепрограмуються протягом двох коротких періодів на початку розвитку після запліднення яйцеклітини сперматозоїдом.[9][10][11][12] Окрім цих трьох етапів, зміни до майже 10% метилювання ДНК в нейронах гіпокампу можуть відбуватись під час досвіду, що викликає формування в пам'яті сильної енграми, емоційно забарвленої страхом.[13]
Після запліднення у ссавців моделі метилювання ДНК значною мірою стираються, а потім відновлюються під час раннього ембріонального розвитку. Майже всі метилювання від батьків стираються, спочатку під час раннього ембріогенезу, а потім знову в гаметогенезі, де кожного разу відбуваються деметилювання та реметилювання. Деметилювання під час раннього ембріогенезу відбувається в передімплантаційний період. Після запліднення сперматозоїдом яйцеклітини з утворенням зиготи відбувається швидке деметилювання батьківської ДНК і повільніше деметилювання материнської ДНК до утворення морули, яка майже не має метилювання. Після утворення бластоцисти може початися метилювання, а з утворенням епібласта відбувається хвиля метилювання до стадії імплантації ембріона[en]. Інший період швидкого і майже повного деметилювання відбувається під час гаметогенезу в примордіальних зародкових статевих клітинах. За винятком цих статевих клітин, на постімплантаційній стадії моделі метилювання в соматичних клітинах є стадійно- тканиноспецифічними зі змінами, які, імовірно, визначають кожен окремий тип клітини[en] та зберігаються стабільно протягом тривалого часу.[14]

Геном сперми миші на 80–90% метильований у CpG-сайтах у ДНК, що становить близько 20 мільйонів метильованих сайтів.[15][16] Після запліднення батьківська хромосома майже повністю деметилюється[en] за шість годин активним процесом перед реплікацією ДНК (синя лінія на малюнку). У зрілому ооциті близько 40% його сайтів CpG метильовані. Деметилювання материнської хромосоми в основному відбувається шляхом блокування дії метилюючих ферментів на ДНК материнського походження та розведення метильованої материнської ДНК під час реплікації (червона лінія на малюнку). Морула (на стадії 16 клітин) має лише невелику кількість метилювання ДНК (чорна лінія на малюнку). Метилювання починає збільшуватися через 3,5 дня після запліднення в бластоцисті, а потім велика хвиля метилювання відбувається на 4,5-5,5 день в епібласті, переходячи від 12% до 62% метилювання та досягаючи максимального рівня після імплантації в матці.[17] На сьомий день після запліднення новоутворені примордіальні зародкові статеві клітини (PGC) в імплантованому ембріоні відокремлюються від решти соматичних клітин. У цей момент PGC мають приблизно такий же рівень метилювання, як і соматичні клітини.
Новоутворені примордіальні зародкові клітини (PGC) в імплантованому ембріоні походять від соматичних клітин. У цей момент PGCs мають високий рівень метилювання. Ці клітини мігрують від епібласта до гонадного гребеня[en]. На цьому етапі клітини швидко розмножуються і починають деметилювання двома хвилями. У першій хвилі деметилювання відбувається шляхом реплікативного розведення, але в другій хвилі деметилювання відбувається в результаті активного процесу. Друга хвиля призводить до деметилювання специфічних локусів. На цьому етапі геноми PGC демонструють найнижчий рівень метилювання ДНК серед будь-яких клітин за весь життєвий цикл [на 13,5 день ембріона (E13.5), див. другий малюнок у цьому розділі].[18]

Після запліднення деякі клітини новоутвореного ембріона мігрують до гонадного гребаня і згодом стають статевими клітинами (сперматозоїдами і яйцеклітинами) наступного покоління. Завдяки феномену геномного імпринтингу материнський і батьківський геноми позначаються по-різному і повинні бути належним чином перепрограмовані кожного разу, коли вони проходять через зародкову лінію. Таким чином, під час процесу гаметогенезу первинні зародкові клітини мають стерти та відновити оригінальні схеми метилювання двобатьківської ДНК на основі статі батька-передавача.
Після запліднення батьківський і материнський геноми деметилюються, щоб стерти їхні епігенетичні підписи та набути тотипотентності (див. Потентність клітин[en]). У цьому місці спостерігається асиметрія: чоловічий пронуклеус піддається швидкому і активному деметилюванню. Тим часом жіночий пронуклеус пасивно деметилюється під час послідовних клітинних поділів. Процес деметилювання ДНК включає репарацію основи та, ймовірно, інші механізми, засновані на репарації ДНК.[19] Незважаючи на глобальний характер цього процесу, існують певні послідовності, які уникають його, такі як диференціально метильовані області[en] (DMRS), пов’язані з імпринтованими генами, ретротранспозони[en] та центромерний гетерохроматин. Реметилювання знову необхідне для диференціації ембріона в повноцінний організм.[20]
Ще в 2003 році було показано, що маніпуляції з ембріонами до імплантації in vitro порушують схеми метилювання в імпринтованих локусах[21] і відіграють вирішальну роль у клонованих тваринах.[22]

Навчання та пам’ять мають рівні постійності, що відрізняється від інших психічних процесів, таких як мислення, мова та свідомість, які є тимчасовими за своєю природою. Навчання та запам’ятовування можуть накопичуватися повільно (як-от вивчення таблиці множення) або швидко (як-от доторкнувшись до гарячої печі), але коли вони досягнуті, їх можна відновити для свідомого використання протягом тривалого часу. (див. також Нейропластичність)
Щури, піддані одному випадку контекстного обумовлення страху, створюють особливо сильну довготривалу пам’ять. Через 24 години після навчання 9,17% генів у геномах нейронів гіпокампу щурів виявилися диференціально метильованими. Це включало понад 2000 диференціально метильованих генів через 24 години після тренування, при цьому понад 500 генів були деметильовані.[23][24] Ділянка гіпокампу мозку – це місце, де спочатку зберігаються контекстуальні спогади про страх, але це зберігання є тимчасовим і не залишається в гіпокампі. У щурів контекстне обумовлення страху скасовується, коли гіпокамп піддається видаленню лише через 1 день після кондиціонування, але щури зберігають значну кількість контекстуального страху, коли встановлюється велика затримка (28 днів) між часом кондиціонування та часом гіпокампектомії (видалення гіпокампу).[25]
Для перепрограмування метилома ДНК потрібні три молекулярні стадії.
- Етап 1: Рекрутинг. Ферменти, необхідні для перепрограмування, залучаються до ділянок геному, які вимагають деметилювання або метилювання.
- Етап 2: Реалізація. Відбуваються початкові ферментативні реакції. У випадку метилювання це короткий етап, який призводить до метилювання цитозину до 5-метилцитозину.
- Етап 3: Репарація ДНК шляхом висічення основи. Проміжні продукти деметилювання каталізуються специфічними ферментами основного шляху репарації ДНК шляхом ексцизії, які остаточно відновлюють цитозин у послідовності ДНК.

Ізоформи ферментів TET[en] включають щонайменше дві ізоформи ТЕТ1, одну із ТЕТ2 і три ізоформи ТЕТ3.[27][28] Повнорозмірна канонічна ізоформа TET1, здається, практично обмежена ранніми ембріонами, ембріональними стовбуровими клітинами та первинними зародковими клітинами (PGC). Домінуюча ізоформа TET1 у більшості соматичних тканин, принаймні у миші, виникає внаслідок використання альтернативного промотору, який призводить до короткого транскрипту та усіченого білка, позначеного як TET1. Ізоформами TET3 є повнорозмірна форма TET3FL, коротка форма сплайсингу TET3s і форма, яка зустрічається в ооцитах і нейронах, позначена як TET3o. TET3o створюється альтернативним використанням промотора та містить додатковий перший N-кінцевий екзон, що кодує 11 амінокислот. TET3o зустрічається лише в ооцитах і нейронах і не експресується в ембріональних стовбурових клітинах або в будь-якому іншому типі клітин або досліджуваних тканинах дорослих мишей. У той час як експресію TET1 ледве можна виявити в ооцитах і зиготах, а TET2 експресується лише помірно, варіант TET3 TET3o демонструє надзвичайно високі рівні експресії в ооцитах і зиготах, але майже відсутній на 2-клітинній стадії. Можливо, що TET3o з високим вмістом в нейронах, ооцитах і зиготах на одноклітинній стадії є основним ферментом TET, який використовується, коли в цих клітинах відбувається дуже масштабне швидке деметилювання.
Ферменти ТЕТ не зв’язуються специфічно з 5-метилцитозином, за винятком випадків рекрутування. Без рекрутування чи націлювання TET1 переважно зв’язується з промоторами високого рівня CG і острівцями CpG (CGI) у всьому геномі за допомогою свого домену CXXC, який може розпізнавати неметильовані CGI.[29] TET2 не має спорідненості до 5-метилцитозину в ДНК.[30] Домен CXXC повнорозмірного TET3, який є переважною формою, що експресується в нейронах, найсильніше зв’язується з CpG, де C було перетворено на 5-карбоксицитозин (5caC). Однак він також зв’язується з неметильованими CpG.[28]

Щоб фермент ТЕТ ініціював деметилювання, він повинен спочатку бути залучений до метильованого сайту CpG в ДНК. Два білки, які, як показано, залучають фермент ТЕТ до метильованого цитозину в ДНК, це OGG1 (див. малюнок Ініціація детилювання ДНК)[31] і EGR1.[32]
Оксогуанінглікозилаза (OGG1) каталізує перший крок у відновленні основи 8-OHdG, пошкодженої окислювально. OGG1 знаходить 8-OHdG, ковзаючи вздовж лінійної ДНК на 1000 пар основ ДНК за 0,1 секунди.[33] OGG1 дуже швидко знаходить 8-OHdG. Білки OGG1 зв'язуються з окислювально пошкодженою ДНК з половинним максимальним часом приблизно 6 секунд.[34] Коли OGG1 знаходить 8-OHdG, він змінює конформацію та утворює комплекс з 8-OHdG у кишені зв’язування OGG1.[35] OGG1 не діє негайно, щоб видалити 8-OHdG. Половина максимального видалення 8-OHdG займає приблизно 30 хвилин у клітинах HeLa in vitro[36] або приблизно 11 хвилин у печінці опромінених мишей.[37] Окислення ДНК активними формами кисню переважно відбувається на гуаніні в метильованому місці CpG через знижений потенціал іонізації гуанінових основ, що знаходяться поруч із 5-метилцитозином.[38] TET1 зв’язує (рекрутується) OGG1, зв’язаний з 8-OHdG (див. малюнок).[31] Ймовірно, це дозволяє TET1 деметилювати сусідній метильований цитозин. Коли епітеліальні клітини молочної залози людини (MCF-10A) були оброблені H 2 O 2, 8-OHdG збільшився в ДНК у 3,5 рази, що спричинило великомасштабне деметилювання 5-метилцитозину приблизно до 20% від початкового рівня в ДНК.[31]
Ген раннього білка реакції росту 1 (early growth response protein 1, EGR1) є геном негайної ранньої реакції[en] (IEG). Визначальною характеристикою IEG є швидка та тимчасова активація — протягом хвилин — рівня їх мРНК незалежно від синтезу білка.[39] EGR1 може бути швидко індукований активністю нейронів.[40] У зрілому віці EGR1 широко експресується в усьому мозку, зберігаючи базові рівні експресії в кількох ключових областях мозку, включаючи медіальну префронтальну кору, смугасте тіло, гіпокамп і мигдалеподібне тіло.[39] Це вираження пов’язане з контролем пізнання, емоційною реакцією, соціальною поведінкою та чутливістю до винагороди.[39] EGR1 зв’язується з ДНК у місцях з мотивами[en] 5'-GCGTGGGCG-3' і 5'-GCGGGGGCGG-3', і ці мотиви виникають переважно в промоторних областях генів.[40] Коротка ізоформа TET1s експресується в мозку. EGR1 і TET1 утворюють комплекс, опосередкований С-кінцевими ділянками обох білків, незалежно від асоціації з ДНК.[40] EGR1 залучає TET1 до геномних областей, що оточують сайти зв’язування EGR1.[40] У присутності EGR1 TET1s здатний до локус-специфічного деметилювання та активації експресії наступних генів, які регулюються EGR1.[40]
Перепрограмування визначається у три фази: ініціація, дозрівання та стабілізація.[41]
Фаза ініціації пов'язана з пригніченням специфічних генів клітинного типу та посиленням плюрипотентних генів.[41] У міру того, як клітини рухаються до плюрипотентності, активність теломерази реактивується для розширення теломерів. Морфологія клітини може безпосередньо впливати на процес перепрограмування, оскільки клітина модифікується, щоб підготуватися до експресії гена плюрипотентності.[42] Основним показником завершення фази ініціації є те, що перші гени, пов’язані з плюрипотентністю, експресуються. Це включає в себе експресію білка Oct-4 або Homeobox NANOG під час проходження мезенхімально-епітеліального переходу (MET), а також втрату апоптозу та ознак старіння.[43]
Якщо клітину безпосередньо перепрограмувати з однієї соматичної клітини на іншу, гени, пов’язані з кожним типом клітини, починають відповідно посилювати та знижувати регуляцію.[41] Це може відбутися або через пряме перепрограмування клітини, або через проміжну стадію індукованих плюрипотентних стовбурових клітин, і подальшого їх диференціювання в бажаний тип клітини.[43]
Перенесення ядра, злиття клітин та фактори перепрограмування можуть активувати фазу ініціації.
Ооцит може перепрограмувати доросле ядро в ембріональний стан після перенесення ядра соматичної клітини, щоб з такої клітини міг розвинутися новий організм.[44]
Перепрограмування відрізняється від розвитку соматичного епітипу[7], оскільки соматичні епітипи потенційно можуть бути змінені після того, як організм залишив стадію розвитку життя.[45] Під час перенесення ядра соматичної клітини ооцит вимикає тканиноспецифічні гени в ядрі соматичної клітини та знову включає ембріональні специфічні гени. Цей процес було показано через клонування, як це видно в дослідженнях Джона Гердона з пуголовками[3] та в дослідженнях вівці Доллі.[46] Примітно, що ці події показали, що доля диференціації клітини є оборотним процесом.
Злиття клітин використовується для створення багатоядерної клітини, яка називається гетерокаріоном[en].[43] Злиті клітини дозволяють реактивувати та експресувати гени, які інакше мовчать. Коли гени реактивуються, клітини можуть повторно диференціюватися. Існують випадки, коли транскрипційні фактори, такі як фактори Яманаки, все ще потрібні для допомоги в перепрограмуванні гетерокаріонних клітин.[47]
Фактори перепрограмування включають мікроРНК, фактор транскрипції, епігенетичні маркери та інші малі молекули.[43] Вихідні фактори транскрипції, які призводять до розвитку iPSC, відкриті Яманакою, включають Oct4, Sox2, Klf4 і c-Myc (фактори OSKM).[5][48] Хоча було показано, що фактори OSKM індукують і сприяють плюрипотентності, інші фактори транскрипції, такі як білок Homeobox NANOG[49], LIN25[50], TRA-1-60[49], і C/EBPα[51] допомагають у ефективність перепрограмування. Використання мікроРНК та інших процесів, керованих малими молекулами, було використано як засіб підвищення ефективності диференціації від соматичних клітин до плюрипотентності.[43]
Фаза дозрівання починається в кінці фази ініціації, коли експресуються перші плюрипотентні гени.[41] Клітина готується бути незалежною від визначених факторів, які почали процес перепрограмування. Першими генами, які були виявлені в iPSC, є Oct4, протеїн Homeobox NANOG і Esrrb, а потім Sox2.[43] На пізніших стадіях дозрівання мовчання трансгену означає початок незалежності клітини від індукованого фактора транскрипції. Коли клітина стає незалежною, завершується фаза дозрівання і починається фаза стабілізації.
Оскільки доведено, що ефективність перепрограмування є змінним і низькоефективним процесом, не всі клітини завершують фазу дозрівання та досягають плюрипотентності.[51] Деякі клітини, які піддаються перепрограмуванню, все ще залишаються в стані апоптозу на початку стадії дозрівання через окислювальний стрес, викликаний стресами зміни експресії генів. Використання мікроРНК, білків і різних комбінацій факторів OSKM почало призводити до підвищення ефективності перепрограмування.
Фаза стабілізації відноситься до процесів у клітині, які відбуваються після досягнення клітиною плюрипотентності. Одним із генетичних маркерів є експресія Sox2 і реактивація Х-хромосоми, тоді як епігенетичні зміни включають теломеразу, яка розширює теломери[52] та втрату епігенетичної пам’яті клітини.[41] Епігенетична пам'ять клітини скидається змінами в метилюванні ДНК [53] за допомогою індукованої активацією цитидиндезамінази (AID), ферментів TET (TET) і ДНК-метилтрансферази (DMNTs), починаючи з фази дозрівання і до стабілізації.[41] Як тільки епігенетична пам'ять клітини втрачається, досягається можливість диференціювання на три зародкові листки.[48] Це вважається повністю перепрограмованою клітиною.[43]

Перепрограмування також можна індукувати штучно шляхом введення екзогенних факторів, як правило, факторів транскрипції. У цьому контексті це часто відноситься до створення індукованих плюрипотентних стовбурових клітин із зрілих клітин, таких як дорослі фібробласти. Це дозволяє виробляти стовбурові клітини для біомедичних досліджень, таких як дослідження лікування стовбуровими клітинами, без використання ембріонів. Він здійснюється шляхом трансфекції генів, асоційованих зі стовбуровими клітинами, у зрілі клітини за допомогою вірусних векторів, таких як ретровіруси. (див. також Генотерапія)
Методи клітинного перепрограмування значно розвинулися з моменту появи індукованих плюрипотентних стовбурових клітин (iPSC) та пересадки ядер соматичних клітин (SCNT).
Перенесення ядра соматичної клітини, започатковане Гердоном, включає перенесення ядра соматичної клітини в яйцеклітину без ядра. Цей процес повертає ядро соматичної клітини до ембріонального стану, повторюючи ранній розвиток [Gurdon, 1962].
iPSC генеруються введенням специфічних факторів транскрипції, таких як Oct4, Sox2, Klf4 і c-Myc (OSKM), у диференційовані соматичні клітини. Ця техніка дозволяє перепрограмувати дорослі клітини в плюрипотентний стан без потреби в ооцитах або ембріонах.
Методи прямого перепрограмування обходять проміжний плюрипотентний стан і безпосередньо перетворюють один тип клітини в інший. Наприклад, перетворення фібробластів у функціональні кардіоміоцити через примусову експресію серцевих транскрипційних факторів є багатообіцяючою стратегією регенеративної медицини.[54][55][56]
Один із перших трансакційних факторів, який проявив здатність перепрограмовувати клітину, був виявлений у міобласті, коли комплементарна ДНК (кДНК), що кодує MyoD, була експресована та перетворила фібробласт на міобласт. Іншим трансакційним фактором, який безпосередньо трансформував лімфоїдну клітину в мієлоїдну, був C/EBPα. MyoD і C/EBPα є прикладами невеликої кількості окремих факторів, які можуть трансформувати клітини. Частіше комбінація факторів транскрипції працює разом, щоб перепрограмувати клітину.
Фактори OSKM (Oct4, Sox2, Klf4 і c-Myc) були спочатку відкриті Яманакою в 2006 році шляхом індукції фібробласту миші в індуковані плюрипотентні стовбурові клітини (iPSC).[5] Протягом наступного року ці фактори були використані для індукції фібробластів людини в iPSC.[48]
- Oct4 є частиною основних регуляторних генів, необхідних для плюрипотентності, як це видно як в ембріональних стовбурових клітинах, так і в пухлинах.[57] Використання Oct4 навіть при невеликих збільшеннях дозволяє розпочати диференціацію до плюрипотентності. Oct4 працює в гіпотезі з Sox2 для експресії FGF4, що може допомогти в диференціації.
- Sox2 — це ген, який використовується для підтримки плюрипотентності стовбурових клітин. Oct4 і Sox2 працюють разом, щоб регулювати сотні генів, які використовуються в плюрипотентності.[57] Однак Sox2 не є єдиним можливим членом родини Sox, який бере участь у регуляції генів разом із Oct4 – Sox4, Sox11 і Sox15 також беруть участь, оскільки білок Sox є надлишковим у всьому геномі стовбурових клітин.
- Klf4 є фактором транскрипції, який використовується для проліферації, диференціювання, апоптозу та репрограмування соматичних клітин. При використанні в клітинному перепрограмуванні Klf4 запобігає клітинному поділу пошкоджених клітин, використовуючи свою апоптотичну здатність, і сприяє активності гістонацетилтрансферази.[48]
- c-Myc також відомий як онкоген, і за певних умов може стати причиною раку.[58] У клітинному перепрограмуванні c-Myc використовується для прогресування клітинного циклу, апоптозу та клітинної трансформації для подальшої диференціації.
Окрім OSKM, інші фактори транскрипції з’явилися як потужні фактори перепрограмування. Приклади включають Nanog, Lin28 і Esrrb, які можуть підвищити ефективність перепрограмування та сприяти створенню високоякісних iPSC.[59]
- Білок гомеобоксу NANOG (NANOG) є фактором транскрипції, який використовується для підвищення ефективності генерації iPSC шляхом підтримки плюрипотентності[60] та пригнічення факторів клітинної детермінації.[61] NANOG працює, сприяючи доступності хроматину через репресію гістонових маркерів, таких як H3K27me3[en]. NANOG допомагає рекрутувати Oct4, Sox2 і Esrrb, що використовуються в транскрипції, а також рекрутує пов’язаний з Брахмою ген-1 (BRG1) для доступності хроматину.

Окрім факторів транскрипції, різні сигнальні шляхи відіграють вирішальну роль у клітинному перепрограмуванні. Ці шляхи модулюють експресію генів та епігенетичні зміни, керуючи переходом від диференційованого стану до плюрипотентної або альтернативної долі клітини.
Сигнальні шляхи Wnt[en], BMP[en] і FGF[en] беруть участь у процесах перепрограмування. Вони сприяють активації ключових генів і встановленню пермісивного стану хроматину.[62][63]
Сигнальний шлях TGF-β[en], відомий своїми різноманітними функціями в розвитку та захворюваннях, може справляти як інгібуючий, так і стимулюючий вплив на перепрограмування, залежно від контексту. Розуміння тонкої взаємодії між TGF-β і перепрограмуванням має важливе значення для використання його потенціалу.[64][65]
Перепрограмування тягне за собою глибоку епігенетичну трансформацію, яка включає глобальне деметилювання ДНК і ремоделювання модифікацій гістонів.
Стирання позначок метилювання ДНК є ознакою перепрограмування. Ферменти TET, серед іншого, сприяють активному процесу деметилювання ДНК, відновлюючи більш сприятливий епігенетичний ландшафт.[66][67]
Динамічні зміни в модифікаціях гістонів, такі як ацетилювання та метилювання гістонів, відіграють вирішальну роль у перепрограмуванні. Ці модифікації регулюють експресію генів і доступність хроматину під час переходу до плюрипотентності.[68][69]
Методи клітинного перепрограмування започаткували нову еру регенеративної медицини, пропонуючи багатообіцяючі шляхи регенерації та відновлення тканин.
Одним із ключових застосувань клітинного перепрограмування є генерація індивідуальних індукованих плюрипотентних стовбурових клітин (iPSC). Ці iPSC можна диференціювати на різні типи клітин, пропонуючи поновлюване джерело клітин для трансплантації та регенеративної терапії.
iPSC, отримані від пацієнтів із певними захворюваннями, є цінною платформою для моделювання захворювання та скринінгу ліків. Дослідники можуть вивчати механізми захворювання та тестувати потенційні терапевтичні сполуки, використовуючи ці клітинні моделі, отримані з iPSC. Часто для таких цілей використовують мініатюрні 3D моделі органів — органоїди.
На додаток до підходів на основі iPSC, інші нові стратегії клітинного перепрограмування пропонують нові можливості для регенерації та відновлення тканин, зокрема, в тканинній інженерії.[70][71]
Перепрограмування in vivo включає пряме перепрограмування резидентних клітин в організмі для регенерації пошкоджених тканин. Наприклад, серцеві фібробласти (наприклад, з інфарктного рубця) можуть бути перепрограмовані в нові кардіоміоцити, пропонуючи потенційні рішення для регенерації серця.[54][55][56]
Групою вчених у 2020 році була проведена генотерапія для омолодження та відновлення нервового волокна сітківки. Старим мишам ввели за допомогою аденовірусної генотерапії гени, які синтезують фактори Яманакі, які епігенетично перепрограмовують та омолоджують гангліозні клітини сітківки миші, що сприяє регенерації аксонів після пошкодження, і усуває втрату зору на мишачій моделі глаукоми та у літніх мишей. Таке омолодження клітин дозволило відновити штучно пошкоджений зоровий нерв — нервові волокна виросли виросли знову. Вчені досягли х2 збільшення кількості клітин сітківки і х5 прискорення росту оптичного нерва.[72]
Дослідники вивчають використання малих молекул і епігенетичних модифікаторів для підвищення ефективності перепрограмування та сприяння тканиноспецифічній диференціації.[73][71]
Дослідження 2023 року, опубліковане в Nature, розкриває значні відмінності в епігеномах індукованих плюрипотентних стовбурових клітин людини і ембріональних стовбурових клітин людини, деталізуючи появу та збереження цих відмінностей під час клітинного перепрограмування. Представляючи нову стратегію — транзиторне-наївне-лікування (transient-naive-treatment, TNT), дослідження демонструє коригувальний підхід, який пом’якшує аберації в епігенетичні пам'яті в клітинах іПСК людини, більш тісно вирівнюючи їх з ембріональними стовбуровими клітинами, потенційно встановлюючи новий еталон для біомедичних застосувань і пропонуючи новий шлях до дослідження епігенетичної пам'яті.[74]
- Епігеноміка
- Індуковані плюрипотентні стовбурові клітини
- Редагування епігенома[en]
- Редагування генома
- Регенеративна медицина
- Ancelin Katia; Borensztein Maud, ред. (2021). Epigenetic Reprogramming During Mouse Embryogenesis: Methods and Protocols. Methods in Molecular Biology (англ.) 2214. New York, NY: Springer Nature. ISBN 978-1-0716-0957-6.
- Eran Meshorer and Giuseppe Testa (2020). Stem Cell Epigenetics (англ.). Elsevier. 2020. ISBN 978-0-12-814085-7.
- Palacios, Daniela, ред. (2019). Epigenetics and regeneration. Translational epigenetics series. London, San Diego, Cambridge, MA Oxford: Academic Press, An imprint of Elsevier. ISBN 978-0-12-814879-2.
- Cellular Reprogramming (Mary Ann Liebert)
- Підбірка статей Reprogramming (Nature Portfolio)
- Buckberry Sam; Liu Xiaodong; Poppe Daniel; de Mendoza, Alex та ін. (2023-08). Transient naive reprogramming corrects hiPS cells functionally and epigenetically. Nature (англ.) 620 (7975). doi:10.1038/s41586-023-06424-7.
- Singh Aditi; Rappolee Daniel A.; Ruden Douglas M. (2023-01). Epigenetic Reprogramming in Mice and Humans: From Fertilization to Primordial Germ Cell Development. Cells (англ.) 12 (14). doi:10.3390/cells12141874.
- Gruhn Wolfram H.; Tang Walfred W.C.; Dietmann Sabine та ін. (2023-01). Epigenetic resetting in the human germ line entails histone modification remodeling. Science Advances (англ.) 9 (3). doi:10.1126/sciadv.ade1257.
- ↑ Reik W, Dean W, Walter J (August 2001). Epigenetic reprogramming in mammalian development. Science (Review). 293 (5532): 1089—1093. doi:10.1126/science.1063443. PMID 11498579.
- ↑ а б в Hatton, Ian A.; Galbraith, Eric D.; Merleau, Nono S. C.; Miettinen, Teemu P.; Smith, Benjamin McDonald; Shander, Jeffery A. (26 вересня 2023). The human cell count and size distribution. Proceedings of the National Academy of Sciences (англ.). Т. 120, № 39. doi:10.1073/pnas.2303077120. ISSN 0027-8424. PMC 10523466. PMID 37722043. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б Gurdon JB (December 1962). The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles. Journal of Embryology and Experimental Morphology. 10: 622—640. PMID 13951335.
- ↑ The Nobel Prize in Physiology or Medicine – 2012 Press Release. Nobel Media AB. 8 жовтня 2012.
- ↑ а б в Takahashi K, Yamanaka S (August 2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4): 663—676. doi:10.1016/j.cell.2006.07.024. PMID 16904174.
- ↑ а б de Magalhães JP, Ocampo A (June 2022). Cellular reprogramming and the rise of rejuvenation biotech. Trends in Biotechnology (English) . 40 (6): 639—642. doi:10.1016/j.tibtech.2022.01.011. PMID 35190201.
- ↑ а б Saygin D, Tabib T, Bittar HE, Valenzi E, Sembrat J, Chan SY, Rojas M, Lafyatis R (6 грудня 2007). Transcriptional profiling of lung cell populations in idiopathic pulmonary arterial hypertension. Pulmonary Circulation. 10 (1). doi:10.1038/stemcells.2007.124. PMC 7052475. PMID 32166015.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Yang, Jae-Hyun; Petty, Christopher A.; Dixon-McDougall, Thomas; Lopez, Maria Vina; Tyshkovskiy, Alexander; Maybury-Lewis, Sun; Tian, Xiao; Ibrahim, Nabilah; Chen, Zhili (12 липня 2023). Chemically induced reprogramming to reverse cellular aging. Aging (англ.). Т. 15, № 13. с. 5966—5989. doi:10.18632/aging.204896. ISSN 1945-4589. PMC 10373966. PMID 37437248. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Morgan, Hugh D.; Santos, Fátima; Green, Kelly; Dean, Wendy; Reik, Wolf (15 квітня 2005). Epigenetic reprogramming in mammals. Human Molecular Genetics. Т. 14. с. R47—R58. doi:10.1093/hmg/ddi114. ISSN 1460-2083. Процитовано 9 жовтня 2023.
- ↑ Feng, Suhua; Jacobsen, Steven E.; Reik, Wolf (29 жовтня 2010). Epigenetic Reprogramming in Plant and Animal Development. Science (англ.). Т. 330, № 6004. с. 622—627. doi:10.1126/science.1190614. ISSN 0036-8075. PMC 2989926. PMID 21030646. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Seisenberger, Stefanie; Peat, Julian R.; Hore, Timothy A.; Santos, Fátima; Dean, Wendy; Reik, Wolf (5 січня 2013). Reprogramming DNA methylation in the mammalian life cycle: building and breaking epigenetic barriers. Philosophical Transactions of the Royal Society B: Biological Sciences (англ.). Т. 368, № 1609. с. 20110330. doi:10.1098/rstb.2011.0330. ISSN 0962-8436. PMC 3539359. PMID 23166394. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Singh, Aditi; Rappolee, Daniel A.; Ruden, Douglas M. (2023-01). Epigenetic Reprogramming in Mice and Humans: From Fertilization to Primordial Germ Cell Development. Cells (англ.). Т. 12, № 14. с. 1874. doi:10.3390/cells12141874. ISSN 2073-4409. PMC 10377882. PMID 37508536. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Bernstein, Carol (2022-01). DNA Methylation and Establishing Memory. Epigenetics Insights (англ.). Т. 15. с. 251686572110724. doi:10.1177/25168657211072499. ISSN 2516-8657. PMC 8793415. PMID 35098021. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Cedar H, Bergman Y (July 2012). Programming of DNA methylation patterns. Annual Review of Biochemistry. 81: 97—117. doi:10.1146/annurev-biochem-052610-091920. PMID 22404632.
- ↑ Kobayashi, Hisato; Sakurai, Takayuki; Imai, Misaki; Takahashi, Nozomi; Fukuda, Atsushi; Yayoi, Obata; Sato, Shun; Nakabayashi, Kazuhiko; Hata, Kenichiro (5 січ. 2012 р.). Contribution of Intragenic DNA Methylation in Mouse Gametic DNA Methylomes to Establish Oocyte-Specific Heritable Marks. PLOS Genetics (англ.). Т. 8, № 1. doi:10.1371/journal.pgen.1002440. ISSN 1553-7404. PMC 3252278. PMID 22242016. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Cao, Mingju; Shao, Xiaojian; Chan, Peter; Cheung, Warren; Kwan, Tony; Pastinen, Tomi; Robaire, Bernard (14 грудня 2020). High-resolution analyses of human sperm dynamic methylome reveal thousands of novel age-related epigenetic alterations. Clinical Epigenetics. Т. 12, № 1. с. 192. doi:10.1186/s13148-020-00988-1. ISSN 1868-7083. PMC 7735420. PMID 33317634. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Auclair G, Guibert S, Bender A, Weber M (2014). Ontogeny of CpG island methylation and specificity of DNMT3 methyltransferases during embryonic development in the mouse. Genome Biology. 15 (12): 545. doi:10.1186/s13059-014-0545-5. PMC 4295324. PMID 25476147.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Zeng Y, Chen T (March 2019). DNA Methylation Reprogramming during Mammalian Development. Genes. 10 (4): 257. doi:10.3390/genes10040257. PMC 6523607. PMID 30934924.
- ↑ Ladstätter S, Tachibana-Konwalski K (December 2016). A Surveillance Mechanism Ensures Repair of DNA Lesions during Zygotic Reprogramming. Cell. 167 (7): 1774—1787.e13. doi:10.1016/j.cell.2016.11.009. PMC 5161750. PMID 27916276.
- ↑ Seisenberger, Stefanie; Peat, Julian R.; Hore, Timothy A.; Santos, Fátima; Dean, Wendy; Reik, Wolf (5 січня 2013). Reprogramming DNA methylation in the mammalian life cycle: building and breaking epigenetic barriers. Philosophical Transactions of the Royal Society B: Biological Sciences (англ.). Т. 368, № 1609. с. 20110330. doi:10.1098/rstb.2011.0330. ISSN 0962-8436. PMC 3539359. PMID 23166394. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Mann MR, Chung YG, Nolen LD, Verona RI, Latham KE, Bartolomei MS (September 2003). Disruption of imprinted gene methylation and expression in cloned preimplantation stage mouse embryos. Biology of Reproduction. 69 (3): 902—914. doi:10.1095/biolreprod.103.017293. PMID 12748125.
- ↑ Wrenzycki C, Niemann H (December 2003). Epigenetic reprogramming in early embryonic development: effects of in-vitro production and somatic nuclear transfer. Review. Reproductive Biomedicine Online. 7 (6): 649—656. doi:10.1016/s1472-6483(10)62087-1. PMID 14748963.
- ↑ Duke CG, Kennedy AJ, Gavin CF, Day JJ, Sweatt JD (July 2017). Experience-dependent epigenomic reorganization in the hippocampus. Learning & Memory. 24 (7): 278—288. doi:10.1101/lm.045112.117. PMC 5473107. PMID 28620075.
- ↑ Bernstein, Carol (2022-01). DNA Methylation and Establishing Memory. Epigenetics Insights (англ.). Т. 15. с. 251686572110724. doi:10.1177/25168657211072499. ISSN 2516-8657. PMC 8793415. PMID 35098021. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Kim JJ, Jung MW (2006). Neural circuits and mechanisms involved in Pavlovian fear conditioning: a critical review. Neuroscience and Biobehavioral Reviews. 30 (2): 188—202. doi:10.1016/j.neubiorev.2005.06.005. PMC 4342048. PMID 16120461.
- ↑ Bayraktar G, Kreutz MR (2018). The Role of Activity-Dependent DNA Demethylation in the Adult Brain and in Neurological Disorders. Frontiers in Molecular Neuroscience. 11: 169. doi:10.3389/fnmol.2018.00169. PMC 5975432. PMID 29875631.
- ↑ Jin SG, Zhang ZM, Dunwell TL, Harter MR, Wu X, Johnson J, Li Z, Liu J, Szabó PE, Lu Q, Xu GL, Song J, Pfeifer GP (January 2016). Tet3 Reads 5-Carboxylcytosine through Its CXXC Domain and Is a Potential Guardian against Neurodegeneration. Cell Reports. 14 (3): 493—505. doi:10.1016/j.celrep.2015.12.044. PMC 4731272. PMID 26774490.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ а б Melamed P, Yosefzon Y, David C, Tsukerman A, Pnueli L (2018). Tet Enzymes, Variants, and Differential Effects on Function. Frontiers in Cell and Developmental Biology. 6: 22. doi:10.3389/fcell.2018.00022. PMC 5844914. PMID 29556496.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Zhang W, Xia W, Wang Q, Towers AJ, Chen J, Gao R, Zhang Y, Yen CA, Lee AY, Li Y, Zhou C, Liu K, Zhang J, Gu TP, Chen X, Chang Z, Leung D, Gao S, Jiang YH, Xie W (December 2016). Isoform Switch of TET1 Regulates DNA Demethylation and Mouse Development. Molecular Cell. 64 (6): 1062—1073. doi:10.1016/j.molcel.2016.10.030. PMID 27916660.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Deplus R, Delatte B, Schwinn MK, Defrance M, Méndez J, Murphy N, Dawson MA, Volkmar M, Putmans P, Calonne E, Shih AH, Levine RL, Bernard O, Mercher T, Solary E, Urh M, Daniels DL, Fuks F (March 2013). TET2 and TET3 regulate GlcNAcylation and H3K4 methylation through OGT and SET1/COMPASS. The EMBO Journal. 32 (5): 645—655. doi:10.1038/emboj.2012.357. PMC 3590984. PMID 23353889.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ а б в г Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, Pan F, Zhao J, Hu Z, Sekhar C, Guo Z (September 2016). OGG1 is essential in oxidative stress induced DNA demethylation. Cellular Signalling. 28 (9): 1163—1171. doi:10.1016/j.cellsig.2016.05.021. PMID 27251462.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Sun Z, Xu X, He J, Murray A, Sun MA, Wei X, Wang X, McCoig E, Xie E, Jiang X, Li L, Zhu J, Chen J, Morozov A, Pickrell AM, Theus MH, Xie H (August 2019). EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity. Nature Communications. 10 (1): 3892. Bibcode:2019NatCo..10.3892S. doi:10.1038/s41467-019-11905-3. PMC 6715719. PMID 31467272.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Blainey PC, van Oijen AM, Banerjee A, Verdine GL, Xie XS (April 2006). A base-excision DNA-repair protein finds intrahelical lesion bases by fast sliding in contact with DNA. Proceedings of the National Academy of Sciences. 103 (15): 5752—5757. Bibcode:2006PNAS..103.5752B. doi:10.1073/pnas.0509723103. PMC 1458645. PMID 16585517.
- ↑ Abdou I, Poirier GG, Hendzel MJ, Weinfeld M (January 2015). DNA ligase III acts as a DNA strand break sensor in the cellular orchestration of DNA strand break repair. Nucleic Acids Research. 43 (2): 875—892. doi:10.1093/nar/gku1307. PMC 4333375. PMID 25539916.
- ↑ van der Kemp, P. A., Charbonnier, J. B., Audebert, M., & Boiteux, S. (2004). Catalytic and DNA-binding properties of the human Ogg1 DNA N-glycosylase/AP lyase: biochemical exploration of H270, Q315 and F319, three amino acids of the 8-oxoguanine-binding pocket. Nucleic Acids Research. 32 (2): 570—578. doi:10.1093/nar/gkh224. PMC 373348. PMID 14752045.
- ↑ Lan L, Nakajima S, Oohata Y, Takao M, Okano S, Masutani M, Wilson SH, Yasui A (September 2004). In situ analysis of repair processes for oxidative DNA damage in mammalian cells. Proceedings of the National Academy of Sciences. 101 (38): 13738—13743. Bibcode:2004PNAS..10113738L. doi:10.1073/pnas.0406048101. PMC 518826. PMID 15365186.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Hamilton ML, Guo Z, Fuller CD, Van Remmen H, Ward WF, Austad SN, Troyer DA, Thompson I, Richardson A (May 2001). A reliable assessment of 8-oxo-2-deoxyguanosine levels in nuclear and mitochondrial DNA using the sodium iodide method to isolate DNA. Nucleic Acids Research. 29 (10): 2117—2126. doi:10.1093/nar/29.10.2117. PMC 55450. PMID 11353081.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Ming X, Matter B, Song M, Veliath E, Shanley R, Jones R, Tretyakova N (March 2014). Mapping structurally defined guanine oxidation products along DNA duplexes: influence of local sequence context and endogenous cytosine methylation. Journal of the American Chemical Society. 136 (11): 4223—4235. doi:10.1021/ja411636j. PMC 3985951. PMID 24571128.
- ↑ а б в Duclot F, Kabbaj M (2017). The Role of Early Growth Response 1 (EGR1) in Brain Plasticity and Neuropsychiatric Disorders. Frontiers in Behavioral Neuroscience. 11: 35. doi:10.3389/fnbeh.2017.00035. PMC 5337695. PMID 28321184.
- ↑ а б в г д Sun Z, Xu X, He J, Murray A, Sun MA, Wei X, Wang X, McCoig E, Xie E, Jiang X, Li L, Zhu J, Chen J, Morozov A, Pickrell AM, Theus MH, Xie H (August 2019). EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity. Nature Communications. 10 (1): 3892. Bibcode:2019NatCo..10.3892S. doi:10.1038/s41467-019-11905-3. PMC 6715719. PMID 31467272.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ а б в г д е David L, Polo JM (May 2014). Phases of reprogramming. Stem Cell Research. 12 (3): 754—761. doi:10.1016/j.scr.2014.03.007.
- ↑ Downing TL, Soto J, Morez C, Houssin T, Fritz A, Yuan F, Chu J, Patel S, Schaffer DV, Li S (December 2013). Biophysical regulation of epigenetic state and cell reprogramming. Nature Materials. 12 (12): 1154—1162. Bibcode:2013NatMa..12.1154D. doi:10.1038/nmat3777. PMC 9675045. PMID 24141451.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ а б в г д е ж Pires CF, Rosa FF, Kurochkin I, Pereira CF (11 грудня 2019). Understanding and Modulating Immunity With Cell Reprogramming. Frontiers in Immunology. 10: 2809. doi:10.3389/fimmu.2019.02809. PMC 917620. PMID 31921109.
- ↑ Hochedlinger K, Jaenisch R (June 2006). Nuclear reprogramming and pluripotency. Nature. 441 (7097): 1061—1067. Bibcode:2006Natur.441.1061H. doi:10.1038/nature04955. PMID 16810240.
- ↑ Mathers JC (June 2006). Nutritional modulation of ageing: genomic and epigenetic approaches. Mechanisms of Ageing and Development. 127 (6): 584—589. doi:10.1016/j.mad.2006.01.018. PMID 16513160.
- ↑ Wilmut I, Schnieke AE, McWhir J, Kind AJ, Campbell KH (February 1997). Viable offspring derived from fetal and adult mammalian cells. Nature. 385 (6619): 810—813. Bibcode:1997Natur.385..810W. doi:10.1038/385810a0. PMID 9039911.
- ↑ Pereira CF, Terranova R, Ryan NK, Santos J, Morris KJ, Cui W, Merkenschlager M, Fisher AG (September 2008). Heterokaryon-based reprogramming of human B lymphocytes for pluripotency requires Oct4 but not Sox2. PLOS Genetics. 4 (9): e1000170. doi:10.1371/journal.pgen.1000170. PMC 2527997. PMID 18773085.
{{cite journal}}: Недійсний|displayauthors=6(довідка)Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в г Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S (November 2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell (English) . 131 (5): 861—872. doi:10.1016/j.cell.2007.11.019. PMID 18035408.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) - ↑ а б Bueno C, Sardina JL, Di Stefano B, Romero-Moya D, Muñoz-López A, Ariza L, Chillón MC, Balanzategui A, Castaño J, Herreros A, Fraga MF, Fernández A, Granada I, Quintana-Bustamante O, Segovia JC, Nishimura K, Ohtaka M, Nakanishi M, Graf T, Menendez P (March 2016). Reprogramming human B cells into induced pluripotent stem cells and its enhancement by C/EBPα. Leukemia. 30 (3): 674—682. doi:10.1038/leu.2015.294. PMID 26500142.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка); Недійсний|displayauthors=6(довідка) - ↑ de Magalhães JP, Ocampo A (June 2022). Cellular reprogramming and the rise of rejuvenation biotech. Trends in Biotechnology (English) . 40 (6): 639—642. doi:10.1016/j.tibtech.2022.01.011. PMID 35190201.
- ↑ а б Srivastava D, DeWitt N (September 2016). In Vivo Cellular Reprogramming: The Next Generation. Cell. 166 (6): 1386—1396. doi:10.1016/j.cell.2016.08.055. PMC 6234007. PMID 27610565.
- ↑ de Magalhães JP, Ocampo A (June 2022). Cellular reprogramming and the rise of rejuvenation biotech. Trends in Biotechnology (English) . 40 (6): 639—642. doi:10.1016/j.tibtech.2022.01.011. PMID 35190201.
- ↑ Polo JM, Anderssen E, Walsh RM, Schwarz BA, Nefzger CM, Lim SM, Borkent M, Apostolou E, Alaei S, Cloutier J, Bar-Nur O, Cheloufi S, Stadtfeld M, Figueroa ME, Robinton D, Natesan S, Melnick A, Zhu J, Ramaswamy S, Hochedlinger K (December 2012). A molecular roadmap of reprogramming somatic cells into iPS cells. Cell (English) . 151 (7): 1617—1632. doi:10.1016/j.cell.2012.11.039. PMC 3608203. PMID 23260147.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ а б Cao, Nan; Huang, Yu; Zheng, Jiashun; Spencer, C. Ian; Zhang, Yu; Fu, Ji-Dong; Nie, Baoming; Xie, Min; Zhang, Mingliang (3 червня 2016). Conversion of human fibroblasts into functional cardiomyocytes by small molecules. Science (англ.). Т. 352, № 6290. с. 1216—1220. doi:10.1126/science.aaf1502. ISSN 0036-8075. Процитовано 9 жовтня 2023.
- ↑ а б Chen, Yueqiu; Yang, Ziying; Zhao, Zhen-Ao; Shen, Zhenya (2017-12). Direct reprogramming of fibroblasts into cardiomyocytes. Stem Cell Research & Therapy (англ.). Т. 8, № 1. doi:10.1186/s13287-017-0569-3. ISSN 1757-6512. PMC 5445304. PMID 28545505. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Klose, Kristin; Gossen, Manfred; Stamm, Christof (2019-01). Turning fibroblasts into cardiomyocytes: technological review of cardiac transdifferentiation strategies. The FASEB Journal (англ.). Т. 33, № 1. с. 49—70. doi:10.1096/fj.201800712R. ISSN 0892-6638. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Rizzino A (December 2009). Sox2 and Oct-3/4: a versatile pair of master regulators that orchestrate the self-renewal and pluripotency of embryonic stem cells. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 1 (2): 228—236. doi:10.1002/wsbm.12. PMC 2794141. PMID 20016762.
- ↑ Dominguez-Sola D, Ying CY, Grandori C, Ruggiero L, Chen B, Li M, Galloway DA, Gu W, Gautier J, Dalla-Favera R (July 2007). Non-transcriptional control of DNA replication by c-Myc. Nature. 448 (7152): 445—451. Bibcode:2007Natur.448..445D. doi:10.1038/nature05953. PMID 17597761.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Buganim, Yosef; Faddah, Dina A.; Cheng, Albert W.; Itskovich, Elena; Markoulaki, Styliani; Ganz, Kibibi; Klemm, Sandy L.; van Oudenaarden, Alexander; Jaenisch, Rudolf (2012-09). Single-Cell Expression Analyses during Cellular Reprogramming Reveal an Early Stochastic and a Late Hierarchic Phase. Cell. Т. 150, № 6. с. 1209—1222. doi:10.1016/j.cell.2012.08.023. ISSN 0092-8674. PMC 3457656. PMID 22980981. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Zaehres H, Lensch MW, Daheron L, Stewart SA, Itskovitz-Eldor J, Daley GQ (March 2005). High-efficiency RNA interference in human embryonic stem cells. Stem Cells. 23 (3): 299—305. doi:10.1634/stemcells.2004-0252. PMID 15749924.
- ↑ Heurtier V, Owens N, Gonzalez I, Mueller F, Proux C, Mornico D, Clerc P, Dubois A, Navarro P (March 2019). The molecular logic of Nanog-induced self-renewal in mouse embryonic stem cells. Nature Communications. 10 (1): 1109. Bibcode:2019NatCo..10.1109H. doi:10.1038/s41467-019-09041-z. PMC 6406003. PMID 30846691.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Sato, Noboru; Meijer, Laurent; Skaltsounis, Leandros; Greengard, Paul; Brivanlou, Ali H. (2004-01). Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nature Medicine (англ.). Т. 10, № 1. с. 55—63. doi:10.1038/nm979. ISSN 1546-170X. Процитовано 9 жовтня 2023.
- ↑ Xu, Ren-He; Sampsell-Barron, Tori L.; Gu, Feng; Root, Sierra; Peck, Ruthann M.; Pan, Guangjin; Yu, Junying; Antosiewicz-Bourget, Jessica; Tian, Shulan (2008-08). NANOG Is a Direct Target of TGFβ/Activin-Mediated SMAD Signaling in Human ESCs. Cell Stem Cell. Т. 3, № 2. с. 196—206. doi:10.1016/j.stem.2008.07.001. ISSN 1934-5909. PMC 2758041. PMID 18682241. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Maherali, Nimet; Ahfeldt, Tim; Rigamonti, Alessandra; Utikal, Jochen; Cowan, Chad; Hochedlinger, Konrad (2008-09). A High-Efficiency System for the Generation and Study of Human Induced Pluripotent Stem Cells. Cell Stem Cell. Т. 3, № 3. с. 340—345. doi:10.1016/j.stem.2008.08.003. ISSN 1934-5909. PMC 3987901. PMID 18786420. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Ichida, Justin K.; Blanchard, Joel; Lam, Kelvin; Son, Esther Y.; Chung, Julia E.; Egli, Dieter; Loh, Kyle M.; Carter, Ava C.; Di Giorgio, Francesco P. (2009-11). A Small-Molecule Inhibitor of Tgf-β Signaling Replaces Sox2 in Reprogramming by Inducing Nanog. Cell Stem Cell. Т. 5, № 5. с. 491—503. doi:10.1016/j.stem.2009.09.012. ISSN 1934-5909. PMC 3335195. PMID 19818703. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Tahiliani, Mamta; Koh, Kian Peng; Shen, Yinghua; Pastor, William A.; Bandukwala, Hozefa; Brudno, Yevgeny; Agarwal, Suneet; Iyer, Lakshminarayan M.; Liu, David R. (15 травня 2009). Conversion of 5-Methylcytosine to 5-Hydroxymethylcytosine in Mammalian DNA by MLL Partner TET1. Science (англ.). Т. 324, № 5929. с. 930—935. doi:10.1126/science.1170116. ISSN 0036-8075. PMC 2715015. PMID 19372391. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Wu, Xiaoji; Zhang, Yi (2017-09). TET-mediated active DNA demethylation: mechanism, function and beyond. Nature Reviews Genetics (англ.). Т. 18, № 9. с. 517—534. doi:10.1038/nrg.2017.33. ISSN 1471-0064. Процитовано 9 жовтня 2023.
- ↑ Apostolou, Effie; Ferrari, Francesco; Walsh, Ryan M.; Bar-Nur, Ori; Stadtfeld, Matthias; Cheloufi, Sihem; Stuart, Hannah T.; Polo, Jose M.; Ohsumi, Toshiro K. (2013-06). Genome-wide Chromatin Interactions of the Nanog Locus in Pluripotency, Differentiation, and Reprogramming. Cell Stem Cell. Т. 12, № 6. с. 699—712. doi:10.1016/j.stem.2013.04.013. ISSN 1934-5909. PMC 3725985. PMID 23665121. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Shao, Yue; Taniguchi, Kenichiro; Gurdziel, Katherine; Townshend, Ryan F.; Xue, Xufeng; Yong, Koh Meng Aw; Sang, Jianming; Spence, Jason R.; Gumucio, Deborah L. (2017-04). Self-organized amniogenesis by human pluripotent stem cells in a biomimetic implantation-like niche. Nature Materials (англ.). Т. 16, № 4. с. 419—425. doi:10.1038/nmat4829. ISSN 1476-4660. PMC 5374007. PMID 27941807. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Grath, Alexander; Dai, Guohao (2019-12). Direct cell reprogramming for tissue engineering and regenerative medicine. Journal of Biological Engineering (англ.). Т. 13, № 1. doi:10.1186/s13036-019-0144-9. ISSN 1754-1611. PMC 6373087. PMID 30805026. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Basu, Amitava; Tiwari, Vijay K. (23 липня 2021). Epigenetic reprogramming of cell identity: lessons from development for regenerative medicine. Clinical Epigenetics. Т. 13, № 1. с. 144. doi:10.1186/s13148-021-01131-4. ISSN 1868-7083. PMC 8305869. PMID 34301318. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Lu, Yuancheng; Brommer, Benedikt; Tian, Xiao; Krishnan, Anitha; Meer, Margarita; Wang, Chen; Vera, Daniel L.; Zeng, Qiurui; Yu, Doudou (2020-12). Reprogramming to recover youthful epigenetic information and restore vision. Nature (англ.). Т. 588, № 7836. с. 124—129. doi:10.1038/s41586-020-2975-4. ISSN 1476-4687. Процитовано 7 грудня 2022.
- ↑ Lin, Tongxiang; Wu, Shouhai (1 квітня 2015). Reprogramming with Small Molecules instead of Exogenous Transcription Factors. Stem Cells International (англ.). Т. 2015. с. e794632. doi:10.1155/2015/794632. ISSN 1687-966X. PMC 4397468. PMID 25922608. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Buckberry, Sam; Liu, Xiaodong; Poppe, Daniel; Tan, Jia Ping; Sun, Guizhi; Chen, Joseph; Nguyen, Trung Viet; de Mendoza, Alex; Pflueger, Jahnvi (2023-08). Transient naive reprogramming corrects hiPS cells functionally and epigenetically. Nature (англ.). Т. 620, № 7975. с. 863—872. doi:10.1038/s41586-023-06424-7. ISSN 1476-4687. Процитовано 16 грудня 2023.