Алкіни

Алкі́ни — клас ненасичених вуглеводнів аліфатичної будови, що містять у своєму ланцюзі потрійний зв'язок C≡C і за своїм складом відповідають загальній формулі CnH2n-2 (при n = 2 і більше). За назвою першого представника цього гомологічного ряду, ацетилену, алкіни також мають позначення ацетиленові вуглеводні.
Окрім аліфатичних алкінів утворення потрійного зв'язку можливе й у вуглеводнях циклічної будови. Представники такого класу, що мають назву циклоалкіни, відповідають загальній формулі CnH2n-4.
Номенклатура[ред. | ред. код]
Систематична номенклатура[ред. | ред. код]
Систематична номенклатура IUPAC для алкінів є аналогічною до номенклатури алкенів: за основу береться найдовший вуглецевий ланцюг, який містить потрійний зв'язок, а напрям нумерації визначається таким чином, щоб потрійний зв'язок дістав найменший можливий номер. При записі назви сполуки її основу, після перерахування бічних замісників, складає назва алкану, який відповідає кількості атомів у ланцюзі, в якому суфікс -ан замінюється на -ін або -ин, а перед суфіксом вміщується число-локант, що позначає розташування потрійного зв'язку.
За наявності у сполуці одночасно потрійного і подвійного зв'язку вони в сумі повинні дістати мінімально можливі номери, а у разі симетричності розташування менший номер відводиться подвійному зв'язку. При записі назви спочатку зазначається розташування подвійного зв'язку, а потім потрійного.
-
4-Метилгекс-2-ин
-
Бут-1,3-діїн
(діацетилен) -
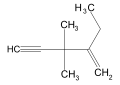
2-Етил-3,3-диметилпент-1-ен-4-ін
Раціональна номенклатура[ред. | ред. код]
Згідно з принципами раціональної номенклатури алкіни можуть розглядатися як похідні ацетилену (етину), в якого один або два атоми водню заміщені на функціональні групи.
-
Диметилацетилен
(бут-2-ин) -
Ізопропілацетилен
(2-метилбут-1-ин) -
Вінілацетилен
(бут-1-ен-3-ін)
Такий спосіб іменування нині не має суттєвого поширення, а також не відповідає вимогам IUPAC.
Тривіальна номенклатура[ред. | ред. код]
З-поміж усіх алкінів нині тривіальна назва широко вживається лише для ацетилену — згідно з номенклатурою IUPAC назва ацетилен є переважною при позначенні вуглеводню C2H2, на противагу систематичній назві етин. Також тривіальні назви мала деяка кількість алкінів, для яких вживалися, наприклад, назви алілен (C3H4), кротонілен (C4H4), валерієн (C5H8) тощо.
Будова[ред. | ред. код]

Зв'язок між атомами вуглецю у молекулах алкінів виникає при перекриванні sp-гібридизованих орбіталей. Залишкові негібридизовані 2py і 2pz орбіталі перекриваються з утворенням двох π-зв'язків, розташованих у взаємно перпендикулярних площинах. Утворюється умовно потрійний зв'язок. Енергія такого зв'язку становить ~815 кДж/моль — він є сильнішим за подвійний зв'язок в алкенах (~610 кДж/моль) та алканах (~350 кДж/моль).
Методом дифракції електронів було встановлено, що відстань між атомами вуглецю у молекулі ацетилену становить 0,120 нм, що є меншим, аніж відстань C=C в етилені (0,134 нм) та С-С в етані (0,154 нм). Також меншою в ацетилені є відстань C-H — 0,106 нм проти 0,109 нм в етилені. Це пояснюється збільшенням s-характеру орбіталей (sp в алкінах проти sp2 в алкенах).
Фізичні властивості[ред. | ред. код]
| Алкін | Формула | Тпл, °C | Ткип, °C |
|---|---|---|---|
| Ацетилен | HC≡CH | -81,8 | 84 |
| Пропін | CH3-C≡CH | -101,5 | -23,2 |
| Бут-1-ин | CH3-CH2-C≡CH | -125,9 | 8,1 |
| Бут-2-ин | CH3-C≡C-CH3 | -32,3 | 27,0 |
| Пент-1-ин | CH3-(CH2)2-C≡CH | -90,0 | 39,3 |
| Гекс-1-ин | CH3-(CH2)3-C≡CH | -132,4 | 71,4 |
| Окт-1-ин | CH3-(CH2)5-C≡CH | -79,6 | 126,2 |
| Дец-1-ин | CH3-(CH2)7-C≡CH | -40,0 | 182,2 |
Фізичні властивості алкінів загалом подібні до аналогічних їм алкенів. Найлегші алкіни — ацетилен, пропін та бут-1-ин — є безбарвними газами. Наступні представники у ряді від бут-2-ину до гептадецинів (C17H32) є рідинами, а вище октадец-1-ину — твердими речовинами.
Температури кипіння алкінів порівняно вищі від температур в алкенів. При цьому вплив має будова ланцюга: алкіни з термінальним (прикінцевим) потрійним зв'язком мають нижчу температуру кипіння, аніж ізомери із внутрішнім потрійним зв'язком. Ця властивість дозволяє проводити розділення ізомерів шляхом фракційної перегонки.
Отримання[ред. | ред. код]
Отримання алкінів можливе за реакцією відщеплення галогеноводнів (дегідрогалогенування). Здійснюються такі реакції при дії спиртових розчинів гідроксиду калію або аміду натрію. Наприклад, для 1,2-дигалогеналкану:
У випадку 1,1-дигалогеналканів їх початково отримують дією галогенідів фосфору(V) на кетони або альдегіди. При відщепленні галогеноводню вони так само на першій стадії утворюють вінілгалогенід.
Реакція протікає за правилом Зайцева. При використанні гідроксидів калію або натрію взаємодія проводиться за якомога нижчої температури для запобігання міграції потрійного зв'язку вглиб ланцюга.
При використанні ацетилену можна синтезувати його гомологи із термінальним зв'язком, попередньо отримавши ацетиленід натрію або етинілмагнійбромід (реакція Йоцича):
Хімічні властивості[ред. | ред. код]
Основні хімічні властивості алкінів визначаються наявністю у них потрійного зв'язку. Порівняно із алкенами, що мають подвійний зв'язок, алкіни є більш реакційноздатними по відношенню до нуклеофільних реагентів. Так, похідні алкінів (ацетиленіди, меркаптиди) можуть вступати в реакції нуклеофільного приєднання, котрі не властиві алкенам.
Кислотні властивості[ред. | ред. код]
Термінальні алкіни мають на кінцевому sp-гібридизованому атомі вуглецю один атом водню, який виявляє кислотні властивості. При чому його кислотність є вищою, аніж у випадку алкенів та аміаку, але меншою, ніж у води чи спиртів. Зокрема, ацетилен має значення pKa на рівні 25, етилен — 44, аміак — 33, етанол — 15,9. Вища кислотність алкінів по відношенню до алкенів пояснюється більшою стійкістю відповідних карбаніонів внаслідок підвищення електронегативності атома вуглецю при переході від sp3- до sp-гібридизованого стану.
Проте кислотність алкінів є недостатньо високою — лише обмежена кількість аніонів здатна здійснити їхню іонізацію. До іонізації не здатний, наприклад, гідроксид-іон. Однак при дії дуже сильних основ з алкінів із прикінцевим зв'язком утворюються солі, що називаються ацетиленідами:
Отримання ацетиленідів при низьких температурах можливе реакцією з амідами металів:
Кислотні властивості алкінів проявляються також і в реакціях із металоорганічними сполуками, які є сильними основами:
Реакція утворення ацетиленідів є якісною при визначенні прикінцевого потрійного зв'язку шляхом взаємодії із аміакатами гідроксидів срібла або міді. Внаслідок реакції утворюється нерозчинний забарвлений осад, який також є вибухонебезпечним:
- (білий осад)
- (червоно-фіолетовий осад)
Реакції приєднання[ред. | ред. код]
Z-Селективне відновлення — гідрування[ред. | ред. код]
Реакція гідрування алкінів протікає у присутності каталізаторів платини, паладію, нікелю.
При цьому друга стадія гідрування протікає набагато швидше, тому для зменшення швидкості реакції, а також для можливості проведення вибіркового гідрування застосовують спеціальні, так звані «отруєні» каталізатори. Каталізатори, «отруєні» солями важких металів (наприклад, каталізатор Ліндлара — Pd/CaCO3 із домішками ацетату свинцю) використовуються при гідруванні виключно потрійного зв'язку.
E-Селективне відновлення натрієм у рідкому амоніаку[ред. | ред. код]
У випадку гідрування натрієм у рідкому амоніаку кінцевий алкен матиме транс-будову:[1]
Механізм цієї реакції подібний до механізму відновлення за Берчем: натрій, розчинений в амоніаку, утворює електрид натрію , який вступає в реакцію одноелектронного відновлення з алкіном:
Галогенування[ред. | ред. код]
Галогенування алкінів протікає за механізмом AE, як і в алкенів, проте із меншою швидкістю. Цю реакцію можуть каталізувати кислоти Льюїса, зокрема, FeCl3, SbCl3.
Здебільшого приєднання галогенів веде до утворення транс-дигалогенопохідної. На першій стадії молекула галогену приєднується за місцем потрійного зв'язку, утворюючи π-комплекс. Після відщеплення одного атома галогену у формі аніону Hal- відбувається перегрупування комплексу у катіон, де залишковий атом галогену є містковим. Ця стадія є лімітуючою. Після цього відщеплений галоген-аніон приєднується до катіона, зі сторони, протилежної до першого галогенового атома, що і визначає транс-будову кінцевої сполуки.
Приєднання за потрійним зв'язком загалом протікає важче, аніж в алкенів. Це можна спостерігати на прикладі реакції вибіркового галогенування вуглеводнів, що одночасно містять подвійний і потрійний зв'язки:
Однак за наявності спряжених (розташованих через один) подвійного і потрійного зв'язків відбувається галогенування потрійного.
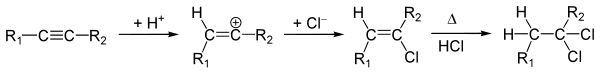
Гідрогалогенування[ред. | ред. код]
Приєднання галогеноводнів (реакція гідрогалогенування) протікає у дві стадії із утворенням гемінальних дигалогенопохідних алканів, відповідно до правила Марковникова. Механізм гідрогалогенування на першій стадії передбачає послідовне утворення π-комплексу внаслідок приєднання галогеноводню за місцем потрійного зв'язку, відщеплення галогенід-аніону та перегрупування залишкової частинки у карбокатіон та приєднання аніону. Приєднання на другій стадії є аналогічним до заміщених алкенів:
Загалом реакційна здатність алкінів у випадку такої взаємодії є у 100—1000 разів меншою, аніж в алкенів.
На додачу до реакцій нуклеофільного приєднання бромоводень у присутності пероксидів може також приєднуватися за вільнорадикальним механізмом, який протікає всупереч правилу Марковникова (ефект Караша).
Особливе практичне значення серед реакцій гідрогалогенування має каталітичне гідрохлорування ацетилену у присутності солей Hg(II), продуктом якого є вінілхлорид — мономер для отримання промислово важливого полівінілхлориду.
Гідратація[ред. | ред. код]
Алкіни здатні приєднувати воду в присутності сульфатної кислоти і солей Hg(II). Ця взаємодія має назву реакція Кучерова. Проміжним продуктом реакції є енол, який швидко перегруповується у кетон:
Реакція гідратації ацетилену стала основою для промислового виробництва ацетальдегіду, проте із часом перестала використовуватися через токсичність використовуваних солей ртуті.
Реакції окиснення[ред. | ред. код]
При дії сильних окисників (таких як перманганат калію, озон) в алкінах відбувається розривання потрійного зв'язку й утворення двох карбонових кислот:
Зміною pH середовища можна досягти припинення реакції на стадії утворення дикетонів:
Реакції полімеризації[ред. | ред. код]
Першим прикладом олігомеризації алкінів стала реакція димеризації ацетилену за наявності солей Cu(I), відкрита Дж. Ньюлендом. Реакція, що веде до утворення вінілацетилену, протікає як приєднання аніону HC≡C- за місцем потрійного зв'язку:
Порівняно більше практичне значення має відкрита М. Бертло реакція циклотримеризації ацетилену, котра відкрила шлях до синтезу бензену та інших ароматичних сполук:
Отримуваний Бертло бензен мав низький вихід, однак застосування активованого вугілля як каталізатора, запроваджене М. Зелінським і Б. Казанським, дало змогу вдосконалити реакцію.
Пізніше Вальтер Реппе здійснив реакцію тетрамеризації ацетилену під дією ціаніду нікелю Ni(CN)2, отримавши циклооктатетраєн:
Тримеризація бут-2-ину продуктом реакції дає гексаметилбензен:
Також алкіни мають здатність полімеризуватися з утворенням спряжених полієнів:
Див. також[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Алкіни |
Примітки[ред. | ред. код]
- ↑ Clayden, Jonathan. (2004). Organic chemistry. Oxford University Press. ISBN 0-19-850346-6. OCLC 442120139.
Посилання[ред. | ред. код]
- АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ [Архівовано 10 березня 2016 у Wayback Machine.] // Фармацевтична енциклопедія
Джерела[ред. | ред. код]
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
- Гауптман З., Грефе Ю., Ремане Х. Органическая химия / Пер. с нем. под ред. В. М. Потапова. — М. : Химия, 1979. — 832 с. (рос.)
- Травень В. Ф. Органическая химия. Учебник для вузов. — М. : ИКЦ «Академкнига», 2004. — Т. 1. — 727 с. — ISBN 5-94628-068-6. (рос.)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||















![{\displaystyle \mathrm {CH_{3}{-}C{\equiv }CH+[Ag(NH_{3})_{2}]OH\longrightarrow CH_{3}{-}C{\equiv }C{-}Ag\downarrow +2NH_{3}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7160b51f8c0c766d974486d02b8b5912a13eeaf)
![{\displaystyle \mathrm {HC{\equiv }CH+2[Cu(NH_{3})_{2}]OH\longrightarrow Cu{-}C{\equiv }C{-}Cu\downarrow +4NH_{3}+2H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d9059770e80e456a4518a3107592c7a891fd65a)



![{\displaystyle {\ce {[Na(NH3)6]+ e-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5a61f808dc024be9bafaa613c9d28db013384b6)










![{\displaystyle \mathrm {nR^{1}C{\equiv }CR^{2}\longrightarrow [-(R^{1})C{=}C(R^{2})-]_{n}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7d44df5ca9ef7b2117fc9a1741ebfbdcd4ab3b8)
