Алотропи заліза


Залежно від тиску та температури, залізо може існувати в трьох алотропних формах при атмосферному тиску: альфа-залізо (α-Fe, ферит), гамма-залізо (γ-Fe, аустеніт) та дельта-залізо (δ-Fe). При дуже високому тиску може існувати четверта форма заліза - епсилон (ε-Fe, гексаферум). Деякі суперечливі експериментальні дані вказують на можливість існування п'ятої форми заліза за високих тисків і температур, яка є стабільною при дуже високих значеннях тиску.[1]
Фази заліза при атмосферному тиску мають велике значення через різну розчинність вуглецю в них, що призводить до утворення різних типів сталей. Фази заліза високого тиску також є важливими моделями для вивчення твердих частин планетарних ядер. Загалом, приймається, що внутрішнє ядро Землі складається головним чином з кристалічного сплаву заліза-нікелю зі структурою ε.[2][3][4] Зовнішнє ядро, що оточує тверде внутрішнє ядро, вважається рідким залізом, змішаним з нікелем та деякими легкими елементами.
Алотропи стандартного тиску[ред. | ред. код]
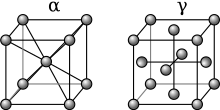
Альфа-залізо (α-Fe)[ред. | ред. код]
При температурах нижче 912°C (1,674°F), залізо має об’ємно-центровану кубічну (ОЦК) кристалічну структуру і відоме як α-залізо або ферит. Це стабільна термодинамічно фаза, що характеризується відносно низькою твердістю. Альфа-залізо може бути піддане тиску до приблизно 15 ГПа, після чого воно перетворюється в фазу високого тиску, відому як ε-залізо, про що йдеться далі.
У магнітному відношенні α-залізо є парамагнітним при високих температурах. Однак нижче його температури Кюрі ( T C або A 2 ) 771 °C (1044 К або 1420 °F), він стає феромагнітним . У минулому парамагнітна форма α-заліза була відома як бета-залізо (β-Fe). Навіть незважаючи на те, що незначне тетрагональне спотворення у феромагнітному стані справді є справжнім фазовим переходом, безперервний характер цього переходу призводить до лише незначного значення при термообробці сталі. Лінія A 2 утворює межу між бета-полями заліза та альфа-полями на фазовій діаграмі на малюнку 1.
Магнітні властивості α-заліза залежать від температури. При високих температурах воно є парамагнітним. Однак при температурі Кюрі ( T C або A 2 ) нижче 771°C (1044 K або 1420°F),[5] воно стає феромагнітним. Раніше парамагнітна форма α-заліза була відома як бета-залізо (β-Fe).[6][7] Хоча тетрагональне спотворення у феромагнітному стані є справжнім фазовим переходом, безперервний характер цього переходу призводить до незначного впливу на термообробку сталі. Лінія A 2 на фазовій діаграмі, зображеній на малюнку 1, визначає межу між бета-полями заліза та альфа-полями.
Фізичні властивості магнетичної поведінки α-заліза залежать від температури. При високих температурах воно проявляє парамагнетичну поведінку. Однак при температурі Кюрі ( T C або A 2 ) нижче 771°C (1044 K або 1420°F), воно стає феромагнетичним. Раніше парамагнетичну форму α-заліза називали бета-залізом (β-Fe). Хоча тетрагональне спотворення у феромагнетичному стані є справжнім фазовим переходом, поступовий характер цього переходу призводить лише до незначного впливу на термообробку сталі. Лінія A 2 на фазовій діаграмі, зображеній на малюнку 1, визначає межу між бета-полями заліза та альфа-полями.

Первинна фаза низьковуглецевої або м'якої сталі та більшості чавунів при кімнатній температурі є феромагнітне α-Fe. [8] Його твердість становить приблизно 80 за шкалою Брінелля.[9][10] Максимальна розчинність вуглецю досягається приблизно 0,02 мас.% при 727 °C (1341 °F) і 0,001% при 0 °C (32 °F).[11] Коли вуглець розчиняється у залізі, атоми вуглецю займають міжвузлові "дірки". Завдяки тому, що розмір вуглецю приблизно вдвічі більший за діаметр тетраедричного отвору, він створює сильне локальне поле деформації.
М'яка сталь, яка містить до приблизно 0,2 мас.% вуглецю, складається в основному з феромагнітного α-Fe та зростаючої кількості цементиту (Fe3C), відомого також як карбід заліза. Ця суміш має пластинчасту структуру, відому як перліт. Оскільки бейніт і перліт містять α-Fe як один з компонентів, будь-який залізовуглецевий сплав буде містити певну кількість α-Fe, якщо він досягне рівноваги при кімнатній температурі. Кількість α-Fe в сплаві залежить від процесу охолодження.
A 2 критична температура та індукційний нагрів[ред. | ред. код]

Важливі параметри сталі, такі як β-Fe (β-залізо) і критична температура A2, мають велике значення при використанні індукційного нагрівання для термічної обробки поверхневого зміцнення та інших процесів. Зазвичай, сталь аустенітизується при температурах 900-1000°C перед загартуванням і відпуском. Високочастотне змінне магнітне поле, використовуване в індукційному нагріві, нагріває сталь двома механізмами нижче температури Кюрі: джоулевим нагріванням або опором і втратами на феромагнітний гістерезис. Вище критичної температури A2, механізм гістерезису зникає, і енергія, необхідна для підвищення температури на один градус, стає значно вищою, ніж нижче A2. Це може вимагати використання спеціальних схем узгодження навантаження для зміни імпедансу в індукційному джерелі живлення, щоб компенсувати ці зміни.[12]
Гамма-залізо (γ-Fe)[ред. | ред. код]
При нагріванні чавуну вище 912°C (1,674°F), його кристалічна структура змінюється на гранецентровану кубічну (ГЦК) кристалічну структуру. У цій формі його називають гамма-залізом (γ-Fe) або аустенітом. γ-залізо може розчиняти значно більше вуглецю (аж 2,04% за масою при 1146°C). Ця γ-форма насичення вуглецем проявляється в аустенітній нержавіючій сталі .
Дельта залізо (δ-Fe)[ред. | ред. код]
Алотропи високого тиску[ред. | ред. код]
Епсилон залізо / гексаферум (ε-Fe)[ред. | ред. код]
При тиску вище приблизно 10-13 ГПа і температурі наближено до 700 К, α-залізо перетворюється на гексагональну структуру щільної упаковки (hcp), також відому як ε-залізо або гексаферум. Високотемпературна γ-фаза також може перетворитися на ε-залізо, але це зазвичай вимагає значно вищих тисків при збільшенні температури. Триплетна точка гексаферуму, фериту і аустеніту має значення 10,5 ГПа при 750 К[13]. У сплавах ε-заліза з Mn, Os і Ru спостерігається антиферомагнетизм[14].
Експериментальна висока температура і тиск[ред. | ред. код]
Альтернативна стабільна форма, якщо вона існує, може з’явитися при тиску щонайменше 50 ГПа і температури щонайменше 1500 К; вважалося, що він має орторомбічну або подвійну ГПУ структуру [1]. Станом на December 2011, останні та поточні експерименти проводяться на високому тиску та надщільних вуглецевих алотропах.
Фазові переходи[ред. | ред. код]
Температури плавлення і кипіння[ред. | ред. код]
Опубліковані дані (на 2007 рік) вказують на те, що потрійна точка γ-ε-рідини встановлена при тисках, відмінних на декілька десятків гігапаскалів, та при температурі плавлення 1000 К. Загалом, комп'ютерне моделювання молекулярної динаміки плавлення заліза та експерименти з ударними хвилями показують вищі точки плавлення та значно крутіший нахил кривої плавлення, ніж статичні експерименти, проведені на елементах алмазного ковадла[15].
Температури плавлення та кипіння заліза, разом із його ентальпією атомізації, нижчі, ніж у попередніх елементів 3d групи від скандію до хрому. Це свідчить про менший внесок 3d-електронів у металеві зв'язки, оскільки вони все більше притягуються до інертного ядра[16]; однак вони вищі, ніж значення для марганцю, оскільки цей елемент має наполовину заповнену 3d-підоболонку, і, отже, його d-електрони менше делокалізовані. Така ж тенденція спостерігається для рутенію, але не для осмію[17].
Структурні фазові переходи[ред. | ред. код]
Точні температури, при яких залізо переходить з однієї кристалічної структури в іншу, залежать від наявності та типу розчинених елементів у залізі. Фазові межі між різними твердими фазами відображаються на бінарних фазових діаграмах, де температура відображається від відсотка заліза. Додавання деяких елементів, наприклад хрому, звужує температурний діапазон гамма-фази, тоді як інші збільшують його. Елементи, які зменшують діапазон гамма-фази, призводять до з'єднання межі фази альфа-гамма з межею фази гамма-дельта, утворюючи так звану гамма-петлю. Додавання таких елементів дозволяє зберігати залізо в об'ємно-центрованій кубічній структурі та запобігає фазовому переходу сталі в інші тверді стани[18].
Дивись також[ред. | ред. код]
Список літератури[ред. | ред. код]
- ↑ а б Boehler, Reinhard (2000). High-pressure experiments and the phase diagram of lower mantle and core materials. Reviews of Geophysics. American Geophysical Union. 38 (2): 221—245. Bibcode:2000RvGeo..38..221B. doi:10.1029/1998RG000053.
- ↑ Cohen, Ronald; Stixrude, Lars. Crystal at the Center of the Earth. Архів оригіналу за 5 February 2007. Процитовано 5 лютого 2007.
- ↑ Stixrude, Lars; Cohen, R.E. (March 1995). High-Pressure Elasticity of Iron and Anisotropy of Earth's Inner Core. Science. 267 (5206): 1972—5. Bibcode:1995Sci...267.1972S. doi:10.1126/science.267.5206.1972. PMID 17770110.
- ↑ What is at the centre of the Earth?. BBC News. 31 серпня 2011.
- ↑ а б Alloy Phase Diagrams. ASM Handbook. Т. 3. ASM International. 1992. с. 2.210, 4.9. ISBN 978-0-87170-381-1.
- ↑ D. K. Bullens et al., Steel and Its Heat Treatment, Vol. I, Fourth Ed., J. Wiley & Sons Inc., 1938, p. 86.
- ↑ Avner, S.H. (1974). Introduction to physical metallurgy (вид. 2nd). McGraw-Hill. с. 225. ISBN 978-0-07-002499-1.
- ↑ Maranian, Peter (2009), Reducing Brittle and Fatigue Failures in Steel Structures, New York: American Society of Civil Engineers, ISBN 978-0-7844-1067-7.
- ↑ Structure of plain steel, процитовано 21 жовтня 2008.
- ↑ Alvarenga HD, Van de Putte T, Van Steenberge N, Sietsma J, Terryn H (January 2015). Influence of Carbide Morphology and Microstructure on the Kinetics of Superficial Decarburization of C-Mn Steels. Metall Mater Trans A. 46 (1): 123—133. Bibcode:2015MMTA...46..123A. doi:10.1007/s11661-014-2600-y.
- ↑ Smith, William F.; Hashemi, Javad (2006). Foundations of Materials Science and Engineering (вид. 4th). McGraw-Hill. с. 363. ISBN 0-07-295358-6.
- ↑ Semiatin, S.L.; Stutz, D.E. (1986). Induction Heat Treatment of Steel. ASM International. с. 95–98. ISBN 978-0-87170-211-1.
- ↑ Anzellini, Simone; Errandonea, Daniel (29 вересня 2021). Properties of Transition Metals and Their Compounds at Extreme Conditions. Crystals. 11 (10): 1185. doi:10.3390/cryst11101185. ISSN 2073-4352.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ G. C. Fletcher; R. P. Addis (November 1974). The magnetic state of the phase of iron (PDF). Journal of Physics F: Metal Physics. 4 (11): 1954. Bibcode:1974JPhF....4.1951F. doi:10.1088/0305-4608/4/11/020. Процитовано 30 грудня 2011.
- ↑ Boehler, Reinhard; Ross, M. (2007). Properties of Rocks and Minerals_High-Pressure Melting. Mineral Physics. Treatise on Geophysics. Т. 2. Elsevier. с. 527—41. doi:10.1016/B978-044452748-6.00047-X. ISBN 9780444527486.
- ↑ Greenwood and Earnshaw, p. 1116
- ↑ Greenwood and Earnshaw, pp. 1074–75
- ↑ Myer Kurz, ред. (22 липня 2002). Handbook of Materials Selection. с. 44. ISBN 9780471359241. Процитовано 19 грудня 2013.