Дендритний потенціал дії

Хоча довгий час вважалось, що потенціал дії (ПД) може генеруватись переважно на низькопороговому початковому сегменті нейронного аксона (AIS), протягом останніх десятиліть було накопичено багато даних на користь того, що потенціали дії також виникають в дендритах. Такий дендритний ПД, для того щоб відрізнити його від аксонного потенціалу дії, часто називають «дендритний спайк».
Дендритні спайки локально генеруються в дендритах багатьох типів нейронів ЦНС шляхом фокальної стимуляції дендриту. Загалом, не зважаючи на їх дещо змішану природу, можна чітко розрізнити три головні типи дендритних спайків, відповідно до класу активних провідників, що лежать в їх основі: Na+, Ca2+ (або плато-спайки) та N-метил-D-аспартат (NMDA) спайки. Хоча різні електричні властивості, типи каналів та різноманіття дендритної морфології породжують відмінні дендритні ПД, з різним часом наростання та тривалістю, дендритні спайки володіють харакатерними для класичних (аксонних) ПД'ї властивостями: вони мають поріг збудження, рефракторний період і активно розповсюджуються на певну відстань.[2]
Дендритний спайк є нелінійним феноменом, який здатен подолати вплив інших синапсів і запобігти інтеграції додаткових вхідних синаптичних імпульсів, постаючи як результат локальної сумації синхронізованих кластерів вхідних сигналів до дендриту. Дендритні спайки зазвичай є значно повільнішими, аніж аксонні ПД і генеруються або ізольовано від соми (локальні спайки), або збігаючись із аксонними потенціалами дії зворотного поширення. Якщо дендритний спайк є достатньо сильним, він може поширитись до тіла нейрону (соми) та призвести до генерації сомато-аксонного потенціалу дії, чи навіть пачок (bursts) потенціаілів дії (кілька спайків).[3]
Існування дендритних спайків суттєво збільшує репертуар обчислювальних функцій нейрону, уможливлюючи функціональну асоціацію локальних вхідних сигналів[4]; підсилення віддалених синаптичних імпульсів, що в протилежному випадку не могли б мати вплив на соматичний потенціал[5]; впливати на стимуляцію синаптичної пластичності.
Історія[ред. | ред. код]
Хоча в 1950-х та ранніх 1960-х панівним було уявлення, що дендрити є пасивними відростками нейронів, які просто інтегрують збуджувальні та інгібуючі імпульси, накопичувались поодинокі свідчення, що в дендритах також може поширюватись потенціал дії. Вперше його зафіксував у 1951 році видатний китайський нейрофізіолог Hsiang-Tung Chang[en], який тоді працював в Єльському університеті. В опублікованій того року статті він повідомив про те, що дендрити можуть збуджуватись під впливом електричної стимуляції і здатні генерувати потенціали дії, які відрізняються від аксонних тим, що не є «все-або-нічого»[1] потенціалами[6]. У наступних восьми своїх публікаціях він підтвердив свої знахідки, втім більшість нейробіологів поставились до них критично, надалі вважаючи, що тільки аксони є єдиним місцем генерації потенціалу дії.
Невдовзі після Чанга, в результаті реєстрації популяційних відповідей в полі CA1 нейронів гіпокампа, були отримані чергові докази щодо генерації дендритами спайків. В середині 1950-х нейрофізіологи зафіксували електрогенну відповідь в апікальних дендритах CA1 нейронів, які передували соматично-аксонному популяційному спайку (PS)[7][8][9][10]. Тоді ж, Джон Еклс з колегами виявили, що спайк також може бути генерований в дендритах мотонейронів з хроматолізом.[11] У 1961 році, Кендел і Спенсер в своїй класичній статті[12] повідомили про внутрішньоклітинну реєстрацію малого, спайк-подібного потенціалу (названого «швидкий препотенціал») в апікальних дендритах CA1 нейронів гіпокампу і вперше зробили припущення, що дендрити можуть генерувати спайки. Згодом, схожі «дендритні спайки» були виявлені в мозочкових клітинах Пуркіньє.[13], а також, — зокрема радянськими фізіологами, — в нейронах кори черепах (1976)[14], нюховій цибулині[15] та сенсомоторній корі щурів.[16]
Втім, лише з кінця 1980-х — початку 1990-х вчені почали поступово схилятись до думки, що дендрити не тільки передають інформацію, але й змінюють та зберігають. Найбільш однозначно існування дендритних спайків було показано в серії статей Грега Стюарта та Берта Закмана протягом 1993—1998 років[17][18][2], які використали ціло-клітинні петч-електроди для реєстрації одночасно соматичного потенціалу дії та дендритного спайка. Це були перші безпосередні свідчення існування потенціалзалежних іонних каналів в дендритах, що слугують для генерації та підтримки дендритних потенціалів дії.
Дендритні спайки[ред. | ред. код]
Na+ — Ca2+ спайки[ред. | ред. код]

Починаючи з 1990-х повідомлення про реєстрацію дендритних спайків в гіпокампальних та неокортикальних нейронах в зрізах та in vivo стають все частішими, все більш переконуючи, що дендрити спроможні генерувати регенеративні спайки за допомогою потенціал-залежних натрієвих (Na+) та кальцієвих (Ca2+) каналів[19][20]. Одночасні соматичні та дендритні записи струму безпосередньо продемонстрували генерацію дендритних спайків. В пірамідних нейронах 5 шару кори та гіпокампа було виявлено дендритні спайки, що передують соматичним спайкам, і які поширюються в обох типах нейронів через сильне синаптичне збудження.[21] Також у мозочкових клітинах Пуркіньє, інтернейронах гіпокампа, мітральних клітинах нюхової системи та гангліозних клітинах сітківки було виявлено дендритні спайки та відокремлені від соматичних потенціали дії.
Одна з можливих причин, чому ці спайки не було видно раніше, це те, що вони можуть маскуватись соматичними спайками, які вони викликають. Генерування в дендритах спайків найчастіше пов'язане із активною провідністю Ca2+ чи Na+ каналів, або їх обох.[22][23] Деполяризація віддаленого апікального дендрита призводить до активації Ca2+ провідностей, які генерують Ca2+ спайк.[24]
Одним з найбільш унікальних прикладів впливу дендритних Ca2+ спайків на поширення синаптичного потенціалу і активного впливу на сому є пірамідальні нейрони 5 шару кори. Внаслідок відносно великої довжини апікального дендрита багато синапсів знаходяться настільки далеко від соми, що за відсутності якого-небудь компенсуючого механізму, вони не матимуть жодного впливу на соматичний потенціал.[25] Втім, не тільки значне пасивне загасання, але навіть активні (Iр та K+ каналів А-типу) струми здатні в цих нейронах призвести до суттєвого послаблення вхідного синаптичного сигналу.[26][27]
Оскільки унікальна морфологія дендритів пірамідальних нейронів L5 дозволяє їм виконувати одні із найскладніших обчислювальних функцій в ЦНС, то для підтримки такої структури дендритів та компенсації її негативних ефектів на проходження сигналу, біля головної точки розгалуження апікального дендрита (~500-600 мкм від соми) існує додаткова, поряд із аксонною, зона генерації спайків.[28]
Позаяк цей регіон дендрита характеризується досить високою щільністю потенціал-залежних кальцієвих каналів, то вважається що дистальне (віддалене) апікальне дендритне дерево може діяти, як окремий центр інтеграції синаптичних імпульсів і генерувати власний, Ca2+ спайк, в такий спосіб спонукаючи сому та аксон до породження потенціалу дії.[29]
Кальцієвий спайк в пірамідальних нейронах 5 шару є настільки сильним, що будучи активований, він веде до повторюваних розрядів.[3] Оскільки вони генерують довгі (до 50 мсек in vitro) плато-потенціали, то тривала деполяризація, яка внаслідок цього виникає і поширюється до аксонного початкового сегменту, спричиняє високочастотні пачки (bursts) потенціалів дії[30] Особливо неочікуваним було відкриття того, що генерування дендритного Ca2+ спайку породжує більше вихідних потенціалів дії в аксоні, аніж підпороговий вхідний імпульс до соми.[31][32] Наявність віддалених дендритних Ca2+ спайків може одразу бути помічена в сомі завдяки характерному паттерну пачок 2-4 спайків з частотою 200 Гц.[33] Тому, можливо, це слугує як засіб для сигналювання сусіднім нейронам про появу дендритних спайків, і тоді ці пачки спайків можуть бути ключовим механізмом кортикального нейронного коду[34]
У клітинах Пуркіньє генерація дендритних спайків більш проста: оскільки в їх дендритах нема Na+ каналів, дендритні потенціали дії обумовлені Ca2+ каналами, що узгоджується із більшою шириною (spike width) цих спайків.
На відміну від локально обмеженої зони для генерації Ca2+ спайків, породження локального Na+ спайку є можливим для більшості регіонів дендритних дерев пірамідальних клітин[35][36]) Ці дендритні спайки схожі на соматичні потенціали дії, оскільки характеризуються швидким зростанням і короткою тривалістю, однак їх поширення до соми є менш стійким та може значно слабшати в сомі, особливо якщо вони генеруються в тонких дендритах[37]
Незважаючи на таке послаблення, Na+ спайки здатні збільшувати часову точність вихідного сигналу соматичного потенціалу дії завдяки швидкості висхідної фази деполяризації в сомі. Оскільки активація локальних Na+ спайків потребує короткої локальної деполяризації з великою амплітудою, то для їх породження потрібно лише, щоб множина синхронних вхідних імпульсів активуавалсь на невеликому відрізку дендрита. Подібна синхронна і кластерна активація синапсів була виявлена в CA1 пірамідальних нейронах гіпокампу, де вивільнення глутамату на радіальний нахилений дендрит призводило до генерації Na+ спайків в єдиній гілці, роблячи її єдиним інтегративним сегментом та місцем стимуляції синаптичної пластичності[37]
Хоча майже всі дослідники визнають сьогодні існування цих дендритних спайків, серед них існує розходження щодо ролі та впливу цих спайків на соматично-аксонний потенціал дії. Кілька досліджень показало, що Na+ і Ca2+ спайки ледь наближаються до соми та аксону, маючи малу амплітуду і часто залишаючись в межах місця їх виникнення. Потрійна реєстрація із аксону, соми та апікального дендриту неокортикального пірамідального нейрону показує, що аксонний потенціал дії завжди передує соматичному потенціалу дії, навіть якщо дендритний спайк передує соматичному потенціалу дії.[38] Ці дані означають, що дендритні спайки не надто надійно поширюються до соми та аксону і, як наслідок, обумовлена дендритними спайками деполяризація що досягає соми є часто малою. Втім, в деяких випадках, соматична деполяризація внаслідок поєднання збуджувального постсинаптичного потенціалу(ЗПСП) та дендритного спайку є достатньо великою для генерації потенціалу дії в аксоні, тоді як в ін. випадках, ЗПСП та дендритний спайк разом зумовлюють лише підпорогову деполяризацію в сомі та аксоні, обмежуючись ізольованим дендритним спайком.
На відміну від великих, «все-або-нічого»[2] потенціалів дії, що виникають в аксоні чи сомі, дендритні спайки варіюються в амплітуді та регулюються попередньою нейронною історією синаптичної та потенціальної активності. Також, на відміну від аксонного потенціалу дії, дендритні спайки кардинально послаблюються, під час поширення до сом, часто не призводячи до потенціалу дії в аксоні[39]. Зважаючи на цю відмінність від потенціалу дії, деякі дослідники вважають, що дендритні спайки слід розглядати як 1) впливові, але не абсолютні вирішальні чинники генерації потенціалу дії в аксоні, 2) як форму активної синаптичної інтеграції, а кінцеве місце синапчтиної інтеграції визнати за аксоном.[40]
| Ca2+ спайк[41] |
|---|
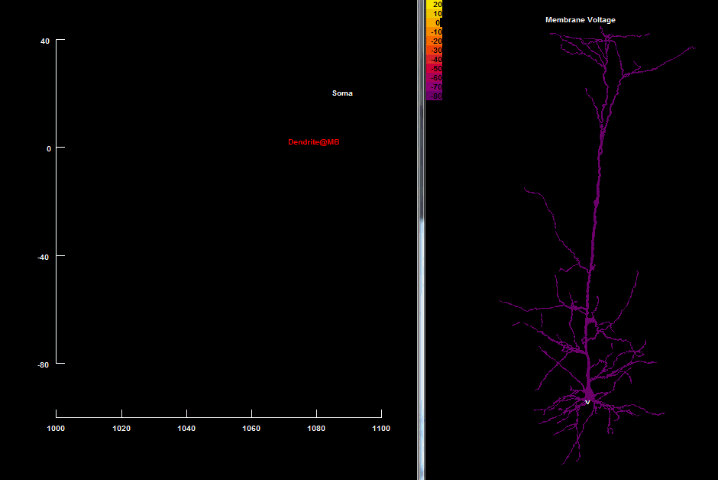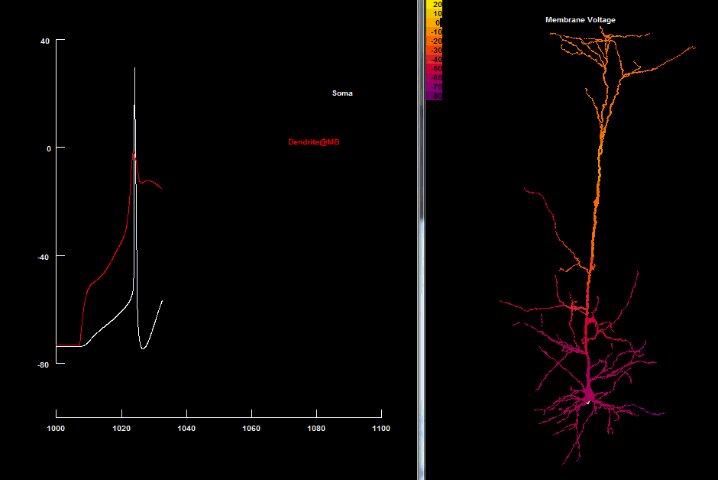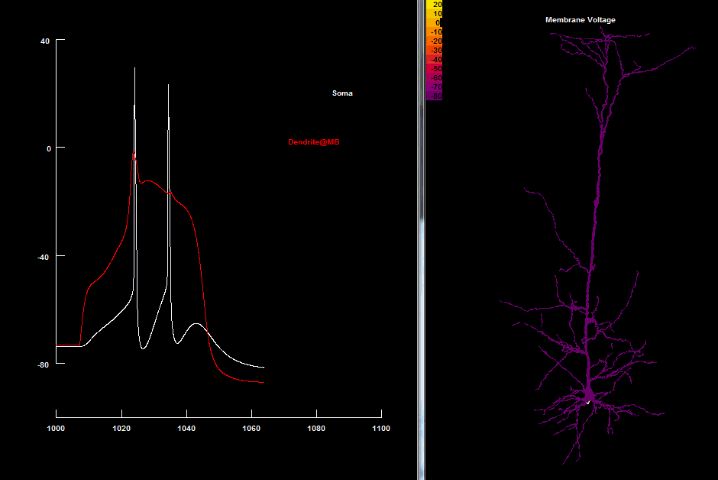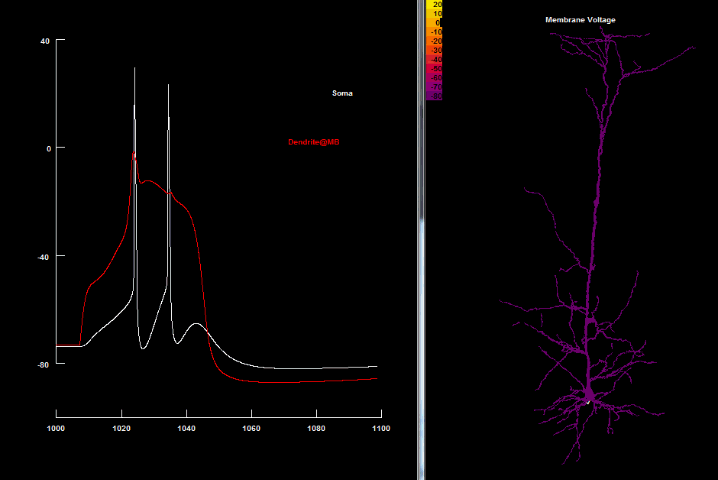
|

NMDA-спайк[ред. | ред. код]
Ряд експериментальних дослідів показало, що активні дендрити можуть генерувати локальні спайки, коли синаптичний вхідний імпульс є достатньо згрупованим у просторі та часі (останнє є головною умовою для існування детектора збігів у дендритах). Такі спайки можуть бути генеровані за допомогою будь-якої комбінації потенціалзалежних регенеративних внутрішніх струмів, присутніх в дендритній мембрані. До прикладу, струм, зумовлений активацією іонотропного рецептора глутамата — NMDA (N-метил-D-аспартат) рецептора — є надзвичайно потенціалзалежним.
Ключовою і незвичною біофізичною характеристикою NMDA рецептора є те, що він пасивний за нормальних потенціалів спокою і не проводить струм, допоки мембрана не деполяризується. Коли рецептор зв'язується глутаматом, його пора відкривається, але провідність каналу є заблокована позаклітинними Mg2+ іонами. Деполяризація постсинаптичної мембрани виштовхує Mg2+ з каналу, дозволяючи йому проводити суміш Na+, K+ та Ca2+.[44] Тому, внаслідок потенціал-залежності Mg2+ блокування, провідність NMDA рецептора є суперлінійною функцією постсинаптичної напруги в діапазоні потенціалів від спокою до −20 мВ[45]
Кінетика Mg2+ блокування є швидкою, тому, на відміну від повільно деактивуючогося рецептору, з'єднання деполяризації з канальним блокатором є досить швидким (суб-мсек), дозволяючи постсинаптичній деполяризації швидко відкрити канал за десятки мілісекунд після пресинаптичного потенціалу дії. Проте, кінетика Mg2+ розблокування також має повільні компоненти, які взаємодіють із кінетикою каналу у спосіб, залежний від часу, що веде до звуження часового інтервалу в межах якого постсинаптична деполяризація може спричинити відкриття NMDA каналу. Інша важлива риса NMDA рецептора — це його проникність для Ca2+ іонів. Через ці вторинні посередники рецептор поєднує свою активність із ферментами.[46] Завдяки цим унікальним властивостям, NMDA рецептор відіграє ключову роль у синаптичній пластичності.

Нещодавні дослідження продемострували, що синхронні синаптичні вхідні імпульси до однієї і тієї ж самої дендритної гілки 5 шару пірамідальних нейронів деполяризує мембрану і створює такий позитивний зворотний зв'язок, що струм через NMDA рецептор деполяризує мембрану і залучає ще більше NMDA-переносимих струмів (підтримуючись активацією дендритних Na+ і Ca2+ каналів)[47]. Цей «все-або-нічого»[3] феномен називається NMDA-спайк і він має значно більшу локальну амплітуду та тривалість, аніж корокті Na+ спайки, але меншу амплітуду, аніж Ca2+ спайки.
In vitro, NMDA-спайк (або плато-потенціали) були знайдені у всіх класах тонких дендритів неокортикальних збуджувальних нейронів і у всіх шарах неокортексу[48][49][35], а також в гіпокампальних апікальних пучках.[50]
Для більшості регіонів на дендритах потрібно лише невелике число синаптичних вхідних сигналів для генерації NMDA-спайку: ~10 згрупованих вхідних імпульсів до одного шипика[51] Втім, подібна згрупованість (кластерність) не є необхідною умовою NMDA-спайків, оскільки вони можуть бути генеровані навіть розподіленими на дендритах синаптичними імпульсами.[52] З іншого боку, деполяризація разом із минулим (від попередніх активацій) зв'язуванням глутамату знижує глутаматний поріг, уможливлюючи поєднання NMDA-спайків[53]
Результатом NMDA спайків є нелінійна відповідь на синаптичні вхідні імпульси із кроковим збільшенням дендритно-соматичної деполяризації, яка призводить до генерації плато-потенціалів, що тривають від 20 до 100 мс.[53] Ці тривалі потенціали більш ефективно поширюються до соми, аніж відповідні підпорогові ЗПСП'и. І хоча NMDA спайк рідко долає поріг для генерації соматичних Na+ потенціалів дії, він значно підсилює своєю локальною активністю вплив на сому синхронно активованих синаптичних вхідних сигналів в базальних дендритах і тим самим збільшує електричний зв'язок між синапсами та сомою.[35] Така локальна дендритна інтеграція синаптичних імпульсів має сигмоїдальний нелінійний характер. Таким чином, NMDA спайк наділяє кожен базальний дендрит здатністю виконувати складну інтеграцію вхідних синаптичних сигналів, результат якої потім передається до аксо-соматичної точки інтеграції для генерації нейронного потенціалу дії[54][51]
Оскільки, — на відміну від спайків, зумовлених потенціал-залежними каналами, — потреба в глутаматі не дозволяє NMDA-спайку поширюватись за межі регіону синаптичної активації, обмежуючи його активність тонкими дендритними гілками, то він розглядається, як один з дендритних механізмів для виявлення збігу вхідних імпульсів, що надходять в безпосередній часовій та/або просторовій близькості.[54][55]
Тож, існування цих каналів та зумовлених ними спайків наділяє нейрон здатністю за дуже короткий час виявляти збіг в сусідніх синаптичних входах, що завжди вважалось притаманним тільки нейронам слухової системи.[56] В CA1 пірамідальних нейронах існує схожий локальний механізм виявлення збігів, але він пов'язаний з іншим потенціал-залежним струмом — Na+.
Зважаючи на їх складну природу, функціональні наслідки NMDA-спайків для кіркової обробки інформації можуть бути різноманітними, залежно від регіону кори. Будучи локалізованими на вході до дендриту, вони дозволяють виконувати паралельну нелінійну обробку сигналів в базальних дендритах, що якісно різнить їх від кальцієвих спайків в апікальних дендритах, які поширюються на кілька мікрометрів в межах дендритного дерева[49] NMDA-спайки можуть також забезпечити ефективний механізм для NMDA-залежної довготривалої синаптичної потенціації одночасно активованих сусідніх синапсів без участі потенціалів дії зворотного поширення.[45] (Див. докладніше NMDA-залежна дендритна пластичність)
Генерація та поширення дендритних спайків[ред. | ред. код]
Хоча дендритні спайки багато в чому схожі до аксонних, вони мають ряд відмінностей, котрі суттєво впливають на дендритну обробку інформації. Для ілюстрації цієї відмінності найкраще підходять пірамідальні нейрони, які обробляють складну інформацію та мають ряд відмінних рис в генерації дендритного спайку. Найбільш детально виникнення та поширення дендритних спайків вивчено на прикладі CA1 пірамідальних нейронів гіпокампу, зокрема на віддаленому апікальному стовбурі та проксимальному пучку їх дендритів.[36]
На прикладі CA1 нейронів було виявлено, що поріг генерації дендритного спайку є на ~10 мВ більш деопляризованим, аніж поріг соматичного спайку (48 мВ для дендритів у порівнянні із 56 мВ для соми). Тобто, поріг для генерації потенціалу дії в дендритах є вищим, аніж в сомі[12][11], що може бути пов'язане із різними властивостями іонних каналів вздовж соматодендритної осі.

Оскільки блокування Na+ каналів цілком усуває можливість генерації дендритного спайку, то ці канали відіграють важливу роль в його генерації. На відміну від дендритів, аксони мають незрівнянно більшу щільність Na+ каналів, що знижує поріг для активації аксонного потенціалу дії у порівнянні із дендритним.[57][58] Втім, ще більш ключову роль у відмінності між порогами дендритних і сомато-аксонних спайків відіграє збільшення експресії в CA1 пірамідальних дендритах K+ каналів А-типу з їх віддаленням від соми.[26] Відтак, блокування IA струмів з допомогою 4-AP суттєво знижує порогову напругу для дендритних спайків.[36] Також внутрішньо випрямляючі K+ канали роблять значний внесок до вхідного опору і тому збільшують кількість вхідних сигналів, які необхідні для породження дендритного потенціалу дії, хоча вони не впливають на порогову напругу.
Внаслідок відносно високого порогу активації, дендритні спайки генеруються тільки після значної, швидкої деполяризації (~20 мВ в межах <1 мсек). Для цього велика кількість синаптичних вхідних імпульсів (~50 синапсів) повинна надійти до досить обмеженого регіону (<100 мкм) апікального дендрита в межах короткого часового інтервалу (~3 мсек).[59]
Генерації дендритного спайку також сприяють NMDA-рецептори, які протидіють викликаному AMPA синаптичними провідностями шунтуванню, що звужує максимальний інтервал поширення вхідних сигналів. NMDA-рецептори здатні розширювати просторово-часові інтервали (кластеризацію сигналів та їх розрізнення в часі), необхідні для генерації спайків[55]
Наслідокм впливу цих чинників є здатність спайку, генерованого в головному дендритному стовбурі, поширюватись до соми для породження вихідного потенціалу дії, в такий спосіб суттєво збільшуючи ефективність вхідного імпульсу, що згенерував дендритний спайк.[60] Тож, сильно синхронізований вхідний сигнал призводить, з незначним короткостроковим запізненням (<2 мсек), до генерації вихідного потенціалу дії для вхідних синаптичних рівнів (кількість активованих синапсів), які значно меншими аніж тоді, коли поширення дендритного спайку обмежене (напр., за присутності TTX).
Втім, навіть всі вище згадані умови не гарантують стійкого та надійного поширення дендритних спайків, які є досить слабкими, аби протистояти впливу інших чинників: мембранному потенціалу, відстані місця генерації від соми, позаклітинній іонній концентрації тощо. Саме тому в межах одного (пірамідального) нейрону можуть відбуватись складні та цікаві взаємодії між різними класами збуджувальних та інгібуючих синапсів, як виявлення збігів, BAC firing, дво- і тришарова інтеграція вхідних сигналів тощо.
Але навіть якщо дендритні спайки не поширюються до соми, вони здатні підсилювати синаптичні потенціали та збільшувати швидкість зростання соматичного ЗПСП, роблячи вихідний спайк більш точним та синхронізованим із вхідним синаптичним імпульсом.[55]
Зворотне поширення потенціалу дії[ред. | ред. код]
Накопичені за останні десятиліття дані значно відредагувати та доповнили нейронну доктрину Рамона-і-Кахаля, оскільки було виявлено, що в багатьох типів нейронів наявність збуджувальних іонних струмів в дендритах дозволяє їм підтримувати дендритні потенціали дії, що йдуть в зворотному напрямку — від соми до дендритів — т. зв. потенціал дії зворотного поширення [4] (back-propagating action potential, bAP).[61] bAP є активним, ретроградним сигналом, який розповсюджується в дендритне дерево та інформує синапси, що нейрон згенерував вихідний потенціал дії.
Існування зворотного поширення соматичного потенціалу є важливим механізмом, як для взаємозв'язку між дендритами та аксонами, так і для ефективного впливу аксонного ПД на дендритний спайк і навпаки, дендритів на сому та аксони. Саме завдяки bAP дендритні спайки узгоджуються із цілісною активністю нейрону та уможливлюють більш точний і надійний вплив синаптичних вхідних сигналів на кінцевий нейронний імпульс.
Проникнення потенціалу дії зворотного поширення в дендрити не є однаковим для всіх нейронів та навіть різниться серед дендритів одного і того ж самого нейрона. В багатьох клітинах (пірамідальних, інтернейронах гіпокампа, допамін- і ГАМК-поставляючих нейронах чорної субстанції (substantia nigra), мотонейронах спинного мозку та мітральних клітинах) потенціал дії активно поширюється назад у дендрити із малим або майже відсутнім зменшенням в амплітуді[62][63] У пірамідальних нейронах bAP проникають не тільки в апікальні дендрити, але навіть в радіальні нахилені та базальні дендрити, але можуть слабнути і вже пасивно поширюватись в апікальному пучку. І майже цілком пасивно bAP'и поширюються в клітинах Пуркіньє.[61]
Тож, ступінь поширення bAP не є однаковою та варіюється залежно від типу нейрону, що в значній мірі обумовлює також і різницю в електричній та обчислювальній активності цих нейронів. Оскільки активне зворотне поширення потенціалу в дендритах підсилюється потенціал-залежними Na+ каналами, то специфічна для кожного нейрону різниця в щільності дендритних Na+ каналів є однією із причин такої варіабельності bAP'ів.[35] Зокрема, експерименти та моделювання однозначно показали, що амплітуда bAP суттєво зменшується після блокування з допомогою TTX дендритних Na+ каналів у тих нейронах, які мають однакову щільність дендритних та соматичних Na+ каналів.[64] Тоді як в нейронах із низькою щільністю дендритних Na+ каналів, як в клітинах Пуркіньє в мозочку, амплітуда bAP є однаковою як за присутності, так і відсутності блокатора TTX.[65][57]
Іншим чинником, що впливає на ступінь розповсюдження bAP в дендритах є морфологія та розгалуження дендритних дерев різних типів нейронів.[66] Зокрема, зворотне поширення потенціалів дії в пірамідальних нейронах гіпокампа може зупинитись в дендритній точці розгалуження і не викликати кальцієвого електрогенезу[65] (Див. докладніше внзизу)

Окрім цього, значний вплив на діапазон поширення bAP має соматичний потенціал дії, оскільки чим більш він ширший, тим менше він загасатиме під час розповсюдження в дендритному дереві. Зважаючи на те, що однією з ролей bAP є ініціювання дендритного вивільнення нейромедіатору, то не дивно, що найбільш ефективним є зворотне поширення в дендритному дереві дофамінних нейронів чорної субстанції (середній мозок), оскільки ці клітини характеризуються найширшим соматичним потенціалом з-поміж усіх інших нейронів де був зафіксований bAP, і який, отже, дозволяє їм надійно та швидко вивільняти дофамін. Таку саму роль bAP виконує в мітральних клітинах нюхової цибулини, де соматичні потенціали дії також значно більш широкі, аніж в інших відомих нейронах.[67]
Важливим фактором у ефективному розповсюдженні чи загасанні bAP є також пасивні електричні властивості дендритних дерев. До прикладу, зниження ефективного мембранного опору внаслідок збільшення синаптичної активності може призвести до градуювального, хоч і помірного зменшення амплітуди потенціалу дії зворотного поширення.[68] Крім того, інгібіторні нейрони також можуть значно послабити bAP та навіть придушити кальцієвий електрогенез.[69]
Подібно до того, як ПД в апікальних дендритах пірамідальних нейронів 5 шару кори пов'язані із значним дендритним електрогенезом Ca2+, то так само було виявлено, що ПД зворотного поширення активують потенціал-залежні кальцієві канали, чим зумовлюють розширення дендритного спайку. Більше того, протягом пачкових розрядів (burst firing) цей кальцієвий електрогенез також збільшує амплітуду потенціалів дії зворотного поширення. Дендритне входження Ca2+ протягом bAP було виявлене в кількох типах нейронів, включаючи гіпокампальні CA1[70][71], неокортикальні[28] та ін. центральні нейрони.[2][72]
І хоча в більшості нейронів зворотне поширення потенціалу дії значно слабшає по мірі віддалення від соми, нещодавні дослідження базальних дендритів пірамідальних нейронів 5 шару продемонстрували, що високочастотні пачки (bursts) потенціалів дії можуть поширюватись у віддалені базальні дендрити, викликаючи регенеративну активацію потенціалзалежних Ca2+ каналів, що веде до генерації дендритних Ca2+ спайків[73]
Зворотне поширення потенціалу дії може також взаємодіяти із синаптичними потенціалами. Провідність, необхідна для генерації потенціалу дії є великою, і тому породжує суттєве зниження в мембранному опорі, що найбільше локалізується в аксоні та сомі. Таке шунтування значно зменшує мембранну часову сталу в цих регіонах нейрону, здійснюючи дренаж заряду із мембранної електричної ємності. В цей спосіб потенціали дії здатні зменшити амплітуду збуджувальних та інгібуючих постсинаптичних потенціалів, тим самим забезпечуючи механізм для припинення інтеграції, яка має місце в дендритах. В неокортикальних пірамідальних нейронах 5 шару соматичні ЗПСПли, генеровані базальними вхідними імпульсами, можуть бути ослаблені до 80 % єдиним потенціалом дії. З іншого боку, більш віддалені вхідні імпульси апікальних дендритів менш шунтуються, оскільки вони знаходяться значно далі від зміни провідності, що виникла протягом потенціалу дії.[74]
Зворотній зв'язок, який здійснюється через таке зворотне поширення потенціалу дії, є досить складним та має безліч важливих наслідків для функціювання дендритів, як і для синаптичної пластичності. До прикладу, єдиний bAP здатен активувати слабкі дендритні потенціал-залежні струми, що, в свою чергу, протікають назад, в бік початкового сегменту генерації потенціалу дії в аксоні, часто призводячи до генерації додаткового потенціалу дії. В такий спосіб, внаслідок взаємодії з дендритами, соматичний ПД здатен призводити до генерації навіть пачок потенціалів(Див. наступний підрозділ).[41][75]
Також bAP може слугувати, як асоціативний зв'язок між пресинаптичним збудженням та постсинаптичною активністю нейрона, призводячи до посилення/послаблення окремих синаптичних контактів між нейронами. До прикладу, залежні від активації NMDA-рецептору зміни в синаптичній силі, прямо залежать від зворотного соматичного потенціалу: bAP послаблює потенціал-залежне Mg2+ блокування NMDA-рецептора, що призводить до збільшення входження Ca2+ через активовані рецептором канали та, як наслідок, до зміни в синаптичній силі на дендритах. Симптоматичним в цьому відношенні є те, що мозочкові клітини Пуркіньє, в яких відсутнє зворотне поширення ПД, також не мають функціональних NMDA-рецепторів[76]
Іншим наслідком проникнення bAP в дендритне дерево є збільшення внутрішньоклітинної концентрації дендритного кальцію [Ca2+] в результаті активації потенціал-залежних Ca2+ каналів.[77] Це збільшення в [Ca2+] лінійно корелює із середньою частотою розряду соматичного ПД в неокортиканльних пірамідальних клітинах. Також було виявлено, що bAP ефективно поширюються до дендритних шипиків, призводячи в них до збільшення внутрішньоклітинного [Ca2+].[78] Окрім ролі Ca2+ в синаптичній пластичності (див. докладніше Дендритна пластичність), ріст внутрішньоклітинної концентрації кальцію впливає також на синаптичну інтеграцію через придушення опосередкованих NMDA-рецептором відповідей або через активацію дендритних K+ провідностей, які можуть шунтувати частину дендритного дерева.[79]
І навпаки, bAP можуть тимчасово припинити синаптичну інтеграцію через повернення дендритного мембранного потенціалу до вихідного положення або через фіксацію збуджувальних синаптичних провідностей близько до їх потенціалу реверсії. В нейронах без bAP або де bAP не спроможні успішно поширюватись до віддалених дендритів, локальні дендритні спайки, які виникають в цих дендритних регіонах можуть генерувати та підтримувати синаптичну інтеграцію, яка потім навіть буде зворотно впливати на соматичний потенціал дії.[33]
В цілому, існування потенціалів дії зворотного поширення суттєво доповнює та навіть змінює класичні уявлення про нейрон. Хоча роль аксону, як місця остаточної інтеграції вхідних сигналів зберігається, він відтепер має не тільки односторонній вплив на інші нейрони, але й на свій власний нейрон, коригуючи його активність. Разом з тим, завдяки bAP, аксон може впливати на інтегративні процеси в дендритах і в свою чергу сам ними визначатись та суттєво змінюючи відповідно до них кінцевий нейронний сигнал. Як наслідок, у ЦНС виникає унікальна взаємодія між збуджувальними та інгібуючими нейронами. Позаяк більшість інгібіторних синапсів формують контакти ближче до соми, а деякі навіть на самому початковому сегменті аксона, то це дозволяє їм найбільш ефективно і точно придушити всю інтегративну активність нейрона, унеможлвилюючи сигналізування інтегрованої ним інформації. Нещодавнє відкриття того, що нейронний транскрипційний фактор регуляції активності NPAS4 (Neuronal Per Arnt Sim domain protein 4) здатен збільшувати кількість інгібіторних синапсів в сомі та зменшувати їх кількість в дендритах під час поведінкової активності, підтверджує, що придушення соматичного bAP хоча і не дозволяє дендритам ефективно вплинути на інші нейрони, воно втім уможливлює формування дендритної пластичності.[80] Оскільки вибіркове інгібування соматичного зворотного потенціалу і послаблення інгібування дендритного сегменту призведе до синаптичного посилення цих дендритів. Крім того, інгібування соми гарантує надійну та цілісну інтеграцію в дендритах вхідної синаптичної інформації, яка не буде придушена bAP і успішно потенціює даний дендритний сегмент чи гілку. Тож, для наступної генерації цілісного нейронного потенціалу дії в аксоні достатньо буде кількох точно спрямованих синаптичних імпульсів.[81]
Отож, зворотне поширення соматичного потенціалу дії має безліч фундаментальних наслідків як для дендритів, так і для нейрона в цілому, позаяк одиничні нейрони, маючи такі складні внутрішні механізми зворотного зв'язку, більше не можуть розглядатись, як розімкнений контур[en] (англ. open-loop).[71][82]. Відтак, поняття «зворотній зв'язок» із нейронних мереж можна перенести на сам нейрон, наділяючи ним кожен елемент мережі.[83][84]
| Зворотньопоширюючийся потенціал дії[41] |
|---|
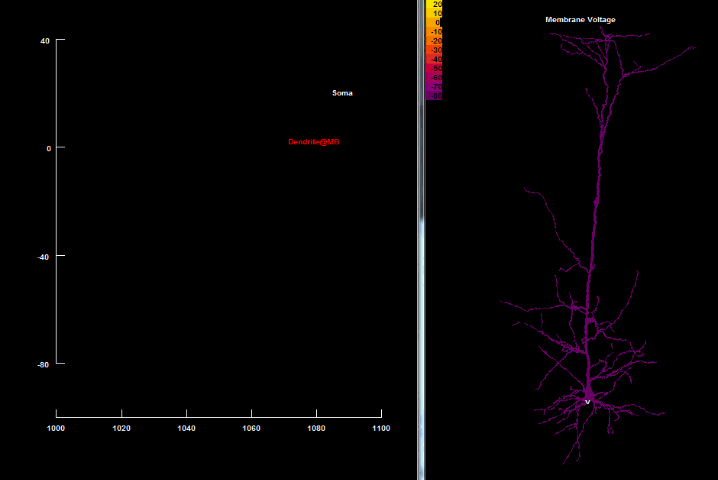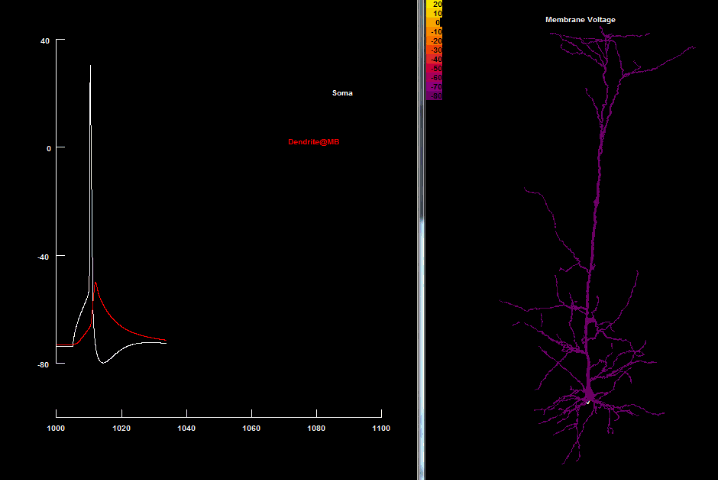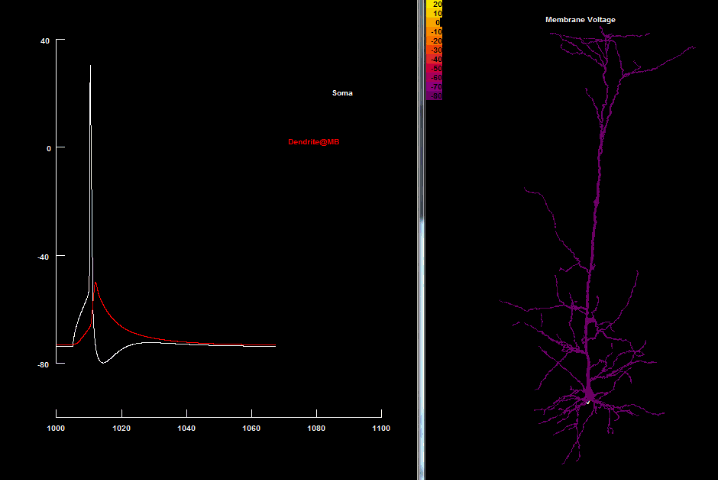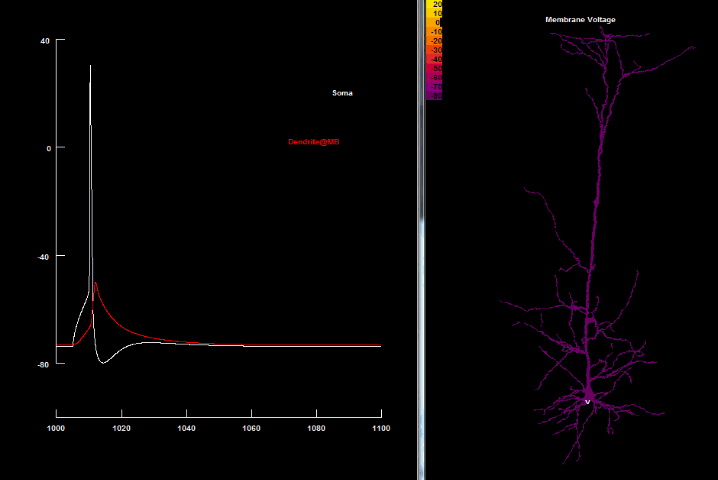
|
BAC firing[ред. | ред. код]

Попри відкриття Ca2+ спайків, залишається проблема, як віддалені синаптичні імпульси можуть подолати поріг для генерації таких спайків, оскільки навіть імпульс, поданий безпосередньо на дендритний пучок, має незначний вплив на апікальний Ca2+ початковий сегмент.[85] Важливий крок у вирішенні цієї проблеми був зроблений з відкриттям того, що Na+ та Ca2+ початкові сегменти у пірамідальних клітинах 5 шару кори здатні впливати один на одного через апікальний дендрит, який усіяний Na+ потенціалзалежними каналами, що спроможні підтримувати поширення сигналу[32] Це означало, що навіть якщо малі (підпорогові) сигнали роблять невеликий внесок тільки до свого початкового сегменту, досягаючи локального порогу, то це швидко сигналізується в інший початковий сегмент. Цілком природно, що виникає можливість для появи асоціативних взаємозв'язків навіть в межах єдиного (пірамідального) нейрону, завдяки чому активність одного регіону клітини може понизити поріг для ініціювання активності в іншому регіоні.[51]
Одночасний збіг віддалених вхідних синаптичних імпульсів в дендритах із аксонним потенціалом дії зворотного поширення в межах відповідного часового інтервалу (20-30 мс) скорочує поріг для генерації дендритного Ca2+ спайку і, як наслідок, може призвести до породження пачки множинних потенціалів дії в сомі.[24][33] Для такого збігу потенціалів соми і дендрита створили окремий термін — «активований зворотнім поширенням потенціалу дії Ca2+ спайковий розряд» (Backpropagation-activated Ca2+ spike firing, BAC firing).[24]
В основі генерації пачок потенціалів дії є той факт, що дендритний Ca2+-спайк може спричинити достатньо деполяризації в аксонній початковій зоні для проходження порогу збудження, в результаті чого виникають складні дендритні потенціали. У свою чергу, потенціали дії зворотного поширення суттєво зменшують поріг для генерації цього дендритного Ca2+-спайку. Як наслідок цих подій, генерується пачка аксонних потенціалів дії, які розповсюджуються назад до дендритної гілки.[24]
Отож, після поєднання bAP та підпорогового ЗПСП, кінцева форма нейронного імпульсу складатиметься із 1) першого аксонного потенціалу та 2) другого і третього ПД, пов'язаних із дендритними спайками. Такий складний механізм і характеризує «BAC firing», необхідність часової синхронності якого відповідає такій самій часовій точності STDP пластичності на віддалених синапсах.
Іншою характерною рисою «BAC firing» є те, що він може бути блокований точно синхронізованою активацією спрямованого в нейрон інгібіторного вхідного імпульсу, який триває ~400 мс. Це означає, що інгібування може використовуватись в корі для контролю з'єднань між зонами генерації близьких та віддалених спайків, як і для того, щоб придушувати пачкові розряди, пов'язані з «BAC firing»[69]
На відміну від типової нейронної мережі, унікальна будова пірамідального нейрону кори 5 шару дозволяє його індивідуальним одиницям обробляти два потоки інформації окремо і тоді об'єднати їх, використовуючи самі лише внутрішні властивості клітини, у такий спосіб зменшуючи навантаження на складність мережі нейронів. Тож, як наслідок особливої форми та спрямованості пірамідальних нейронів 5 шару кори, у поєднанні з унікальною організацією кори, механізм «BAC firing» ідеально підходить для асоціювання в межах кількох мілісекунд кіркових шляхів прямого (feed-forward) та зворотного (feedback) зв'язку в межах одного нейрона, тобто поєднання висхідної («bottom-up») сенсорної інформації із низхідними («top-down») асоціативними сигналами.[32]

З огляду на подібну складність пірамідальних нейронів та унікальність їх дендритів, Метью Ларкум (Matthew Larkum), який відкрив «BAC firing» та ряд інших ключових властивостей дендритів, висунув гіпотезу, що для існування в корі головного мозку асоціювання зовнішніх даних про світ із внутрішніми його репрезентаціями не обов'язково є потрібними громіздкі нейронні мережі та їх складні механізми самоорганізації, воно може бути реалізоване на клітинному рівні і через внутрішньоклітинні механізми[32][34]. Це дозволяє корі виконувати ті ж самі операції, але з незрівнянно більш потужними паралельними обчисленнями, аніж виконують штучні нейронні мережі та їх аналоги.
В корі, соматичні та проксимальні вхідні сигнали до пірамідальних нейронів 5 шару надходять із висхідних, специфічних сенсорних регіонів, тоді як віддалені апікальні дендрити цих клітин отримують низхідну інформацію або від інших сенсорних центрів, або ж від вищих шарів кори, зокрема центрів уваги. З іншого боку, механізм «BAC-firing» пов'язаний із окремим, новим типом нейронного коду — т. зв. «burst-timing code», який різниться від класичних нейронних кодів («rate code» та «spike-timing code»).[86] Оскільки вхідні сигнали до соми і дендритів пірамідального нейрону L5 походять з різних регіонів кори, то «burst-timing код» дозволяє виявити збіг цих висхідних та нисхідних сигналів і сигналізувати його нижчестоячим постсинаптичним нейронам.
Спираючись на ці факти, модель Ларкума постулює, що інформація, яка отримується із зовнішнього світу, через прямий зв'язок (feed-forward) надходить до пірамідальних нейронів кори для встановлення базової частоти спайкових розрядів (firing), що надалі починають взаємодіяти через зворотній зв'язок (feedback) з інформацією внутрішнього, нейронного походження, яка надходить в дендрити цих нейронів і кардинально змінює спайкові розряди нейрона. Зворотній зв'язок за цією схемою слугує як «передбачення» корою, чи може і чи повинен даний пірамідальний нейрон (або мікроколонки пірамідальних нейронів) генерувати спайкові розряди.[87]
Відтак, асоціативна функція кори (зв'язування зовнішніх даних з внутрішньою картиною світу) теоретично може бути досягнута без необхідності складних схем, використовуючи єдиний, двомірний шар розташованих вертикально в одну лінію пірамідальних нейронів. У такий спосіб також може бути вирішена класична нейронна проблема гомункула — відокремленого механізму чи структури, що спостерігає за нейронною інформацією, асоціює та осмислює її. Відповідно до моделі Ларкума, нейрони, які найкраще відповідають передбачувальним зворотнім зв'язкам, мають більший вплив на інші частини мозку через збільшення їх спайкових розрядів чи пачок. В свою чергу, їх активність через прямий зв'язок впливатиме на подальше вдосконалення передбачувальної сили зворотніх зв'язків і т. д. З іншого боку, часова залежність, притаманна «BAC firing», може бути одним із ключових механізмів для збільшення синхронізації вхідних імпульсів і слугувати для збільшення нейронами синхронності їх вихідних сигналів.[34]
| Кальцієвий спайк, який активується потенціалом дії зворотного поширення (BAC firing)[41] |
|---|
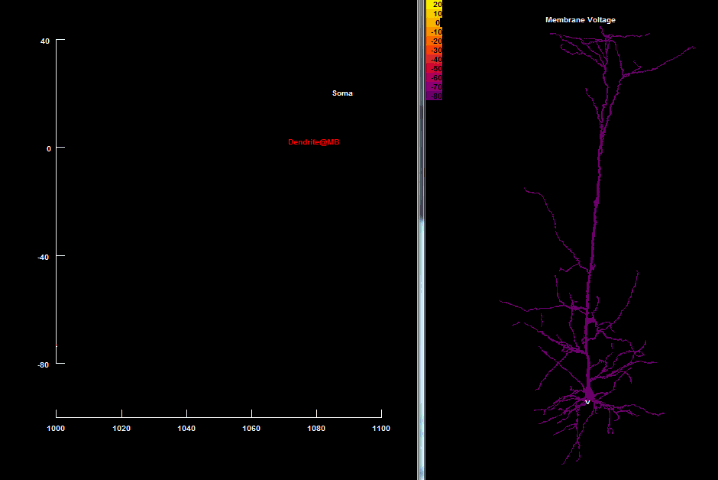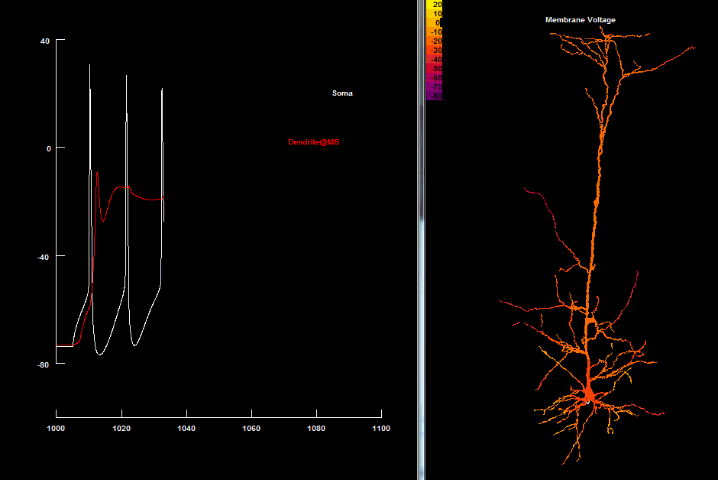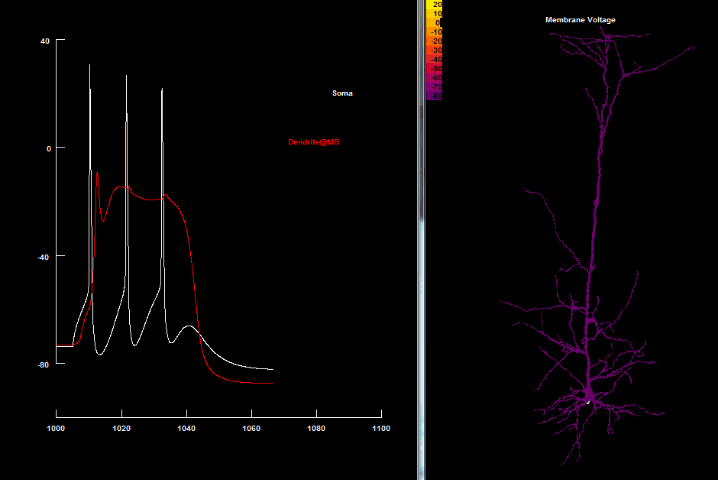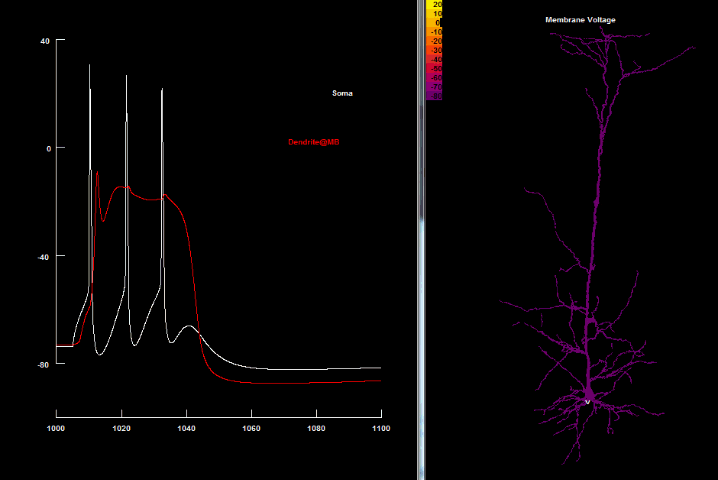
|
Відкриття того, що дендрити можуть генерувати спайки породило важливу проблему — як дендрити інтегрують синаптичні імпульси: якщо спайки можуть бути генеровані в дендритах, інтегративна сила дендритного дерева буде мінімальною, оскільки багато просторових і темпоральних взаємодій, включаючи збудження та інгібування, будуть нівельовані генерацією дендритного спайку у відповідь на декілька ЗПСП'ів. Одне з рішень було запропоноване ще в 1959 році видатним американським нейрофізіологом Рафаелем Лоренте де Но[en], який висунув припущення[88], — яке сьогодні підтримується багатьма експериментальними даними[24][89], — що зменшення провідності дендритних спайків може відігравати важливу роль в дендритній інтеграції у ЦНС. Згідно з цією ідеєю, спайки можуть бути генеровані в дендритах, але вони не будуть благополучно поширюватись до соми. Їх головний вплив полягатиме у збільшенні деполяризації, пов'язаної з даним синаптичним імпульсом, але не обов'язково в генерації аксонного потенціалу дії.[90] Одна із головних функцій такого спайка буде полягати у підсиленні синаптичних потенціалів, завдяки чому буде збільшуватись імовірність, що комбінація синапсів, які викликали даний дендритний спайк, врешті решт приведе до появи кінцевого вихідного імпульсу від нейрона через генерацію потенціалу дії в аксоні. В такому випадку додаткова соматична деполяризація, пов'язана із дендритним спайком, приведе мембранний потенціал вище порогу для генерації соматично-аксонного потенціалу дії[91].
Вплив дендритної морфології на розповсюдження потенціалу дії[ред. | ред. код]

Хоча відкриття потенціал-залежних іонних каналів дозволило пролити нове світло на роль активних дендритів в нейронній обробці інформації, воно не могло пояснити всієї палітри різноманіття дендритних потенціалів дії, які навіть можуть різнитись серед нейронів того ж самого типу. Тим більше, що при однаковій щільності каналів в дендритах, поширення і вплив спайків в нейронах суттєво різниться.
Із прогресом обчислювальних технологій стало можливим моделювання анатомічно-подібних нейронів. Ці перші обчислювальні моделі вперше показали, що не тільки розподіл та щільність дендритних іонних каналів впливають на форму та тривалість розповсюдження спайків. Не менш значущим є вплив геометрії дендритних дерев. Подібно до того, наскільки важливою є морфологія дендритів для формування зовнішніх синаптичних контактів та отримання/передачі нейронних сигналів, настільки ж вона є важливою для внутрішніх процесів в самих нейронах.
Як було передбачено кабельною теорію і згодом підтверджено на основі компартментного моделювання, навіть морфологія дендритних дерев з пасивними характеристиками, — без потенціал-залежних іонних каналів та активних струмів, — має сильний вплив на електричні властивості нейронів, на проходження синаптичного потенціалу та його інтеграцію в нейроні. Самі по собі дендрити діють, як активні (резистивні) та реактивні (ємнісні) навантаження на початковий сегмент аксону, ускладнюючи генерацію потенціалу дії.[92]
Структура дендритного дерева є функціонально асиметричною, оскільки загасання напруги від соми до дендритних закінчень і в зворотному напрямку не є однаковим.[93] Загасання напруги від соми через товщі головні дендрити до віддалених дендритних закінчень, зазвичай, є значно слабшим, аніж загасання напруги від тонких віддалених дендритів до соми.[94] Ця асиметрія впливає не тільки на перехідне та стаціонарне загасання підпорогових сигналів напруги, але й зумовлює асиметрію в активному поширенні дендритного спайку та зворотного соматичного ПД.[95]
Найбільш переконливо вплив дендритної геометрії на електричну активність нейронів з активними дендритами був показаний в класичній статті Захарія Мейнена та Терренса Сейновскі.[64] Вони симулювали динаміку спайків кількох анатомічно реконструйованих нейронів кори з різною дендритною геометрією та однаковим розподілом і щільністю іонних каналів. Найбільш неочікуваним було відкриття того, що змінюючи тільки морфологію дендритних дерев і залишаючи незмінними розподіл/щільність іонних каналів, можна отримати весь спектр спайкових розрядів, виявлених експериментально в корі.[64] Отримані результати переконливо показали, що кореляція між дендритною морфологією і формами спайкових розрядів не чутлива до варіації в кінетиці та щільності каналів допоки зберігається ізоляція швидких каналів від повільних.
Наступні дослідження також показали, що дендритна геометрія є вирішальним чинником для ефективного поширення соматичного зворотного потенціалу дії (bAP) в дендрити. Зокрема, було виявлено, що ефективність проходження bAP в пірамідальних нейронах 5 шару пов'язане із кількістю апікальних нахилених гілок та діаметром апікального пучка.[96] В СА1 пірамідальних нейронах гіпокампу bAP є особливо ефективним у віддалених дендритних регіонах із просторими гілками[65][97] З іншого боку, bAP розповсюджуються менш ефективно в дендритах таламокортикальних релейних нейронів, що характеризуються значним розгалуженням гілок.[94]
Одні дендритні геометрії характеризуються більш стійким та тривалим поширенням ПД, тоді як інші проявляють значний опір до такого поширення, призводячи до загасання потенціалу. До прикладу, клітини Пуркіньє навіть при відносно високій щільності Na+ мають одну з найбільш яскраво виражених убуваючих провідностей, зменшуючи амплітуду ПД на кілька мілівольт в 100 мкм від соми[1][98] Подібне слабке поширення зворотного потенціалу дії в цих клітинах, як було передбачено кабельною теорією[99], пов'язане з їх складною розгалуженою геометрією, а також із відносно низькою щільністю іонних каналів та вузькою шириною потенціалів дії.[61]

З іншого боку, існують дендритні геометрії (як в дофамінних та мітральних клітинах), які значно сприяють поширенню ПД, потребуючи тільки незначної щільності Na+ каналів для ефективного проходження у віддалені дендрити[18]

Такий самий визначальний вплив дендритної морфології був показаний для поширення спайків, які генеруються в дендритах, до соми. Як в пасивних дендритах, так і в активних, дендритний спайк залежить від місця його виникнення в дендритному дереві[100][101][98] Дендритні спайки можуть розповсюджуватись на сотні мікрометрів до соми із більшості регіонів дендритного дерева в дофамінних та неокортикальних пірамідальних нейронах. Тоді як, подібно до bAP, майже для всіх регіонів на дендритах клітин Пуркіньє дендритний спайк поширюється менш ніж 50 мкм, обмежуючись гілками, близькими до місця його виникнення.[98] Тож, як і bAP, поширення дендритних спайків суттєво залежить від типу нейронів, будучи відмінним в різних регіонах ЦНС. І так само, як для bAP, дендритна геометрія визначає силу впливу іонних каналів на поширення дендритних спайків, із необхідністю існування більш високої щільності Na+ в дендритах клітин Пуркіньє для тривалого поширення дендритного спайку до соми.[95]
Існування кореляції морфологічних властивостей та ефективності поширення ПД також свідчить про те, що кількість дендритних точок розгалуження є критичним фактором для ефективності такого поширення. Дендритні дерева із великою кількістю точок розгалуження значно послаблюють bAP.[95] Ще більш точним чинником у передбаченні того, наскільки ефективно розповсюдиться ПД в дендритному дереві є площа дендритної мембрани, яка визначається кількістю точок розгалуження та відношенням між діаметром батьківських та дочірніх дендритних точок розгалужень. Значне збільшення площі дендритної мембрани призводить до великого ємнісного навантаження, що сильно послаблює амплітуду швидких перехідних напруг, не дозволяючи ПД перейти поріг для активного розповсюдження.[94]
Дендритна геометрія не є статичною, а суттєво змінюється протягом диференціації та формування організму: дозрівання нейронів, синаптична пластичність, пам'ять та здобуття досвіду пов'язані із збільшенням дендритного розгалуження.[102][103] Постійна зміна в морфології дендритів повинна була б сильно впливати на генерацію і проходження сомато-дендритного потенціалу дії, тож повинні існувати механізми, котрі б підтримували нейронну активність на постійному рівні. Довголітні моделювання та експерименти показали, що збільшення складності дендритних дерев призводить до послаблення або навіть припинення зворотного поширення ПД, якщо не компенсується паралельним збільшенням щільностей потенціал-залежних каналів в дендритах[94][104][105]
Відтак, обчислювальне моделювання та експериментальні дослідження підтверджують, що дендритна морфологія є однією з головних причин відмінності в поширенні ПД серед різних нейронних анатомій. І хоча існує очевидна різниця між щільністю та властивостями каналів серед різних типів нейронів, саме дендритна геометрія визначає, наскільки вирішальною є ця різниця для функціонування нейрону і для генерації ним потенціалу дії.[95] Тому дендритна морфологія має суттєвий вплив не тільки на проходження дендритного спайку та bAP, але й на загальну нейронну обробку інформації, визначаючи: а) тип і силу зв'язку між чисельними вхідними сигналами на вході та вихідним сигналом на виході нейрону та б) інтеграцію сигналів в сомато-дендритних сегментах та ступніь їх впливу на синаптичну пластичність. Це також означає, що слід брати до уваги дендритну морфологію при моделюванні штучних нейронних мереж і задля ефективної симуляції активності мозку.
Примітки[ред. | ред. код]
- 1) ↑ Все-або-нічого — потенціал, який будучи генерований (після досягнення порогу збудження) розповсюджується сам по собі до завершення.
- 2) ↑ Цікаво, що «зворотне поширення» (англ. backpropagation) було запропоноване в теорії штучних нейронних мереж, ще до його відкриття в нейронах, як один з методів нейронного навчання. Див. метод зворотного поширення помилки. Подібно до навчання перцептрона, біологічне зворотне поширення також сприяє навчанню, посилюючи чи послаблюючи синаптичну пластичність. Однак, на відміну від перцептрона, зворотне поширення потенціалу дії відбувається в межах одного нейрона і завдяки існуванню дендритних локальних спайків може бути цілком незалежним від пост- і пресинаптичних нейронів, наділяючи один нейрон властивостями цілої нейронної мережі.
Джерела[ред. | ред. код]
- ↑ а б Llinás R. and Sugimori M. (1 серпня 1980). Electrophysiological properties of in vitro Purkinje cell dendrites in mammalian cerebellar slices. The Journal of Physiology. 305: 197—213. PMID 7441553. Архів оригіналу за 4 жовтня 2013. Процитовано 18 жовтня 2013.
- ↑ а б в г Stuart G, Schiller J, and Sakmann B. (15 грудня 1997). Action potential initiation and propagation in rat neocortical pyramidal neurons. The Journal of Physiology. 505 (3): 617—632. PMID 9457640. Архів оригіналу за 4 жовтня 2013. Процитовано 18 жовтня 2013.
- ↑ а б Larkum M. E. and Zhu J.J. (15 серпня 2002). Signaling of Layer 1 and Whisker-Evoked Ca2+ and Na+ Action Potentials in Distal and Terminal Dendrites of Rat Neocortical Pyramidal Neurons In Vitro and In Vivo. The Journal of Neuroscience. 22 (16): 6991—7005. Архів оригіналу за 5 лютого 2015. Процитовано 18 жовтня 2013.
- ↑ Mel Bartlett W. (1994). Information Processing in Dendritic Trees. Neural Computation. 6 (6): 1031—1085. doi:10.1162/neco.1994.6.6.1031. ISSN 0899-7667.
- ↑ Larkum Matthew E and Nevian Thomas (2008). Synaptic clustering by dendritic signalling mechanisms. Current Opinion in Neurobiology. 18 (3): 321—331. doi:10.1016/j.conb.2008.08.013. ISSN 0959-4388.
- ↑ Chang Hsiang-Tung (1 січня 1951). Dendritic potential of cortical neurons produced by direct electrical stimulation of the cerebral cortex. Journal of neurophysiology: 1 1-21. Архів оригіналу за 23 грудня 2015. Процитовано 8 листопада 2013.
- ↑ Cragg B. G. and Hamlyn L. H. (1955 September 28). Action potentials of the pyramidal neurones in the hippocampus of the rabbit. The Journal of Physiology. 129: 608—627.
- ↑ Fujita Yasuichiro and Sakata Hideo (1962). Electrophysiological properties of CA1 and CA2 apical dendrites of rabbit hippocampus. Journal of Neurophysiology. 25: 209—222.
- ↑ Herreras O. (1 листопада 1990). Propagating dendritic action potential mediates synaptic transmission in CA1 pyramidal cells in situ. Journal of neurophysiology. 64: 1429—1441.
- ↑ Wall P. D. (1 вересня 1965). Impulses originating in the region of dendrites. The Journal of Physiology,. 180: 116—133.[недоступне посилання з серпня 2019]
- ↑ а б Eccles JC, Libet B, Young RR (1958). The behaviour of chromatolyzed motoneurons studied by intracellular recording. Journal of Physiology . 143: 11—40.
- ↑ а б Spencer and E.Kandel (1 травня 1961). Electrophysiology of hippocampal neurons: IV. FAST PREPOTENTIALS. Journal of neurophysiology. 24: 272—285. Архів оригіналу за 16 лютого 2015. Процитовано 18 жовтня 2013.
- ↑ Llinas R. and Nicholson C.; Precht, W. (1969). Preferred Centripetal Conduction of Dendritic Spikes in Alligator Purkinje Cells. Science. 163 (3863): 184—187. doi:10.1126/science.163.3863.184. ISSN 0036-8075.
{{cite journal}}: Пропущено|author2=(довідка) - ↑ Pivovarov A. S. (1977). Action potential generation by turtle cortical neurons. Dendritic and somatic spikes. Neurophysiology. 8 (3): 181—186. doi:10.1007/BF01064613. ISSN 0090-2977.
- ↑ Voronkov G. S., Gusel'nikova K. G. and Torgovanova G. V. (1977). Generation of spike activity by dendrites of secondary neurons of the rat olfactory bulb. Neurophysiology. 8 (3): 218—224. doi:10.1007/BF01064619. ISSN 0090-2977.
- ↑ Labakhua T. Sh., Kokaya M. G. and Okudzhava V. M. (1986). Dendritic action potentials of pyramidal tract neurons in the cat sensorimotor cortex. Neurophysiology. 18 (4): 307—314. doi:10.1007/BF01052798. ISSN 0090-2977.
- ↑ Stuart Greg J.and Sakmann Bert (1994a). Active propagation of somatic action potentials into neocortical pyramidal cell dendrites. Nature. 367 (6458): 69—72. doi:10.1038/367069a0. ISSN 0028-0836.
- ↑ а б Hausser Michael, Stuart Greg, Racca Claudia and Sakmann Bert (1995). Axonal initiation and active dendritic propagation of action potentials in substantia nigra neurons. Neuron. 15 (3): 637—647. doi:10.1016/0896-6273(95)90152-3. ISSN 0896-6273.
- ↑ Wong R.K.S., D.A.Prince and Basbaum A.I (February 1979). Intradendritic recordings from hippocampal neurons (PDF). PNAS. 76: 986—990. Архів оригіналу (PDF) за 24 вересня 2015. Процитовано 18 жовтня 2013.
- ↑ Kamondi Anita, Acsády László, Wang Xiao-Jing, Buzsáki György (1998). Theta oscillations in somata and dendrites of hippocampal pyramidal cells in vivo: Activity-dependent phase-precession of action potentials. Hippocampus. 8 (3): 244—261. doi:10.1002/(SICI)1098-1063(1998)8:3<244::AID-HIPO7>3.0.CO;2-J. ISSN 1050-9631.
- ↑ Golding NL , Jung H , Mickus T and Spruston N (15 жовтня 1999). Dendritic Calcium Spike Initiation and Repolarization Are Controlled by Distinct Potassium Channel Subtypes in CA1 Pyramidal Neurons. The Journal of Neuroscience: 8789—8798. Архів оригіналу за 19 грудня 2015. Процитовано 18 жовтня 2013.
- ↑ Oesch Nicholas, Euler Thomas, Taylor W. Rowland (2005). Direction-Selective Dendritic Action Potentials in Rabbit Retina. Neuron. 47 (5): 739—750. doi:10.1016/j.neuron.2005.06.036. ISSN 0896-6273.
- ↑ Xiong Wenhui, Chen Wei R. (2002). Dynamic Gating of Spike Propagation in the Mitral Cell Lateral Dendrites. Neuron. 34 (1): 115—126. doi:10.1016/S0896-6273(02)00628-1. ISSN 0896-6273.
- ↑ а б в г д Larkum Matthew E., Zhu J. Julius, and Sakmann Bert (1999). A new cellular mechanism for coupling inputs arriving at different cortical layers. Nature. 398 (6725): 338—341. doi:10.1038/18686. ISSN 0028-0836.
- ↑ Stuart G and Spruston N. (1998 May 15). Determinants of voltage attenuation in neocortical pyramidal neuron dendrites. The Journal of Neuroscience. 18: 3501—10. PMID 9570781. Архів оригіналу за 10 листопада 2016. Процитовано 4 листопада 2013.
- ↑ а б Hoffman DA , Magee JC , Colbert CM , Johnston D (26 червня 1997). K+ channel regulation of signal propagation in dendrites of hippocampal pyramidal neurons. Nature . 387: 869—875. Архів оригіналу за 15 жовтня 2013. Процитовано 4 листопада 2013.
- ↑ Magee Jeffrey, Hoffman Dax, Colbert Costa, and Johnston Daniel (1998). Electrical and calcium signaling in dendrites of hippocampal pyramidal neurons. Annual Review of Physiology. 60 (1): 327—346. doi:10.1146/annurev.physiol.60.1.327. ISSN 0066-4278.
- ↑ а б Schiller Jackie, Schiller Yitzhak, Stuart Greg, and Sakmann Bert (1997). Calcium action potentials restricted to distal apical dendrites of rat neocortical pyramidal neurons. The Journal of Physiology. 505 (3): 605—616. doi:10.1111/j.1469-7793.1997.605ba.x. ISSN 0022-3751.
- ↑ Williams SR. (22 серпня 2004). Spatial compartmentalization and functional impact of conductance in pyramidal neurons. Nature Neuroscience. 7: 961—967. doi:10.1038/nn1305.
- ↑ Schwindt Peter and Crill Wayne (1 березня 1999). Mechanisms Underlying Burst and Regular Spiking Evoked by Dendritic Depolarization in Layer 5 Cortical Pyramidal Neurons. Journal of neurophysiology. 81 (3): 1341—1354. PMID 10085360. Архів оригіналу за 8 листопада 2013. Процитовано 18 жовтня 2013.
- ↑ Williams Stephen R. and Stuart Greg J. (1999). Mechanisms and consequences of action potential burst firing in rat neocortical pyramidal neurons. The Journal of Physiology. 521 (2): 467—482. doi:10.1111/j.1469-7793.1999.00467.x. ISSN 0022-3751.
- ↑ а б в г Larkum M. E., Senn W. and Lüscher H.-R. (2004). Top-down Dendritic Input Increases the Gain of Layer 5 Pyramidal Neurons. Cerebral Cortex. 14 (10): 1059—1070. doi:10.1093/cercor/bhh065. ISSN 1460-2199.
- ↑ а б в Larkum M.E., Zhu J.J., and Sakmann B. (2001). Dendritic mechanisms underlying the coupling of the dendritic with the axonal action potential initiation zone of adult rat layer 5 pyramidal neurons. The Journal of Physiology. 533 (2): 447—466. doi:10.1111/j.1469-7793.2001.0447a.x. ISSN 0022-3751.
- ↑ а б в Larkum Matthew (2013). A cellular mechanism for cortical associations: an organizing principle for the cerebral cortex. Trends in Neurosciences. 36 (3): 141—151. doi:10.1016/j.tins.2012.11.006. ISSN 0166-2236.
- ↑ а б в г Nevian T, Larkum ME, Polsky A, and Schiller J. (7 січня 2007). Properties of basal dendrites of layer 5 pyramidal neurons: a direct patch-clamp recording study. Nature Neuroscience (2): 206—214. doi:10.1038/nn1826. PMID 17206140. Архів оригіналу за 6 квітня 2010. Процитовано 18 жовтня 2013.
- ↑ а б в Gasparini S., Migliore M. and Magee J. (2004). On the Initiation and Propagation of Dendritic Spikes in CA1 Pyramidal Neurons. Journal of Neuroscience. 24 (49): 11046—11056. doi:10.1523/JNEUROSCI.2520-04.2004. ISSN 0270-6474.
- ↑ а б Losonczy Attila and Magee Jeffrey C. (2006). Integrative Properties of Radial Oblique Dendrites in Hippocampal CA1 Pyramidal Neurons. Neuron. 50 (2): 291—307. doi:10.1016/j.neuron.2006.03.016. ISSN 0896-6273.
- ↑ Stuart et al, 1997, с. 617 - 632.
- ↑ Golding Nace L and Spruston Nelson (1998). Dendritic Sodium Spikes Are Variable Triggers of Axonal Action Potentials in Hippocampal CA1 Pyramidal Neurons. Neuron. 21 (5): 1189—1200. doi:10.1016/S0896-6273(00)80635-2. ISSN 0896-6273.
- ↑ Spruston N, Stuart G and Hausser M (1999). Dendritic integration. У Stuart G, Spruston N, Hausser M. (ред.). Dendrites. Oxford University Press. с. 351—401. ISBN ISBN 0198566565..
{{cite book}}: Cite має пустий невідомий параметр:|1=(довідка); Перевірте значення|isbn=: недійсний символ (довідка) - ↑ а б в г Schaefer A. T., Larkum ME , Sakmann B , and Roth A (2003). Coincidence Detection in Pyramidal Neurons Is Tuned by Their Dendritic Branching Pattern. Journal of Neurophysiology. 89 (6): 3143—3154. doi:10.1152/jn.00046.2003. ISSN 0022-3077.
- ↑ Gerstner Wulfram and Kistler Werner M. (2002). Spiking Neuron Models: Single Neurons, Populations, Plasticity. Cambridge University Press. с. 480. ISBN 9780521890793.
- ↑ Feldman Daniel E. (2012). The Spike-Timing Dependence of Plasticity. Neuron. 75 (4): 556—571. doi:10.1016/j.neuron.2012.08.001. ISSN 0896-6273.
- ↑ Gulledge Allan T., Kampa Björn M. and Stuart Greg J. (2005). Synaptic integration in dendritic trees. Journal of Neurobiology. 64 (1): 75—90. doi:10.1002/neu.20144. ISSN 0022-3034.
- ↑ а б Hunt David L and Castillo Pablo E (2012). Synaptic plasticity of NMDA receptors: mechanisms and functional implications. Current Opinion in Neurobiology. 22 (3): 496—508. doi:10.1016/j.conb.2012.01.007. ISSN 0959-4388.
- ↑ Kampa B. M., Clements J.,Jonas P. and Stuart G. J. (2004). Kinetics of Mg2+ unblock of NMDA receptors: implications for spike-timing dependent synaptic plasticity. The Journal of Physiology. 556 (2): 337—345. doi:10.1113/jphysiol.2003.058842. ISSN 0022-3751.
- ↑ Cai Xiang and Liang Conrad W.; Muralidharan, Sukuman; Kao, Joseph P.Y.; Tang, Cha-Min; Thompson, Scott M. (2004). Unique Roles of SK and Kv4.2 Potassium Channels in Dendritic Integration. Neuron. 44 (2): 351—364. doi:10.1016/j.neuron.2004.09.026. ISSN 0896-6273.
{{cite journal}}: Пропущено|author2=(довідка) - ↑ Branco Tiago and Häusser Michael (2010). The single dendritic branch as a fundamental functional unit in the nervous system. Current Opinion in Neurobiology. 20 (4): 494—502. doi:10.1016/j.conb.2010.07.009. ISSN 0959-4388.
- ↑ а б Lavzin Maria, Rapoport Sophia, Polsky Alon, Garion Liora, and Schiller Jackie (2012). Nonlinear dendritic processing determines angular tuning of barrel cortex neurons in vivo. Nature. 490 (7420): 397—401. doi:10.1038/nature11451. ISSN 0028-0836.
- ↑ Wei D.-S., Mei Y-A, Bagal A., Kao J.P.Y., Thompson S.M., and Tang C.-M. (2001). Compartmentalized and Binary Behavior of Terminal Dendrites in Hippocampal Pyramidal Neurons. Science. 293 (5538): 2272—2275. doi:10.1126/science.1061198. ISSN 0036-8075.
- ↑ а б в Major Guy, Larkum Matthew E. and Schiller Jackie (2013). Active Properties of Neocortical Pyramidal Neuron Dendrites. Annual Review of Neuroscience. 36 (1): 1—24. doi:10.1146/annurev-neuro-062111-150343. ISSN 0147-006X.
- ↑ Polsky A., Mel B., and Schiller J. (2009). Encoding and Decoding Bursts by NMDA Spikes in Basal Dendrites of Layer 5 Pyramidal Neurons. Journal of Neuroscience. 29 (38): 11891—11903. doi:10.1523/JNEUROSCI.5250-08.2009. ISSN 0270-6474.
- ↑ а б Major G., Polsky A., Denk W., Schiller J., and Tank D.W. (2008). Spatiotemporally Graded NMDA Spike/Plateau Potentials in Basal Dendrites of Neocortical Pyramidal Neurons. Journal of Neurophysiology. 99 (5): 2584—2601. doi:10.1152/jn.00011.2008. ISSN 0022-3077.
- ↑ а б Polsky Alon, Mel Bartlett W and Schiller Jackie (2004). Computational subunits in thin dendrites of pyramidal cells. Nature Neuroscience. 7 (6): 621—627. doi:10.1038/nn1253. ISSN 1097-6256.
- ↑ а б в Ariav Gal, Polsky Alon , and Schiller Jackie (27 серпня 2003). Submillisecond Precision of the Input–Output Transformation Function Mediated by Fast Sodium Dendritic Spikes in Basal Dendrites of CA1 Pyramidal Neurons. The Journal of Neuroscience. 23: 7750—7758. Архів оригіналу за 30 листопада 2018. Процитовано 18 жовтня 2013.
- ↑ Schiller Jackie and Schiller Yitzhak (2001). NMDA receptor-mediated dendritic spikes and coincident signal amplification. Current Opinion in Neurobiology. 11 (3): 343—348. doi:10.1016/S0959-4388(00)00217-8. ISSN 0959-4388.
- ↑ а б Hausser M. (27 жовтня 2000). Diversity and Dynamics of Dendritic Signaling. Science. 290: 739—744. doi:10.1126/science.290.5492.739. Архів оригіналу за 28 вересня 2014. Процитовано 4 листопада 2013.
- ↑ Colbert Costa M. and Pan Enhui (2002). Ion channel properties underlying axonal action potential initiation in pyramidal neurons. Nature Neuroscience. 5 (6): 533—538. doi:10.1038/nn857. ISSN 1097-6256.
- ↑ Magee Jeffrey C. and Cook Erik P. (2000). Somatic EPSP amplitude is independent of synapse location in hippocampal pyramidal neurons. Nature Neuroscience. 3 (9): 895—903. doi:10.1038/78800. ISSN 1097-6256.
- ↑ Gasparini S., Migliore M. and Magee J. (2004). On the Initiation and Propagation of Dendritic Spikes in CA1 Pyramidal Neurons. Journal of Neuroscience. 24 (49): 11046—11056. doi:10.1523/JNEUROSCI.2520-04.2004. ISSN 0270-6474.
- ↑ а б в Stuart Greg and Häusser Michael (1994). Initiation and spread of sodium action potentials in cerebellar purkinje cells. Neuron. 13 (3): 703—712. doi:10.1016/0896-6273(94)90037-X. ISSN 0896-6273.
- ↑ Larkum M. E. , Rioult M. G. , and Luscher H. R. (1 січня 1996). Propagation of action potentials in the dendrites of neurons from rat spinal cord slice cultures. Journal of neurophysiology . 75: 154—170.
- ↑ а б Stuart Greg, Spruston Nelson, Sakmann Bert, and Häusser Michael (1997). Action potential initiation and backpropagation in neurons of the mammalian CNS. Trends in Neurosciences. 20 (3): 125—131. doi:10.1016/S0166-2236(96)10075-8. ISSN 0166-2236.
- ↑ а б в г Mainen, Z.F. and Sejnowski, T.J. (25 липня 1996). Influence of dendritic structure on firing pattern in model neocortical neurons. Nature. 382: 363—366. doi:10.1038/382363a0. PMID 8684467. Архів оригіналу за 17 жовтня 2013. Процитовано 8 листопада 2013.
- ↑ а б в Spruston N., Schiller Y., Stuart G., and Sakmann B. (1995). Activity-dependent action potential invasion and calcium influx into hippocampal CA1 dendrites. Science. 268 (5208): 297—300. doi:10.1126/science.7716524. ISSN 0036-8075.
- ↑ Goldstein Steven S. and Rall Wilfrid (1974). Changes of Action Potential Shape and Velocity for Changing Core Conductor Geometry. Biophysical Journal. 14 (10): 731—757. doi:10.1016/S0006-3495(74)85947-3. ISSN 0006-3495.
- ↑ Spruston Nelson, Jaffe David B. and Johnston Daniel (1994). Dendritic attenuation of synaptic potentials and currents: the role of passive membrane properties. Trends in Neurosciences. 17 (4): 161—166. doi:10.1016/0166-2236(94)90094-9. ISSN 0166-2236.
- ↑ Rapp M., Yarom Y. and Segev I. (1996). Modeling back propagating action potential in weakly excitable dendrites of neocortical pyramidal cells. Proceedings of the National Academy of Sciences. 93 (21): 11985—11990. doi:10.1073/pnas.93.21.11985. ISSN 0027-8424.
- ↑ а б Miles R., Toth K., Gulyas A., Hajos N., and Freund T. (1996). Differences between Somatic and Dendritic Inhibition in the Hippocampus. Neuron. 16 (4): 815—823. doi:10.1016/S0896-6273(00)80101-4. ISSN 0896-6273.
- ↑ Magee J. and Johnston D. (1995). Synaptic activation of voltage-gated channels in the dendrites of hippocampal pyramidal neurons. Science. 268 (5208): 301—304. doi:10.1126/science.7716525. ISSN 0036-8075.
- ↑ а б Magee J. C. (1997). A Synaptically Controlled, Associative Signal for Hebbian Plasticity in Hippocampal Neurons. Science. 275 (5297): 209—213. doi:10.1126/science.275.5297.209. ISSN 0036-8075.
- ↑ Amitai Y., Friedman A., Connors B. W. and Gutnick M. J. (1993). Regenerative Activity in Apical Dendrites of Pyramidal Cells in Neocortex. Cerebral Cortex. 3 (1): 26—38. doi:10.1093/cercor/3.1.26. ISSN 1047-3211.
- ↑ Kampa B. M. (2006). Calcium Spikes in Basal Dendrites of Layer 5 Pyramidal Neurons during Action Potential Bursts. Journal of Neuroscience. 26 (28): 7424—7432. doi:10.1523/JNEUROSCI.3062-05.2006. ISSN 0270-6474.
- ↑ Hausser M. (9 січня 2001). Synaptic function: dendritic democracy. Current Biology. 11 (1): R10—R12. doi:10.1016/S0960-9822(00)00034-8. Архів оригіналу за 24 вересня 2015. Процитовано 18 жовтня 2013.
- ↑ Doiron Brent, Laing Carlo, Longtin André, and Leonard Maler (2002). Journal of Computational Neuroscience. 12 (1): 5—25. doi:10.1023/A:1014921628797. ISSN 0929-5313.
{{cite journal}}: Пропущений або порожній|title=(довідка) - ↑ Bliss T.V.P. and Collingridge G.L. (1993). A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361 (6407): 31—39. doi:10.1038/361031a0. ISSN 0028-0836.
- ↑ Svoboda Karel, Denk Winfried, Kleinfeld David, and Tank David W. (1997). In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612): 161—165. doi:10.1038/385161a0. ISSN 0028-0836.
- ↑ Yuste Rafael, Gutnick Michael J., Saar Drorit, Delaney Kerry R., Tank David W. (1994). Ca2+ accumulations in dendrites of neocortical pyramidal neurons: An apical band and evidence for two functional compartments. Neuron. 13 (1): 23—43. doi:10.1016/0896-6273(94)90457-X. ISSN 0896-6273.
- ↑ Tong G., Shepherd D., and Jahr C. (1995). Synaptic desensitization of NMDA receptors by calcineurin. Science. 267 (5203): 1510—1512. doi:10.1126/science.7878472. ISSN 0036-8075.
- ↑ Bloodgood Brenda L., Sharma Nikhil, Browne Heidi Adlman, and Trepman Alissa Z. (2013). The activity-dependent transcription factor NPAS4 regulates domain-specific inhibition. Nature. 503 (7474): 121—125. doi:10.1038/nature12743. ISSN 0028-0836.
- ↑ Maya-Vetencourt José Fernando (2013). Activity-Dependent NPAS4 Expression and the Regulation of Gene Programs Underlying Plasticity in the Central Nervous System. Neural Plasticity. 2013: 1—12. doi:10.1155/2013/683909. ISSN 2090-5904.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Stuart Greg J., Häusser Michael (2001). Dendritic coincidence detection of EPSPs and action potentials. Nature Neuroscience. 4 (1): 63—71. doi:10.1038/82910. ISSN 1097-6256.
- ↑ Sjöström Per Jesper, Häusser Michael (2006). A Cooperative Switch Determines the Sign of Synaptic Plasticity in Distal Dendrites of Neocortical Pyramidal Neurons. Neuron. 51 (2): 227—238. doi:10.1016/j.neuron.2006.06.017. ISSN 0896-6273.
- ↑ London Michael and Häusser Michael (2005). Dendritic computation. Annual Review of Neuroscience. 28 (1): 503—532. doi:10.1146/annurev.neuro.28.061604.135703. ISSN 0147-006X.
- ↑ Larkum M. E., Nevian T., Sandler M., Polsky A. and Schiller J. (2009). Synaptic Integration in Tuft Dendrites of Layer 5 Pyramidal Neurons: A New Unifying Principle. Science. 325 (5941): 756—760. doi:10.1126/science.1171958. ISSN 0036-8075.
- ↑ а б Giugliano M., Camera G., Fusi S., and Senn W. (2008). The response of cortical neurons to in vivo-like input current: theory and experiment: II. Time-varying and spatially distributed inputs. Biological Cybernetics. 99 (4-5): 303—318. doi:10.1007/s00422-008-0270-9. ISSN 0340-1200.
- ↑ Larkum M.E., Senn В. and Lüscher H.-R. (2004). Top-down Dendritic Input Increases the Gain of Layer 5 Pyramidal Neurons. Cerebral Cortex. 14 (10): 1059—1070. doi:10.1093/cercor/bhh065. ISSN 1460-2199.
- ↑ Lorente de No, R. and Condouris G.A. (1959 April). Decremental Conduction in Peripheral Nerve. Integration of Stimuli in the Neuron. PNAS. 45: 592—617.
- ↑ Gasparini S. and Magee (2006). State-Dependent Dendritic Computation in Hippocampal CA1 Pyramidal Neurons. Journal of Neuroscience. 26 (7): 2088—2100. doi:10.1523/JNEUROSCI.4428-05.2006. ISSN 0270-6474.
- ↑ Jack James , Noble Denis , Tsien Richard W. (1975). Electric Current Flow in Excitable Cells. Oxford University Press. с. 518.
- ↑ Larriva-Sahd Jorge (2002). Some contributions of Rafael Lorente de Nó to neuroscience: A reminiscence. Brain Research Bulletin. 59 (1): 1—11. doi:10.1016/S0361-9230(02)00838-9. ISSN 0361-9230.
- ↑ Bekkers J.M. and Hausser M. (2007). Targeted dendrotomy reveals active and passive contributions of the dendritic tree to synaptic integration and neuronal output. Proceedings of the National Academy of Sciences. 104 (27): 11447—11452. doi:10.1073/pnas.0701586104. ISSN 0027-8424.
- ↑ Segev Idan and Rall Wilfrid (1998). Excitable dendrites and spines: earlier theoretical insights elucidate recent direct observations. Trends in Neurosciences. 21 (11): 453—460. doi:10.1016/S0166-2236(98)01327-7. ISSN 0166-2236.
- ↑ а б в г д Roth Arnd (2004). New biophysical methods for the characterization of signal transfer in neurons (PhD thesis). с. 108.
- ↑ а б в г Vetter P., Roth A ., and Häusser M. (1 лютого 2001). Propagation of Action Potentials in Dendrites Depends on Dendritic Morphology. Journal of neurophysiology . 85: 926—937. Архів оригіналу за 11 квітня 2012. Процитовано 17 листопада 2013.
- ↑ Kim HG and Connors BW (1 грудня 1993). Apical dendrites of the neocortex: correlation between sodium-and calcium-dependent spiking and pyramidal cell morphology. The Journal of Neuroscience. 12 (13): 5301—5311. Архів оригіналу за 29 липня 2013. Процитовано 17 листопада 2013.
- ↑ Samsonovich A.V. and Ascoli G.A. (2006). Morphological homeostasis in cortical dendrites. Proceedings of the National Academy of Sciences. 103 (5): 1569—1574. doi:10.1073/pnas.0510057103. ISSN 0027-8424.
- ↑ а б в Roth A. and Hausser M. (1 вересня 2001). Compartmental models of rat cerebellar Purkinje cells based on simultaneous somatic and dendritic patchclamp recordings. The Journal of Physiology. 535: 445—472. doi:10.1111/j.1469-7793.2001.00445.x.[недоступне посилання з серпня 2019]
- ↑ Rall, Wilfrid (1964.). Theoretical significance of dendritic trees for neuronal input-output relations.. Neural Theory and Modeling: Proceedings of the 1962 Ojai Symposium. Stanford University Press. с. 73—97. ISBN 9780804701945.
- ↑ Rall, Wilfrid (1964.). Theoretical significance of dendritic trees for neuronal input-output relations.. Neural Theory and Modeling: Proceedings of the 1962 Ojai Symposium. Stanford University Press. с. 73—97. ISBN 9780804701945.
- ↑ Zador, Anthony M. and Agmon-snir, Hagai and Segev, Idan (1 березня 1995). The morphoelectrotonic transform: a graphical approach to dendritic function. The Journal of Neuroscience. 15 (3): 1669—1682. Архів оригіналу за 1 грудня 2018. Процитовано 17 листопада 2013.
- ↑ Bailey C.H. and Kandel E.R. (1993). Structural Changes Accompanying Memory Storage. Annual Review of Physiology. 55 (1): 397—426. doi:10.1146/annurev.ph.55.030193.002145. ISSN 0066-4278.
- ↑ Yacoubian Talene A. and Lo Donald C. (2000). Truncated and full-length TrkB receptors regulate distinct modes of dendritic growth. Nature Neuroscience. 3 (4): 342—349. doi:10.1038/73911. ISSN 1097-6256.
- ↑ MacDermott A.B., Mayer.L., Westbrook G.L., Smith S.J., and Barker J.L. (1986). NMDA-receptor activation increases cytoplasmic calcium concentration in cultured spinal cord neurones. Nature. 321 (6069): 519—522. doi:10.1038/321519a0. ISSN 0028-0836.
- ↑ Zhu J. Julius (2004). Maturation of layer 5 neocortical pyramidal neurons: amplifying salient layer 1 and layer 4 inputs by Ca2+ action potentials in adult rat tuft dendrites. The Journal of Physiology. 526 (3): 571—587. doi:10.1111/j.1469-7793.2000.00571.x. ISSN 0022-3751.
Література[ред. | ред. код]
Книги[ред. | ред. код]
- Stuart G, Spruston N, Hausser M., ред. (1999). Dendrites. Oxford University Press. с. 139—160. ISBN ISBN 0198566565..
{{cite book}}: Перевірте значення|isbn=: недійсний символ (довідка) - Hille, Bertil (2001). Ionic Channels of Excitable Membranes. Sinauer Associates, Incorporated. с. 814. ISBN 9780878933211.
- Squire, Larry, ред. (2008). Fundamental Neuroscience (вид. 3). с. 63. ISBN 978-0-12-374019-9.
- Yuste, Rafael (2010). Dendritic Spines. MIT Press. с. 264. ISBN 9780262013505.
- Koch, Christof (2004). Biophysics of Computation: Information Processing in Single Neurons. Oxford University Press. с. 562. ISBN 9780195181999.
- Galizia, C. Giovanni and Lledo, Pierre-Marie, ред. (2013). Neurosciences - From Molecule to Behavior: a university textbook. Springer. с. 736. ISBN 978-3-642-10769-6.
Оглядові статті[ред. | ред. код]
- Sjostrom P. J., Rancz E. A., Roth A., Hausser M. (2008). Dendritic Excitability and Synaptic Plasticity. Physiological Reviews. 88 (2): 769—840. doi:10.1152/physrev.00016.2007. ISSN 0031-9333.
- Hausser M. (27 жовтня 2000). Diversity and Dynamics of Dendritic Signaling. Science. 290: 739—744. doi:10.1126/science.290.5492.739. Архів оригіналу за 28 вересня 2014. Процитовано 4 листопада 2013.
- Major Guy, Larkum Matthew E. and Schiller Jackie (2013). Active Properties of Neocortical Pyramidal Neuron Dendrites. Annual Review of Neuroscience. 36 (1): 1—24. doi:10.1146/annurev-neuro-062111-150343. ISSN 0147-006X.
- London Michael and Häusser Michael (2005). Dendritic computation. Annual Review of Neuroscience. 28 (1): 503—532. doi:10.1146/annurev.neuro.28.061604.135703. ISSN 0147-006X.
- Johnston D, Magee JC, Colbert CM, Christie BR (1996). Active Properties of Neuronal Dendrites. Annual Review of Neuroscience. 19 (1): 165—186. doi:10.1146/annurev.ne.19.030196.001121. ISSN 0147-006X.
- Mel Bartlett W. (1994). Information Processing in Dendritic Trees. Neural Computation. 6 (6): 1031—1085. doi:10.1162/neco.1994.6.6.1031. ISSN 0899-7667.