Дигалан
| Дигалан | |
|---|---|

| |
| Систематична назва | дигалан(6) |
| Інші назви | гідрид галію, Галій(III) гідрид |
| Ідентифікатори | |
| Номер CAS | 12140-58-8 |
| SMILES | |
| InChI | |
| Властивості | |
| Молекулярна формула | Ga2H6 |
| Зовнішній вигляд | безбарвна рідина |
| Тпл | -21,4 °C |
| Ткип | 139 °C (визначена інтерполяцією) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Дигала́н — бінарна неорганічна сполука Галію та Гідрогену складу Ga2H6. За звичайних умов являє собою прозору, рухливу рідину. При температурах, вищих за 130 °C, дигалан розкладається з утворенням простих речовин. Через свою малостійкість сполука не знайшла широкого використання.
Структура[ред. | ред. код]
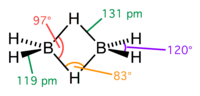
Молекула дигалану за своєю будовою подібна до диборану: центральні атоми Галію сполучені між собою містковими атомами Гідрогену. Бічні міжатомні відстані Ga—H у дигалані дорівнюють 152 пм, місткові відстані Ga—H — 171 пм, кут Ga—H—Ga — 98°. Відстань між атомами Галію — 258 пм.
При синтезі дигалану у розчинах випадає білий осад, який являє собою олігомерний ланцюг (GaH3)x (така форма за властивостями та способом утворення повністю відповідає гідриду алюмінію). Нільс Віберг припустив, що в результаті взаємодії утворюється мономер гідриду галію, який з часом полімеризується.
Отримання[ред. | ред. код]
Дигалан можна синтезувати шляхом двостадійного процесу: обробкою галогеніду галію алкілзаміщеним силаном з наступною взаємодією із галогідридом натрію:
Іншим методом отримання дигалану є взаємодія його метилзаміщеної похідної з триетиламіном:
Хімічні властивості[ред. | ред. код]
При середніх температурах (вище 130 °C) дигалан розкладається на прості речовини:
Твердий Ga2H6 відносно стійкий до розчинення у воді, а при дії кислот активно розкладається з утворенням водню:
В ефірних розчинах дигалан може взаємодіяти з іншими гідридами, утворюючи подвійні гідриди:
Джерела[ред. | ред. код]
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
| Це незавершена стаття про неорганічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |





