Ескулетин
| Ескулетин[1] | |
|---|---|
| |
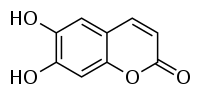
| Назва за IUPAC | 6,7-дигідрокси-хромен-2-он |
| Інші назви | цихоригенін 6,7-дигідроксикумарин |
| Ідентифікатори | |
| Номер CAS | 305-01-1 |
| PubChem | 5281416 |
| Номер EINECS | 206-161-5 |
| KEGG | C09263 |
| ChEBI | 490095 |
| SMILES | C1=CC(=O)OC2=CC(=C(C=C21)O)O |
| InChI | 1/C9H6O4/c10-6-3-5-1-2-9(12)13-8(5)4-7(6)11/h1-4,10-11H |
| Номер Бельштейна | 152788 |
| Властивості | |
| Молекулярна формула | C9H6O4 |
| Молярна маса | 178,14 г/моль |
| Зовнішній вигляд | білий або жовтуватий порошок |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Ескулетин (англ. Aesculetin; також відомий як 6,7-дигідроксикумарин та цихоригенін) — похідний кумарину, природний лактон, що виникає при внутрішньомолекулярній циклізації похідного коричної кислоти.
Присутній у цикорії та багатьох токсичних та лікарських рослинах у формі глікозидів та кон'югатів кавової кислоти.[2]
Сполука використовується в деяких сонцезахисних кремах, але є дані, що вона діє як фотосенсибілізатор для пошкодження ДНК.[3] Натрієва сіль метилового похідного ескулетину використовується в дерматології для лікування варикозу.
Ескулетин — синя флуоресцентна сполука, що міститься в рослинах.[4] Ескулін, глюкозид ескулетину, флуоресціює під ультрафіолетовим світлом з довгими хвилями (360 нм). Гідроліз ескуліну призводить до втрати цієї флуоресценції. Ескулетин має здатність гасити внутрішню флуоресценцію бичачого сироваткового альбуміну.[5]
Ескулетин може трансформуватися у скополетин (7-гідрокси-6-метоксикумарин) та ізоскополетин (6-гідрокси-7-метоксикумарин) шляхом інкубації з катехолом-O-метилтрансферазою у печінці щурів.[6]
Ескулетин може бути синтезований конденсацією триацетату гідроксігідрохінону з малоновою кислотою в концентрованій сірчаній кислоти [7].
Примітки[ред. | ред. код]
- ↑ Aesculetin. Sigma-Aldrich.
- ↑ Dey, P. M.; Harborne, J. B., ред. (1997). Plant Biochemistry. Academic Press. ISBN 9780122146749.
- ↑ Hausen, B. M.; Schmieder, M. (September 1986). The sensitizing capacity of coumarins (I). Contact Dermatitis. 15 (3): 157—163. doi:10.1111/j.1600-0536.1986.tb01317.x. PMID 3780217.
- ↑ Lang, M.; Stober, F.; Lichtenthaler, H.K. (1991). Fluorescence emission spectra of plant leaves and plant constituents. Radiation and Environmental Biophysics. 30 (4): 333—347. doi:10.1007/BF01210517. PMID 1961919.
- ↑ Liu, X.-F.; Xia, Y.-M.; Fang, Y.; Zou, L.; Liu, L.-L. (2004). Interaction between natural pharmaceutical homologues of coumarin and bovine serum albumin. Huaxue Xuebao. 62 (16): 1484—1490.
- ↑ Müller-Enoch, D.; Seidl, E.; Thomas, H. (1976). 6.7-Dihydroxycoumarin (Aesculetin) as a substrate for catechol-o-methyltransferase. Z. Naturforsch. C (нім.). 31 (5–6): 280—284. doi:10.1515/znc-1976-5-611. PMID 134569.
- ↑ Ahluwalia, V. K.; Bhagat, Pooja; Aggarwal, Renu; Chandra, Ramesh (30 грудня 2013). Intermediates for Organic Synthesis. I. K. International Pvt Ltd. с. 213. ISBN 978-81-88237-33-3.