Міастенія
| Міастенія гравіс | |
|---|---|
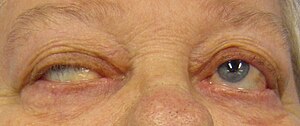 Косоокість та птоз у хворого на міастенію гравіс, що виникають при намаганні відкрити очі | |
| Спеціальність | неврологія |
| Препарати | піридостигмін[1][2], неостигмін[1], циклоспорин[1][2], циклофосфамід[1], преднізон[2], азатіоприн[2], ритуксимаб[2], екулізумаб[2], mycophenolate mofetild[2], преднізолон[2], такролімус[2], distigmined[3] і піридостигмін[4] |
| Частота | 0.015% |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 8C60 |
| МКХ-10 | G70.0 |
| OMIM | 254200 |
| DiseasesDB | 8460 |
| MedlinePlus | 000712 |
| eMedicine | oph/263 |
| MeSH | D009157 |
| | |
Міастені́я гравіс (англ. Myasthenia gravis, від грец. μύς — «м'яз» та ἀσθένεια — «слабкість», буквально «тяжка міастенія») — автоімунний нервово-м'язовий розлад, що клінічно характеризується патологічною слабкістю і стомлюваністю скелетних м'язів, пов'язаний з ушкодженням ацетилхолінових рецепторів постсинаптичної мембрани поперечно-смугастих м'язів специфічними комплементфіксуючими антитілами. Синоніми хвороби: астенічна офтальмоплегія, хвороба Ерба — Гольдфлама, бульбарний астенічний параліч.
Етіологія і патогенез[ред. | ред. код]
Етіологія і патогенез міастенії остаточно не визначені. У сучасній медицині міастенія розцінюється як аутоімунне захворювання. У механізмі патологічної стомлюваності м'язів головного значення надають блокаді постсинаптичних ацетилхолінових рецепторів нервово-м'язових з'єднань аутоантитілами. Патогенез зумовлений блокуванням провідності на рівні міоневрального синапсу. Специфічні антиацетилхолінові антитіла знижують кількість ацетилхолінових рецепторів у нервово-м'язових з'єднаннях. Крім того, постсинаптичні імпульси «спрощуються», що призводить до припинення нейром'язової передачі. Повторна активація нервово-м'язових з'єднань спричиняє нормальне вивільнення ацетилхоліну. Кількість ацетилхолінових рецепторів, які можуть активізувати м'язові волокна, прогресивно зменшується, що і призводить до міастенічної стомлюваності. Істотна роль належить патології зобної залози. Останнім часом доведено імунологічне значення селезінки, що відіграє певну роль у дозріванні й диференціації лімфоцитів та продукції специфічних антитіл.
Клінічні ознаки[ред. | ред. код]
Клінічні прояви міастенії різноманітні та включають окуломоторні, бульбарні порушення, слабкість жувальних і мімічних м'язів, м'язів шиї та кінцівок. Поширеність патологічного процесу на різні групи м'язів може бути досить варіабельною: від одностороннього птозу до залучення практично всіх довільних м'язів.
Очні симптоми[ред. | ред. код]
Ураження очей при міастенії:
- Птоз у хворих на міастенію характеризується асиметрією, динамічністю протягом доби (зменшується вранці та після відпочинку, наростає при фізичному або зоровому навантаженні, переважно в другій половині дня). Опущення повік наростає при фіксації погляду і рухах очними яблуками в боки, а також після фізичного навантаження (зажмурювання, присідання, ходьба та ін.).
- Окуломоторні порушення асиметричні, мінливі при навантаженні, не вкладаються в зону іннервації ІІІ, IV, VI пар черепних нервів. Характерний так званий м'язовий ністагмоїд — відхилення очних яблук у крайніх відведеннях при фіксації погляду з поверненням на місце.
- Диплопія при міастенії посилюється при зоровому і фізичному навантаженні, на яскравому світлі, у другій половині дня (особливо при прогляданні телепередач), більш виражена при погляді вдалину (два однакові предмети на вулиці, роздвоєння дороги, сходинок, два телевізори тощо), зменшується після відпочинку із закритими очима та вранці.
М'язові симптоми[ред. | ред. код]
Ураження м'язів характеризують:
- Мімічна слабкість — один з основних симптомів міастенії. Вона більш виражена у верхній половині обличчя — в кругових м'язах очей, підсилюється при повторному зажмурюванні й загальному фізичному навантаженні. Унаслідок слабкості кругового м'яза рота спостерігають утруднення при надуванні щік, усмішка «гарчання», рідше виникає «поперечна усмішка».
- Бульбарний синдром характеризується порушеннями ковтання (захлинання, потрапляння рідкої їжі в носові ходи), гугнявістю, дизартрією, рідше — охриплістю голосу і дуже рідко — порушеннями модуляції голосу, що нагадує заїкання. Бульбарні порушення також мають динамічний характер: підсилюються при мовному, загальному фізичному навантаженні, під час прийому їжі (особливо при вживанні гарячої їжі), зменшуються після відпочинку.
- Слабкість жувальних м'язів також є характерним для міастенії симптомом — стомлення при жуванні, іноді до звисання нижньої щелепи, хворі під час вживання їжі підтримують щелепу і допомагають собі при жуванні рукою.
- Слабкість м'язів тулуба і шиї частіше відзначають у хворих похилого віку і виражається в зігнутій позі внаслідок слабкості м'язів спини, звисаючій голові внаслідок слабкості задньої групи м'язів шиї.
- Слабкість м'язів кінцівок може бути «ізольованою» (тобто без інших симптомів міастенії) — так звана тулубна форма, може поєднуватися із слабкістю довільних м'язів іншої локалізації. Типові для міастенії слабкість проксимальних м'язів кінцівок, переважання слабкості м'язів-розгиначів над м'язами-згиначами, підсилення слабкості при навантаженні (неспроможність увійти до транспорту після швидкої ходьби або бігу, падіння при спробі піти швидше, підйомі сходами, тощо), істотне зменшення слабкості вранці і після відпочинку.
М'язові групи, що уражаються: дельтоподібний м'яз, трицепс плеча, клубово-поперековий м'яз; можлива також поява слабкості після навантаження (або посилення її) в інших м'язових групах: розгиначах кистей і стоп, рідше — у двоголових м'язах плеча, чотириглавих м'язах стегна, дрібних м'язах кистей, тобто можуть уражатися практично всі довільні м'язи кінцівок.
- Дихальні розлади при міастенії пов'язані з декількома причинами: ослабленням міжреберних м'язів, діафрагми, рідше — із западанням надгортанника внаслідок ослаблення м'язів гортані. Респіраторні порушення у хворих характеризуються утрудненням вдиху, послабленням кашльового поштовху, скупченням густої, в'язкої слини, яку неможливо проковтнути.
Міастенічний криз[ред. | ред. код]
Особливий стан — міастенічний криз, при якому з різних причин відбувається різке погіршення стану з порушенням вітальних функцій. Частіше міастенічний криз провокує бронхолегенева інфекція, при цьому порушення дихання можуть мати змішаний характер. Диференціювати міастенічний криз від інших станів, що супроводжуються респіраторними розладами, можна за наявності бульбарного синдрому, гіпомімії, птозу, асиметричного зовнішнього офтальмопарезу, слабкості та стомлюваності м'язів кінцівок і шиї, що зменшується у відповідь на введення антихолінестеразних препаратів.
Діагностика[ред. | ред. код]
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Міастенію встановлюють на підставі анамнестичних даних, клінічного огляду, позитивної проби з антихолінестеразними препаратами, електроміографічного обстеження, динамічного спостереження. При зборі анамнезу звертають увагу на мінливість симптомів протягом доби, зв'язок їх з навантаженням, наявність часткових або повних ремісій, зворотність симптомів на тлі вживання антихолінестеразних препаратів (на час їх дії) і на тлі адекватної імуносупресивної терапії. Специфічним тестом для діагностики міастенії є проба з антихолінестеразними препаратами: прозерином, каліміном. Найчастіше проводять пробу з прозерином (неостигміном). Дозу підбирають індивідуально з розрахунку 0,125 мг/кг маси тіла. Можна вибрати будь-який парентеральний шлях введення препарату, але зазвичай проводять підшкірну ін'єкцію. Оцінюють дію препарату через 30-40 хвилин. Позитивною пробу вважають при відновленні м'язової сили з компенсацією бульбарних і окуломоторних порушень. У діагностично складних випадках проводять морфологічне дослідження м'язового біоптату (світлова, електронна мікроскопія, гістохімічне, імуногістохімічне, імунофлюоресцентне та інші види візуального вивчення нервово-м'язових з'єднань і оточуючих їх тканин). Поряд з різними клінічними, електрофізіологічними, фармакологічними методами для уточнення діагнозу міастенія використовують й імунологічні методи (імуноферментні, радіоімунологічні), що полягають в кількісному визначенні анти-АХ-автоантитіл у сироватці крові хворих, що дозволяє з імовірністю до 80 % підтвердити цей діагноз.
Диференційний діагноз[ред. | ред. код]
Необхідно проводити з: конгенітально-спадковими формами міастенії, міастенічними синдромами (за типом Ламберта — Ітона, при інфекційних хворобах та інтоксикаціях); розсіяним склерозом, нейроінфекціями (енцефалітом, енцефаломієлополірадикулоневритами, поліневритами); бічним аміотрофічним склерозом; спадковими і запальними міопатіями, міотонічною дистрофією (хвороба Россолімо — Куршнера — Штейнерта — Баттена), структурними (мітохондріальними) міопатіями; нейроендокринними синдромами, різними варіантами пароксизмальної міоплегії; органічними захворюваннями ЦНС (об'ємні утворення, судинні захворювання головного і спинного мозку); астеноневротичними реакціями, синдромом хронічної стомлюваності та іншими станами, що супроводжуються загальною стомлюваністю.
Лікування[ред. | ред. код]
Невідкладна допомога[ред. | ред. код]
Лікування міастенічного кризу:
- В першу чергу необхідно забезпечити адекватне дихання за допомогою примусової штучної вентиляції легень (ШВЛ). Показниками до ШВЛ є порушення ритму дихання, ціаноз, збудження, втрата свідомості, участь допоміжної мускулатури, зміна величини зіниць, відсутність реакції на введення антихолінестеразних препаратів.
- Проведення екстракорпоральних методів — плазмаферезу або плазмасорбції. Проводять її курсом упродовж 1-2 тижнів з кратністю 2-5 операцій.
- Застосування імуноглобулінів. Людський імуноглобулін є імунореактивним білком. Препарати виготовляють з плазми здорових людей. Високі дози імуноглобуліну пригнічують імунні процеси. Нині терапія імуноглобуліном є альтернативою плазмаферезу через схожість механізмів, що лежать в основі цих методів лікування[джерело?]. Загальноприйнятим режимом терапії вважають короткі 5-денні курси внутрішньовенного введення препарату в дозі 400 міліграм/кг щоденно. У середньому клінічний ефект відзначають на 4-й день терапії. Він зберігається впродовж 50-100 днів. Можуть також застосовувати внутрішньовенно краплинно октагам і біовен в мінімальній дозі 4-5 міліграм/кг № 10, сумарна доза становить 25 г[джерело?]. Можливе використання нормального людського імуноглобуліну в дозі 50 мл внутрішньовенно краплинно на 100—150 мл фізіологічного розчину. Інфузії повторюють через день в дозі 3-5 г на курс лікування.
- Застосування антихолінестеразних препаратів. Застосування їх в дозах діагностичної проби показане при будь-якій формі кризу (найбільш ефективне їх введення при міастенічному кризі). Прозерин вводять підшкірно в дозі від 1,5 до 2,5 мл, для зменшення небажаних ефектів вводять 0,1 % розчин атропіну по 0,2-0,5 мл. Результат оцінюють як при прозериновій пробі.
- Застосування глюкокортикостероїдних препаратів. Найбільш ефективна пульс-терапія метилпреднізолоном внутрішньовенно краплинно в дозі 1000 мг. Після проведення пульс-терапії рекомендують щоденний прийом преднізолону.
Консервативне лікування[ред. | ред. код]
Успіхи в лікуванні міастенії пов'язані з впровадженням в практику антихолінестеразних препаратів (1932—1934 рр.), тимектомії (1939 р.), глюкокортикостероїдної терапії (1966 р.). У останні десятиріччя широко застосовують екстракорпоральні методи (гемосорбція, плазмаферез), з початку 90-х років ХХ століття з успіхом використовують для лікування автоімунних захворювань в/в нормальний людський імуноглобулін. Найбільший ефект лікування спостерігають при поєднанні цитостатиків із глюкокортикоїдами. Є окремі повідомлення про застосування при міастенії антилімфоцитарного і антитимусного глобулінів[джерело?].
Застосування антихолінестеразних препаратів[ред. | ред. код]
Розраховане на збільшення впливу медіатора ацетилхоліну на функціональну здатність ацетилхолінових постсинаптичних рецепторів внаслідок пригнічення дії холінестерази. Дози антихолінестеразних препаратів підбирають індивідуально. Зазвичай застосовують один препарат, оскільки комбінації антихолінестеразних препаратів можуть призвести до холінергічного кризу. Підсилення їх дії відбувається при одночасному призначенні солей калію.
Анаболічні стероїди[ред. | ред. код]
Можуть бути методом вибору в лікуванні міастенії при неадекватності або непереносимості інших засобів консервативної терапії, а також при наявності протипоказань до тимектомії. Препаратом вибору є ретаболіл. Це пов'язано з відсутністю токсичної дії та тривалим ефектом після однократної ін'єкції.
Глюкокортикоїди[ред. | ред. код]
Ефективними для лікування міастенії є глюкокортикоїди. Лікування преднізолоном слід починати з максимальних доз. Тривалість прийому максимальної дози залежно від тяжкості стану хворого, швидкості розвитку й ступеня вираженості поліпшення — від одного до декількох місяців — з подальшим поступовим зниженням у міру досягнення терапевтичного ефекту до підтримувальної дози. Глюкокортикоїдну терапію здійснюють на тлі вживання антихолінестеразних препаратів, але з'являється необхідність значного зменшення їх дозування для запобігання холінергічному кризу. У зв'язку з калійуричною дією глюкокортикоїдів хворі повинні одержувати препарати калію.
Імунодепресивна терапія[ред. | ред. код]
Імунодепресивну терапію застосовують при неефективності антихолінестеразних препаратів і глюкокортикостероїдів, у людей похилого віку з гострою формою міастенії, яким протипоказана тимектомія. Імунодепресивну терапію проводять препаратами азатіоприн та метотрексат.
Променева терапія[ред. | ред. код]
Як метод пригнічення функції вилочкової залози застосовують рентгенівське опромінення ділянки груднини. Це метод вибору у хворих із неоперабельними тимомами, при наявності протипоказань до хірургічного лікування.
Хірургічне лікування[ред. | ред. код]

Видалення вилочкової залози — тимектомія, широко розповсюджений і досить ефективний метод лікування міастенії. Операція ефективна лише при відносно нетривалому перебігу захворювання (8-10 років), у хворих віком не старше 50-60 років. Лікувальний вплив тимектомії при міастенії можна пояснити видаленням джерела постійної антигенної стимуляції — тимоми (пухлини тимусу). У хворих на міастенію, якщо виявили неефективність комплексної терапії, як правило, ефект приносить спленектомія.
Джерела[ред. | ред. код]
| Інформація в цьому розділі застаріла. (березень 2016) |
- Кузин М. И., Гехт Б. М. Миастения.- М., 1996;(рос.)
- Лайсек Р. П., Барчи Р. Л. Миастения. — М., 1984;(рос.)
- Роит А., Бростофф Дж., Мейл Д. Иммунология. — М., 2000;(рос.)
- Болезни вилочковой железы / В. П. Харченко, Д. С. Саркисов, П. С. Ветшев и др. — М., 1998;(рос.)
- Карлов В. А. Неврология. — М., 1999.(рос.)
Посилання[ред. | ред. код]
- МІАСТЕНІЯ [Архівовано 30 червня 2016 у Wayback Machine.]
|