Мідь: відмінності між версіями
| [неперевірена версія] | [перевірена версія] |
Shkod (обговорення | внесок) →Маркування промислової міді: уточнено за ГОСТ 859-2001 |
|||
| Рядок 86: | Рядок 86: | ||
|М00 |
|М00 |
||
|Cu-OFE |
|Cu-OFE |
||
|99, |
|99,96 |
||
|0, |
|0,03 |
||
|0,0005 |
|0,0005 |
||
|- |
|- |
||
|М0 |
|М0 |
||
|Cu-PHC, OF-Cu |
|Cu-PHC, OF-Cu |
||
|99, |
|99,93<sup>*</sup> |
||
|0, |
|0,04 |
||
|0,002 |
|0,002 |
||
|- |
|- |
||
|М1б |
|М1б |
||
|Cu-OF1, Cu-ETP1 |
|Cu-OF1, Cu-ETP1 |
||
|99,95 |
|99,95<sup>*</sup> |
||
|0,003 |
|0,003 |
||
|0,002 |
|0,002 |
||
| Рядок 104: | Рядок 104: | ||
|М1 |
|М1 |
||
|Cu-OF, Cu-ETP, Cu-FRHC, SW-Cu, E-Cu, E Cu58 |
|Cu-OF, Cu-ETP, Cu-FRHC, SW-Cu, E-Cu, E Cu58 |
||
|99,90 |
|99,90<sup>*</sup> |
||
|0, |
|0,05 |
||
| - |
| - |
||
|- |
|- |
||
|М1ф |
|М1ф |
||
|Cu-DHP, SF-Cu |
|Cu-DHP, SF-Cu |
||
|99, |
|99,90<sup>*</sup> |
||
| - |
| - |
||
|0,012 — 0,04 |
|0,012 — 0,04 |
||
| Рядок 116: | Рядок 116: | ||
|М2 |
|М2 |
||
| |
| |
||
|99,7 |
|99,7<sup>*</sup> |
||
|0,07 |
|0,07 |
||
| - |
| - |
||
| Рядок 122: | Рядок 122: | ||
|М3 |
|М3 |
||
| |
| |
||
|99,5 |
|99,5<sup>*</sup> |
||
|0,08 |
|0,08 |
||
| - |
| - |
||
|- |
|- |
||
|} |
|} |
||
Прим. <sup>*</sup> ''Cu+Ag, не менше''. |
|||
Специфічні особливості міді, що властиві різним маркам, визначаються не вмістом міді (відмінності складають не більше 0,5 %), а вмістом конкретних домішок (їх кількість може відрізнятися у 10…50 разів). Часто використовують класифікацію марок міді за вмістом кисню: |
Специфічні особливості міді, що властиві різним маркам, визначаються не вмістом міді (відмінності складають не більше 0,5 %), а вмістом конкретних домішок (їх кількість може відрізнятися у 10…50 разів). Часто використовують класифікацію марок міді за вмістом кисню: |
||
* безкиснева мідь |
* безкиснева мідь: М00б, М0б з вмістом кисню до 0,001 % і М1б до 0,003 %; |
||
* рафінована мідь (М1ф, М1р, М2р, М3р) з вмістом кисню до 0,01 %, але з підвищеним вмістом фосфору; |
* рафінована мідь (М1ф, М1р, М2р, М3р) з вмістом кисню до 0,01 %, але з підвищеним вмістом фосфору; |
||
* мідь високої чистоти (М00, М0, М1) з вмістом кисню 0, |
* мідь високої чистоти (М00, М0, М1) з вмістом кисню 0,03…0,05 %; |
||
* мідь загального призначення (М2, М3) з вмістом кисню до 0,08 %. |
* мідь загального призначення (М2, М3) з вмістом кисню до 0,08 %. |
||
Версія за 04:32, 16 грудня 2016
Мідь (традиційна назва) або Купрум (назва хімічного елемента в новій хімічній термінології, від лат. Cuprum) — хімічний елемент із хімічним символом Cu і атомним номером 29, що в чистому вигляді складає хімічну речовину мідь (до простої речовини назва «купрум» не застосовується).
Атомна маса міді 63,546. Це пластичний ковкий перехідний метал червонувато-золотистого кольору (рожевий за відсутності оксидної плівки), добрий провідник тепла і електрики. Віддавна його широко використовувала людина.
Походження назви
Українське слово «мідь» (разом з рос. медь, пол. miedź, чеськ. med) походить від праслов'янського *mědь, походження якого не з'ясоване. Були запропоновані такі версії:
- Одна з версій вважає це слово запозиченням з германських мов і пов'язує його з давньоверхньонімецьким smîdа («метал») і smid («коваль»), давньоісландським smiðr («ремісник», «коваль»), німецьким Schmied і англійським smith («коваль»).
- Друга припускає питомо слов'яньке походження, пов'язуючи його зі старослов'янським СМѢДЪ («темний»).
- Третя виводить назву металу від назви стародавньої країни Мідії (іранське Мādа-, грец. Μηδία).
- Четверта порівнює слов'янське слово з хеттським miti-, mita- («червоний»). Тобто, буквально — «червоний метал».
- Інші версії зв'язують «мідь» з грецьким σμίλη («ніж для вирізування») або з ірландським mēin(n) («руда, метал»)[1][2].
Латинська назва міді cuprum, «купрум» бере своє походження від назви острова Кіпр (грец. Κύπρος, у латинській передачі Kúpros), де у давнину існував широкий промисел мідних предметів.
Алхіміки звали мідь словом Venus ("Венера), пов'язуючи її з планетою Венера.
Загальні відомості
Густина 8,940 r/см3. tпл 1084,5 °С; tкип 2540 °С. Твердість за Моосом — 2,5-3. Хімічно малоактивна, але на повітрі завжди вкрита шаром оксидів або основного карбонату. Домішки: Ag, As, Fe, Bi, Sb, Hg, Ge. Взаємодіє з галогенами, сіркою, селеном, утворює комплексні сполуки з ціанідами і ін. Солі одновалентної міді у воді або нерозчинні, або якщо не стабілізуються комплексоутворенням диспропорціонують. Наприклад:
або більш загально в іонній формі:
Стабілізовані комплексоутворенням сполуки одновалентної міді ([Cu(NH3)2]+, [Cu(Г)2]- де Г — галоген (крім F) абоціанід-іон) легко окиснюються до сполук двовалентної міді, що використовується для очищення газів від кисню: їх пропускають через водний розчин амоніаку з порошком міді, при цьому поверхневий шар оксиду розчиняється і мідь вільно окиснюється. На практиці поведінку амоніачних розчинів оксидів міді можна спостерігати поклавши круглу мідну пластинку (монету) у прозору посудину з водним розчином амоніаку так, щоб розділити розчин на дві частини. У верхній частині, завдяки доступу кисню, розчин забарвиться в темно-синій колір сполуками двовалентної міді, в нижній сполуки двовалентної міді прореагують з металевою міддю з утворенням безбарвних сполук одновалентної міді, тому розчин буде світлішим або безбарвним.
Солі двовалентної міді добре розчинні у воді і в розбавлених розчинах повністю дисоційовані. Кларк міді 4,7·10−3 % за масою. В основних гірських породах її середній вміст трохи вищий (10−2). Мідь характерна для основного і кислого магматизму. При першому вона концентрується в магматичних і скарнових родововищах і поствулканічних колчеданних рудах. У зв'язку з гранітним магматизмом формуються мідно-порфірові і жильні родовища.
Історія

Початок мідної доби поклало освоєння людьми техніки гарячого кування і литва, якому багато сприяло поширення гончарного виробництва. Печі й керамічні форми для відливання дали можливість освоїти методи переробки самородної міді. Сталося це на Близькому Сході приблизно у IV тисячолітті до н. е., в Європі і Китаї в II—III тисячолітті до н. е., а в Перу на початку I тисячоліття до н. е.
Наступний етап розвитку технологій настав вже наприкінці III тисячоліття до н. е., коли була відкрита можливість отримання металів з руди. У зв'язку з відносною простотою отримання з руди і порівняно невисокою температурою плавлення мідь — один з перших металів, широко освоєних людиною. Одночасно, швидше за все випадково, було встановлено, що, якщо в тигель, де плавиться мідь, додати трохи олова, якість отриманого матеріалу суттєво покращиться.
На початку II тисячоліття до нашої ери мідь стала замінюватися бронзою. Приблизно у цю ж пору з'явилися й перші залізні вироби, але м'яке залізо (не придатне до лиття, оскільки вимагало надмірно високих температур), як матеріал для зброї і сільськогосподарських знарядь, не могло конкурувати з бронзою, — бронзова доба тривала ще 1000 років, аж до освоєння технологій навуглецьовування, гартування і зварювання сплавів заліза.
І пізніше бронза зберігала свою роль, так як перевершувала залізо в технологічності, — якщо форму залізному виробу можна було надавати лише куванням (тому навіть старовинні цвяхи мали квадратний перетин), то бронзові знаряддя можна було виливати. З XV століття бронза знову стала стратегічним матеріалом, оскільки виявилося, що вона незамінна для виготовлення гармат.
Мідь і її сплави з глибокої давнини служили для чеканення монет і медалей.
Мінерали міді

Відомо 170—200 мінералів міді, але промислове значення мають близько 20. До них належать: самородна мідь Cu (92 %), халькопірит (мідний колчедан) CuFeS2 (34,6 %), борніт Cu5FeS4(63,3 %), кубаніт CuFe2S3 (22 24 %), халькозин Cu2S (79,9 %), ковелін (мідний блиск) CuS (66,5 %), тенантит 3Cu2S·As2S3 (57,5 %), тетраедрит 3Cu2S·Sb2S3 (52,3 %), енаргіт Cu3AsS4, куприт Cu2O (88,8 %), тенорит CuO (79,9 %), малахіт Cu2CO3·Cu(OH)2 (57,4 %), азурит 2 CuCO3·Cu(OH)2 (55,3 %), халькантит Cu[SO4]•5H2O (31,8 %), бронцантит CuSO4·3Cu(OH)2 (56,2 %), атакаміт CuCl2·3Cu(OH)2 (59,5 %), хризокола CuSiO3·nH2O (36,6), делафосит CuFeO2, ендрюсит та ін.
Сульфіди міді (халькопірит, халькозин, борніт, лаутит) є найголовнішими в її рудах; підлегле значення мають сульфосолі (бляклі руди) і сульфоарсеніди (енаргіт); ще менше — оксиди, карбонати і силікати (див. мідні руди).
Виробництво міді
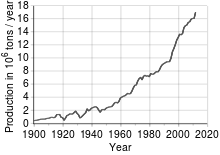
Отримання міді
Мідь отримують з мідних, мідно-молібденових, мідно-нікелевих і поліметалічних руд. Заводи випускають чорнову (99 %), рафіновану вогневим (99,6 % Cu) і електролітичним (99,95 % Cu) методами мідь.
Процес добування міді включає три основні етапи:
- збагачення мідної руди;
- виплавка чорнової міді;
- рафінування міді.
Враховуючи дуже малий вміст міді в рудах (1-2 %), руду спочатку збагачують флотаційним способом. Розмелену руду змішують з флотаційними реагентами піноутворювачами та водою і продувають пульпу повітрям. Пухирці повітря прилипають до зерен рудних мінералів, спливають і утворюють піну, а пуста порода, яка добре змочується водою опускається на дно.
Після фільтрації піни та просушування отримують концентрат з вмістом 10…35 % міді. Для зменшення вмісту сірки збагачену руду піддають окислювальному випалу при температурі 600…900 °C. Після цього руда поступає в полуменеві печі з температурою в зоні плавки 1450 °C, де відбувається дисоціація вищих сульфідів і карбонатів. Продукти дисоціації сплавляють між собою, утворюючи штейн — легкоплавкий сплав з температурою плавлення 900…1150 °C і вмістом 10…60 % Cu, 10…58 % Fe, 22…25 % S. Крім того, штейн містить домішки нікелю, цинку, свинцю, золота, срібла. Виплавка чорнової міді відбувається в горизонтальних конверторах з боковим дуттям продувкою штейну повітрям. Температура в конвертері становить 1200—1300 °C. Спочатку окисляється залізо:
Окисел заліза в вигляді шлаку спливає на поверхню і зливається. У другий період продування:
Закис міді розчиняється в розплаві та взаємодіє з напівсірчистою міддю з утворенням чорнової міді:
Тепло в конвертері виділяється за рахунок перебігу хімічних реакцій, без подавання палива. Таким чином, в конвертері отримують чорнову мідь, що містить 98,5…99,5 % Cu; 0,3…0,5 % S; 0,01…0,04 % Fe; 0,3…0,5 % Ni.
Рафінування чорнової міді проводять вогневим (окислення домішок при продуванні розплаву повітрям), або електролітичним способом за рахунок електролізу в водному розчині сірчаної кислоти та мідного купоросу. При проходженні струму анодні плити чорнової міді розчиняються і на катодах осаджується чиста електролітична мідь, а домішки випадають на дно ванни.
Найбільше міді добувають у Чилі. На долю цієї країни припадає третина світового виробництва. Далі за видобутком йдуть США, Індонезія та Перу.
Маркування промислової міді
Марки промислової міді та її хімічний склад визначається в ДСТУ ГОСТ 859—2003[3]. Скорочена інформація про марки міді та аналоги у зарубіжних стандартах наведена нижче:
| Марки міді | EN, DIN | Cu, % | O, % | P, % |
|---|---|---|---|---|
| М00 | Cu-OFE | 99,96 | 0,03 | 0,0005 |
| М0 | Cu-PHC, OF-Cu | 99,93* | 0,04 | 0,002 |
| М1б | Cu-OF1, Cu-ETP1 | 99,95* | 0,003 | 0,002 |
| М1 | Cu-OF, Cu-ETP, Cu-FRHC, SW-Cu, E-Cu, E Cu58 | 99,90* | 0,05 | - |
| М1ф | Cu-DHP, SF-Cu | 99,90* | - | 0,012 — 0,04 |
| М2 | 99,7* | 0,07 | - | |
| М3 | 99,5* | 0,08 | - |
Прим. * Cu+Ag, не менше.
Специфічні особливості міді, що властиві різним маркам, визначаються не вмістом міді (відмінності складають не більше 0,5 %), а вмістом конкретних домішок (їх кількість може відрізнятися у 10…50 разів). Часто використовують класифікацію марок міді за вмістом кисню:
- безкиснева мідь: М00б, М0б з вмістом кисню до 0,001 % і М1б до 0,003 %;
- рафінована мідь (М1ф, М1р, М2р, М3р) з вмістом кисню до 0,01 %, але з підвищеним вмістом фосфору;
- мідь високої чистоти (М00, М0, М1) з вмістом кисню 0,03…0,05 %;
- мідь загального призначення (М2, М3) з вмістом кисню до 0,08 %.
Сортамент промислових поставок
Промислова мідь постачається після наступних видів обробки тиском:
- холоднодеформований прокат — це тягнені (прутки, дріт, труби) і холоднокатані (листи, стрічка, фольга) вироби. Він випускається в твердому, напівтвердому і м'якому (відпаленому) станах;
- гарячедеформований прокат — результат пресування (прутки, труби) або гарячого вальцювання (листи, плити), при температурах вище температури рекристалізації (150…240 °C);
Сортамент промислової міді наступний:
- Мідні прутки — випускаються пресованими (20…180 мм) і холоднодеформовані, в твердому, напівтверді і м'якому станах (діаметр 3…50 мм) за ДСТУ ГОСТ 1535^2006[4].
- Плоский мідний прокат загального призначення випускається у вигляді фольги, стрічки, листів і плит з ДСТУ ГОСТ 1173:2006[5]
- Фольга мідна — холоднокатана: 0,05…0,1 мм (випускається тільки в твердому стані)
- Стрічки мідні — холоднокатані: 0,1…6 мм.
- Листи мідні — холоднокатані: 0,2…12 мм і гарячекатані: 3…25 мм (механічні властивості регламентуються до 12 мм).
- Плити мідні — гарячекатані: понад 25 мм (механічні властивості не регламентуються).
- Мідні труби загального призначення виготовляються холоднодеформованими (в м'якому, напівтверді і твердому станах) і пресованими (великих перерізів) за ДСТУ ГОСТ 617:2007[6].
Властивості міді
Хімічні властивості
Мідь — малоактивний метал, в електрохімічному ряду напруг вона стоїть правіше за водень. Вона не взаємодіє з водою, розчинами лугів, соляною і розведеною сірчаною кислотою. Проте в кислотах — сильних окислювачах (наприклад, у азотній і концентрованій сірчаній) — мідь розчиняється:
- (домішки Cu2S)
Чиста мідь має достатньо високу стійкість до корозії: продукти окиснення утворюють при звичайній температурі лише тонкий поверхневий шар . В сухому повітрі це оксиди міді (червоний Cu2O непомітний, чорний CuO призводить до потемніння), у вологій атмосфері, що містить вуглекислий газ мідь покривається зеленуватим нальотом основного карбонату міді:
В сполуках мідь може проявляти ступені окиснення +1, +2 і +3, з яких +2 — найбільш характерний і стійкий. Мідь(II) утворює стійкий оксид CuO і гідроксид Cu(OH)2. Цей гідроксид амфотерний, добре розчиняється у кислотах і в концентрованих лугах:
Солі міді (II) знайшли широке застосування в народному господарстві. Особливо важливим є мідний купорос — кристалогідрат сульфату міді(II) CuSO4.
Механічні властивості
Механічні властивості чистої міді у м'якому стані наступні[4]:
- умовна границя текучості σ0,2 = 70 МПа;
- границя міцності σв = 200 МПа;
- відносне видовження після руйнування при розтягування δ = 35…40 %;
- твердість за шкалою Брінелля 40 HB;
- модуль Юнга E = 110…128 МПа
- модуль зсуву G = 48 МПа.
Застосування

Мідь використовують з бронзової доби, часові рамки якого оцінюються від 4 тис. до 1 тис. років до н. е. Зокрема, в Україні виявлені старі Картамиські мідні копальні на Луганщині, які датуються XVI ст. до н. е.
Сучасне широке застосування міді пов'язане з її високою електропровідністю, хімічною стійкістю, пластичністю і здатністю утворювати сплави з багатьма металами: оловом (бронза), цинком (латунь), нікелем (мельхіор) і ін. Мідь використовується в різних галузях промисловості: електротехнічній (50 %), машинобудуванні (25 %), будівельній, харчовій і хімічній (25 %) галузях.
Використання чистої міді
Використовується у чистому вигляді у електротехніці, вирізняється високою електро- і теплопровідністю.
Більше половини міді, що добувається, використовується в електротехніці для виготовлення різних проводів, кабелів, струмопровідних частин електротехнічної апаратури. Для цього переважно використовується чистий метал (99,98…99.999 % Cu), що пройшов електролітичне рафінування.
Завдяки високій теплопровідності мідь — незамінний матеріал теплообмінників і холодильної апаратури. Крім цього, з міді виготовляють деталі хімічної апаратури та інструмент для роботи з вибухонебезпечними або легкозаймистими речовинами.
Широко застосовується мідь в гальванотехніці для нанесення мідних покриттів, одержання тонкостінних виробів складної форми, виготовлення кліше в поліграфії та ін.
Сплави на основі міді
Залежно від марки (складу) сплави можуть використовуватися в різних галузях техніки як конструкційні елементи (в тому числі у вигляді припоїв[7]), як матеріали з антифрикційними властивостями, із стійкістю до корозії або заданою електро- і теплопровідністю. Велике значення мають наступні мідні сплави:
- латунь — основна добавка цинк (Zn). Вона має жовтуватий колір. Позначається звичайна латунь буквою Л з цифрою, що вказує на процентний вміст у латуні міді, а все інше — цинк. Наприклад, Л62 (62 % міді). Латунь твердіша за мідь, вона ковка і в'язка, тому легко вальцюється в тонкі листи або виштамповується у найрізноманітніші форми. Недолік: вона з часом окислюється і чорніє. Домішки кремнію (Si), олова (Sn), алюмінію (Al) підвищують міцність, антифрикційні властивості й корозійну стійкість латуні на повітрі, у морській воді й атмосфері. Марганець додає жаростійкості, а залізо твердості. Свинцева латунь добре полірується, а домішка до алюмінієвої латуні миш'яку, нікелю й заліза підвищує її стійкість до кислот;
- бронза — сплави з різними елементами, головним чином металами — оловом, алюмінієм, берилієм (Be), свинцем (Pb), кадмієм (Cd) та іншими, крім цинку (Zn) і нікелю (Ni). Порівняно з латунню бронза міцніша, стійкіша до корозії, мають антифрикційні властивості. Позначають бронзу Бр, а далі йдуть елементи, які входять у її склад та їх процентний вміст (крім міді). Наприклад, БрОФ 8,0-0,3 містить 8 % олова й 0,3 % фосфору, решта — мідь. Із бронз виготовляють крани, вентилі, втулки навантажених підшипників тощо Берилієва бронза після загартовування, за твердістю й пружними властивостями перевершує високоякісну сталь, а кадмієві й хромисті бронзи мають високу тепло- і електропровідність;
- мідно-нікелеві сплави — (константан (МНМц 40-1,5), манганин (МНМц 3-12), куніаль (МНА 13-3), мельхіор (МНЖМц 30-0,8-1), нейзильбер («нове срібло»)(МНЦ 15-20)). Мідно-нікелеві сплави мають високу корозійну стійкість і особливі електричні властивості, які змінюються залежно від вмісту нікелю. Крім нікелю, до складу сплаву можуть входити й інші елементи.
З часів античності мідь використовувалась у складі монетних сплавів, які отримали особливе поширення у новітню добу. Це сплави: мідь-цинк-олово, мідь-алюміній мідь-нікель, бронза, латунь, мельхіор. Литі мідні зливки античної Греції та Риму представляють інтерес для нумізматики. Мідні монети, що чеканились як еквівалент срібним, мали особливо великі розміри та вагу, як, наприклад шведські мідні дошки-плоти чи мідні гроші. З появою розмінної монети мідні монети пристосувались до потреб грошового обігу.
Мідь у інших сплавах
Дюралюміній — є сплавом алюмінію, де основним легуючим елементом є мідь (вміст 4,4 %), а також, магній (1,5 %) та марганець (0,5 %).
У ювелірній справі часто використовуються сплави золота з міддю для збільшення міцності виробів при деформаціях і стійкості до стирання, так як чисте золото дуже м'який метал і не є стійким до цих механічних впливів.
Є сплави на основі міді, створені для імітації золота, що використовуються для виготовлення біжутерії (див., наприклад, абіссінське золото).
Мідь у хімічних сполуках
Мідний купорос (у природі зустрічається у вигляді мінералу халькантит, хімічна формула CuSO4 • 5Н2О) використовується як окремо в 1…2. так і в суміші із свіжогашеним вапном в 1…4 % концентрації (бордоська рідина) у сільському господарстві для боротьби з хворобами рослин. У промисловості мідний купорос використовується при виробництві штучних волокон, органічних барвників, мінеральних фарб, миш'якових хімікатів, для збагачення руди при флотації.
Оксиди міді (Cu2O, CuO) використовуються для отримання оксиду ітрію-барію-міді YBa 2 Cu 3O7-δ, який є основою для отримання високотемпературних надпровідників.
Оксид міді (іноді з додаванням оксиду барію або оксиду бісмуту для збільшення ємності) використовується як катод у мідно-окисидному гальванічному елементі (винайденому в 1882 році Лаландом) — хімічному джерелі електричного струму в якому анодом є цинк (рідше олово), а електролітом служить гідроксид калію.
Біологічна роль
Позитивний вплив

Мідь важливий елемент для всіх рослин і тварин. Відомо понад 50 білків та ферментів, у яких знайдено мідь. В основному мідь міститься в крові в складі білків плазми, які називаються церулоплазмінами. Поглинаючись у кишечнику мідь переноситься до печінки завдяки зв'язку із альбуміном. Мідь сприяє росту і розвитку, бере участь у кровотворенні, імунних реакціях. Мідь потрібна для перетворення заліза організму в гемоглобін. У крові більшості молюсків і членистоногих мідь використовується замість заліза для транспортування кисню.
Відзначено[8] на основі досліджень, що сполуки міді в формі сультату у певних дозах діють бактеростатично, протигрибково, антитоксично, у курчат стимулюють ріст, а у курей несучість і якість яєць, посилють біотрансформацію білків корму в білки тіла, підвищують загальну резистентність організму сільськогосподарської птиці.
Вважається, що мідь і цинк конкурують один з одним у процесі засвоювання в травній системі, тому надлишок одного з цих елементів в їжі може викликати недостачу іншого елемента. Здоровій дорослій людині необхідне надходження міді у кількості 1…2 мг щоденно[9]. Захворювання, що викликаються дефіцитом міді: анемія, водянка, дерматози, затримка росту, депігментація волосся, часткове облисіння, втрата апетиту, сильне схуднення, зниження рівня гемоглобіну, атрофія серцевого м'яза.
Негативний вплив
Надлишкове надходження міді в організм веде до відкладення її в тканинах (хвороба Вільсона). При надходженні в організм людини надлишкової кількості міді може виникнути бронхіальна астма, захворювання нирок, захворювання печінки, а також просто інтоксикація організму. Симптоми передозування[9]:
- безсоння, дратівливість, депресія;
- м'язові болі, анемія;
- подразнення слизових оболонок, запальні захворювання;
- погіршення пам'яті;
- розлади шлунково-кишкового тракту.
Цікаві факти
- Індіанці культури Чонос (Еквадор) ще у XV—XVI століттях виплавляли мідь із вмістом 99,5 % і використовували її як монети у вигляді сокирок розмірами сторін по 2 мм і 0,5 мм завтовшки. Ця монета ходила по всьому західному узбережжю Південної Америки, в тому числі і в державі інків[10].
- У Японії мідним трубопроводам для газу в будинках присвоєно статус «сейсмостійких».
- Інструменти, виготовлені з міді і її сплавів, не утворюють іскор при ударах, а тому застосовуються там, де існують особливі вимоги безпеки (вогненебезпечні, вибухонебезпечні виробництва).
- Польські вчені встановили, що в тих водоймах, де присутня мідь, коропи відрізняються великими розмірами. У ставках чи озерах, де міді немає, швидко розвивається грибок, який вражає коропів[11].
Примітки
- ↑ Етимологічний словник української мови у 7 томах. К.: Наукова думка, 1982—2009.
- ↑ Этимологический словарь русского языка. — М.: Прогресс М. Р. Фасмер 1964—1973.
- ↑ ГОСТ 859—2001 Мідь. Марки.
- ↑ а б ДСТУ ГОСТ 1535:2007 Прутки мідні. Технічні умови.
- ↑ ДСТУ ГОСТ 1173:2007 Фольга, стрічки, листи та плити мідні. Технічні умови.
- ↑ ДСТУ ГОСТ 617:2007 Труби мідні та латунні круглого перерізу загальної призначеності. Технічні умови.
- ↑ ГОСТ 23137-78. Припої мідно-цинкові. Марки (російська) . Москва: Видавництво стандартів. 1988. с. 2.
- ↑ Горобець А. І. Використання різних сполук і рівнів міді в годівлі птиці.
- ↑ а б Ми і медицина. Мідь (Cu)
- ↑ Espinoza Soriano, Waldemar. Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
- ↑ Интересные факты о меди и медных трубах
Див. також
- Сплави міді
- Мідна промисловість
- Мідні руди
- Мідно-молібденові руди
- Мідянисті пісковики і сланці
- Мідь самородна
- Ресурси і запаси міді
Література
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім.. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Горбовий П. М., Загричук Г. Я., Фальфушинська Г. І. Основи хімії елементів. — Тернопіль: В-во Карп'юка, 2001. — 276с.
- Григор'єва В. В. та ін. Загальна хімія. — К.: Вища школа., 1991.-431 с.
- Романова Н. В. Загальна та неорганічна хімія. — К.: Перун., 1998.-480 с.
- Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., испр./Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; Под ред. Р. А. Лидина. — М.: Химия, 2000. 480 с.: ил. — ISBN 5-7245-1163-0.

![{\displaystyle \mathrm {2[Cu(H_{2}O)_{2}]^{+}+2H_{2}O\longrightarrow [Cu(H_{2}O)_{6}]^{2+}+Cu} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fac8b1e10dd0e94e1afcf09ec74477241c60059f)







![{\displaystyle \mathrm {CuO+2NaOH+H_{2}O{\xrightarrow {boiling}}Na_{2}[Cu(OH)_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d8b899f070dcf1a95ee31a5a56b7bcc5a151bdf)