Антитіла: відмінності між версіями
| [перевірена версія] | [перевірена версія] |
ReAl (обговорення | внесок) |
Bunyk (обговорення | внесок) |
||
| Рядок 5: | Рядок 5: | ||
== Класифікація == |
== Класифікація == |
||
[[Файл:2221 Five Classes of Antibodies new.jpg|left|thumb |
[[Файл:2221 Five Classes of Antibodies new.jpg|left|thumb]] |
||
Відомо 5 класів імуноглобулінів людини: [[Імуноглобуліни класу G|G]], М, A, D, Е ([[Імуноглобуліни класу G|IgG]], IgM, IgA, IgD і IgE). |
Відомо 5 класів імуноглобулінів людини: [[Імуноглобуліни класу G|G]], М, A, D, Е ([[Імуноглобуліни класу G|IgG]], IgM, IgA, IgD і IgE). |
||
| Рядок 12: | Рядок 12: | ||
[[Імуноглобуліни класу G|Імуноглобулін IgG]] має підкласи: [[Імуноглобуліни класу G|IG1]], [[Імуноглобуліни класу G|IG2]], [[Імуноглобуліни класу G|IG3]] і [[Імуноглобуліни класу G|IG4]] знайдені в сироватці крові в різних концентраціях. Їх молекули побудовані з двох ідентичних легких (молекулярна маса 22000 Да) і двох ідентичних важких (молекулярна маса 55 000-70 000 Да) поліпептидних ланцюжків, скріплених [[дисульфідний зв'язок|дисульфідними зв'язками]]. При розщеплюванні протеолітичними ферментами (наприклад, [[папаїн]]ом) молекула імуноглобуліну розпадається на три частини: два однакові фрагменти (позначаються Fab), кожен з яких зберігає здібність до пов'язання з [[антиген]]ом, і фрагмент (позначається Fc), що сприяє проходженню молекули імуноглобуліну через [[біологічні мембрани]]. Всі три фрагменти сполучені короткими гнучкими ділянками, розташованими в середині важкого ланцюжка. |
[[Імуноглобуліни класу G|Імуноглобулін IgG]] має підкласи: [[Імуноглобуліни класу G|IG1]], [[Імуноглобуліни класу G|IG2]], [[Імуноглобуліни класу G|IG3]] і [[Імуноглобуліни класу G|IG4]] знайдені в сироватці крові в різних концентраціях. Їх молекули побудовані з двох ідентичних легких (молекулярна маса 22000 Да) і двох ідентичних важких (молекулярна маса 55 000-70 000 Да) поліпептидних ланцюжків, скріплених [[дисульфідний зв'язок|дисульфідними зв'язками]]. При розщеплюванні протеолітичними ферментами (наприклад, [[папаїн]]ом) молекула імуноглобуліну розпадається на три частини: два однакові фрагменти (позначаються Fab), кожен з яких зберігає здібність до пов'язання з [[антиген]]ом, і фрагмент (позначається Fc), що сприяє проходженню молекули імуноглобуліну через [[біологічні мембрани]]. Всі три фрагменти сполучені короткими гнучкими ділянками, розташованими в середині важкого ланцюжка. |
||
Гнучкість дозволяє молекулам імуноглобулінів оптимально приєднуватися до антигенів, що мають різну просторову будову. Ділянки молекули, відповідальні за зв'язування з антигеном (активний центр), утворені N-кінцевими (несуть на кінці аміногрупу -NH2) відрізками важких і легких ланцюжків. Послідовність [[амінокислота|амінокислот]] в цих відрізках специфічна для кожного IgG і називається варіабельною ділянкою, в інших частинах ланцюжків вона майже не варіює. Варіабельна ділянка формується завдяки [[V(D)J-рекомбінація|V(D)J-рекомбінації]] та |
Гнучкість дозволяє молекулам імуноглобулінів оптимально приєднуватися до антигенів, що мають різну просторову будову. Ділянки молекули, відповідальні за зв'язування з антигеном (активний центр), утворені N-кінцевими (несуть на кінці аміногрупу -NH2) відрізками важких і легких ланцюжків. Послідовність [[амінокислота|амінокислот]] в цих відрізках специфічна для кожного IgG і називається варіабельною ділянкою, в інших частинах ланцюжків вона майже не варіює. Варіабельна ділянка формується завдяки [[V(D)J-рекомбінація|V(D)J-рекомбінації]] та [[Соматичний гіпермутагенез|соматичному гіпермутагенезі]] лімфоцитів<ref name="Evo of Im">{{Cite journal |author = [[Кунін Євген Вікторович|Eugene V. Koonin]] & Mart Krupovic |title = Evolution of adaptive immunity from transposable elements combined with innate immune systems |journal = [[Nature reviews. Genetics]] |volume = 16 |issue = 3 |pages = 184–192 |year = 2015 |month = March |doi = 10.1038/nrg3859 |pmid = 25488578 }}</ref>. |
||
Інші класи імуноглобулінів ([[реагіни]]<ref>[http://webmed.com.ua/ua/zdorove_ot_a_do_ya/diagnostika/analizy_krovi/infekcionnaya_panel/urogenitalnye_infekcii/kardiolipinovye_antitela_vdrl Кардіоліпінові антитіла]</ref>) відрізняються будовою важких ланцюжків. IgM — еволюційно найдавніші імуноглобуліни; вони синтезуються на перших стадіях імунної реакції. Їх молекули складаються з 5 мономерних субодиниць, кожна з яких нагадує молекулу IgG. Для IgA характерна здатність проникати в різні [[Секрет (фізіологія)|секрети]] (зокрема [[слина|слину]], [[молозиво]], [[кишковий сік]]), де вони існують в полімерній формі. Антитіла, що беруть участь в [[алергія|алергічних]] реакціях, відносяться до IgE. |
Інші класи імуноглобулінів ([[реагіни]]<ref>[http://webmed.com.ua/ua/zdorove_ot_a_do_ya/diagnostika/analizy_krovi/infekcionnaya_panel/urogenitalnye_infekcii/kardiolipinovye_antitela_vdrl Кардіоліпінові антитіла]</ref>) відрізняються будовою важких ланцюжків. IgM — еволюційно найдавніші імуноглобуліни; вони синтезуються на перших стадіях імунної реакції. Їх молекули складаються з 5 мономерних субодиниць, кожна з яких нагадує молекулу IgG. Для IgA характерна здатність проникати в різні [[Секрет (фізіологія)|секрети]] (зокрема [[слина|слину]], [[молозиво]], [[кишковий сік]]), де вони існують в полімерній формі. Антитіла, що беруть участь в [[алергія|алергічних]] реакціях, відносяться до IgE. |
||
Версія за 11:06, 13 жовтня 2017
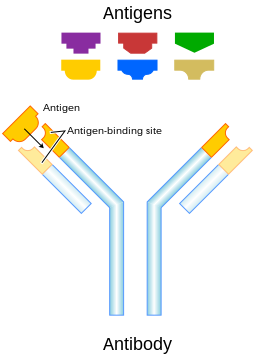
Протитіла́, антитіла́ або імуноглобулі́ни (Ig) — білкові сполуки, які організм хребетних тварин виробляє у відповідь на антигени, чужорідні речовини, що потрапляють до крові, лімфи або тканин організму з метою знищити або нейтралізувати потенційно небезпечні з них — бактерії, віруси, отрути та деякі інші речовини. Імуноглобуліни містяться в сироватці крові і утворюють групу близьких по структурі глікопротеїдів.
Класифікація

Відомо 5 класів імуноглобулінів людини: G, М, A, D, Е (IgG, IgM, IgA, IgD і IgE).
Найповніше вивчені імуноглобуліни класу G (IgG), вони ж є і найпоширенішими.
Імуноглобулін IgG має підкласи: IG1, IG2, IG3 і IG4 знайдені в сироватці крові в різних концентраціях. Їх молекули побудовані з двох ідентичних легких (молекулярна маса 22000 Да) і двох ідентичних важких (молекулярна маса 55 000-70 000 Да) поліпептидних ланцюжків, скріплених дисульфідними зв'язками. При розщеплюванні протеолітичними ферментами (наприклад, папаїном) молекула імуноглобуліну розпадається на три частини: два однакові фрагменти (позначаються Fab), кожен з яких зберігає здібність до пов'язання з антигеном, і фрагмент (позначається Fc), що сприяє проходженню молекули імуноглобуліну через біологічні мембрани. Всі три фрагменти сполучені короткими гнучкими ділянками, розташованими в середині важкого ланцюжка.
Гнучкість дозволяє молекулам імуноглобулінів оптимально приєднуватися до антигенів, що мають різну просторову будову. Ділянки молекули, відповідальні за зв'язування з антигеном (активний центр), утворені N-кінцевими (несуть на кінці аміногрупу -NH2) відрізками важких і легких ланцюжків. Послідовність амінокислот в цих відрізках специфічна для кожного IgG і називається варіабельною ділянкою, в інших частинах ланцюжків вона майже не варіює. Варіабельна ділянка формується завдяки V(D)J-рекомбінації та соматичному гіпермутагенезі лімфоцитів[1].
Інші класи імуноглобулінів (реагіни[2]) відрізняються будовою важких ланцюжків. IgM — еволюційно найдавніші імуноглобуліни; вони синтезуються на перших стадіях імунної реакції. Їх молекули складаються з 5 мономерних субодиниць, кожна з яких нагадує молекулу IgG. Для IgA характерна здатність проникати в різні секрети (зокрема слину, молозиво, кишковий сік), де вони існують в полімерній формі. Антитіла, що беруть участь в алергічних реакціях, відносяться до IgE.
Імуноглобуліни синтезуються лімфатичними клітинами. При деяких ураженнях цих клітин в крові та сечі накопичується велика кількість так званих мієломних імуноглобулінів, які, на відміну від імуноглобулінів здорового організму, однорідні по складу.
За характером впливу на антиген розрізняють:
- аглютиніни — антитіла, що зумовлюють аглютинацію мікроорганізмів;
- лізини та опсоніни — антитіла, що сприяють їх руйнуванню;
- преципітини — антитіла, що осаджують білкові речовини у розчинах; антитоксини та інші.
Застосування в медицині


При верифікації типу клітин, їх органел або, навіть, молекул використовують антитіла. Антитіла широко використовують з діагностичною метою в медицині: на принципі реакції антиген-антитіло засновані методи імуносцинтиграфії, імуногістохімії, вестерн-блоту тощо.
Для лікування або профілактики деяких інфекційних хвороб (наприклад, правець, сказ тощо) застосовують лікувальні алогенні чи гетерогенні імуноглобуліни, які отримують введенням деяких збудників або токсинів донорам — людям або тваринам, спричиняючи, таким чином, в них імунну реакцію, яка призводить до виробляння антитіл. Після цього в них беруть кров, яку очищують від баласту і готують стерильний розчин, що містить велику кількість захисних антитіл.
Див. також
- Поліклональні антитіла
- Імунітет
- Імунологія
- Імуногенетика
- фагоцитоз
- сироватка крові
- антиген
- антигени лейкоцитів людини(HLA)
- Імунна реакція
- імунний фактор
Примітки
- ↑ Eugene V. Koonin & Mart Krupovic (March 2015). Evolution of adaptive immunity from transposable elements combined with innate immune systems. Nature reviews. Genetics. 16 (3): 184—192. doi:10.1038/nrg3859. PMID 25488578.
- ↑ Кардіоліпінові антитіла
Література
- Гауровиц Ф., Иммунохимия и биосинтез антител, пер. с англ., М., 1969
- Незлин Р. С., Биохимия антител, М., 1966
- Портер Р., Структура антител, в сборнике: Молекулы и клетки, в. 4, пер. с англ., М., 1969
- Kabat Е. A., Structural concepts in immunology and immunochemistry, N. Y., 1968.
Посилання
| |||||||||||||||||||||||||
| Це незавершена стаття про білки. Ви можете допомогти проєкту, виправивши або дописавши її. |
| Це незавершена стаття з імунології. Ви можете допомогти проєкту, виправивши або дописавши її. |