Триптофан
| Триптофан | |
|---|---|
| |
| Ідентифікатори | |
| Абревіатури | Trp,W |
| Номер CAS | 73-22-3 |
| Номер EINECS | 200-795-6 |
| DrugBank | 00150 |
| KEGG | D00020 і C00078 |
| Назва MeSH | D12.125.072.050.850 і D12.125.142.875 |
| ChEBI | 16828 |
| Код ATC | N06AX02 |
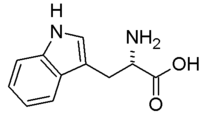
| SMILES | C1=CC=C2C(=C1)C(=CN2)CC(C(=O)O)N[1] |
| InChI | InChI=1S/C11H12N2O2/c12-9(11(14)15)5-7-6-13-10-4-2-1-3-8(7)10/h1-4,6,9,13H,5,12H2,(H,14,15)/t9-/m0/s1 |
| Номер Бельштейна | 86197 |
| Номер Гмеліна | 51434 |
| Властивості | |
| Молекулярна формула | C11H12N2O2 |
| Молярна маса | 204,23 г/моль |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Триптофа́н (β-(β-індоліл)-α-амінопропіонова кислота[2]) — незамінна амінокислота. Кодується тільки одним кодоном — UGG. L-стереоізомер входить до складу гамаглобулінів, фібриногену, казеїну та інших білків. Триптофан є провітаміном.
Загальний опис[ред. | ред. код]
Триптофан був уперше виділений Ф. Гопкінсом і С. Коулом у 1901 році з казеїну. Унаслідок різноманіття пов'язаних з триптофаном метаболічних реакцій і продуктів він був однією з перших амінокислот, що були віднесені до незамінних. Дослідження, проведені на представниках роду Neurospora[en] (червона хлібна пліснява) і на бактеріях Pseudomonas, а також виділення метаболітів триптофану із сечі, надали неоціненну допомогу в з'ясуванні деталей його метаболізму[3].
Триптофан існує в оптично активних L- і D-, та рацемічній DL-формі. Добре розчинний у воді, обмежено — у спирті, не розчинний в діетиловому ефірі. Це гетероциклічна амінокислота й одна з найважливіших амінокислот із широким спектром дії. Триптофан використовують клітини ссавців для біосинтезу нікотинової кислоти (вітамін РР) і серотоніну, для створення м'язових білків, білків антитіл імунної системи, він бере участь у синтезі мелатоніну, є необхідним будівельним матеріалом для організму, нормалізує роботу нервової системи і травлення, має антидепресантну дію, підвищує опірність стресам, поліпшує сон. Недостатня кількість триптофану викликає погіршення стану шкіри й волосся, анемію, викликає безсоння.
Біосинтез триптофану в мікроорганізмів і рослин здійснюється конденсацією амінокислоти серину з індолом, що каталізується ферментом триптофансинтазою [en].
 Біосинтез триптофану в кишкової палички використовували для доказу колінеарності гену і поліпептидного ланцюга, який цим геном кодується, коли розміщення кожної амінокислоти в поліпептидному ланцюгу визначається окремою ділянкою гену.
Біосинтез триптофану в кишкової палички використовували для доказу колінеарності гену і поліпептидного ланцюга, який цим геном кодується, коли розміщення кожної амінокислоти в поліпептидному ланцюгу визначається окремою ділянкою гену.
В організмах тварин L-триптофан піддається складним перетворенням, утворюючи низку життєво важливих сполук: із продуктів його розпаду в ссавців утворюється нікотинова кислота і серотонін, у комах — пігменти очей (омохроми[en]), у рослин — гетероауксин, індикан та низку алкалоїдів.
Метаболізм[ред. | ред. код]

Під час нормального розпаду в організмі 6 із 11 атомів вуглецю триптофану включаються в цикл трикарбонових кислот через ацетил- і ацетоацетилкофермент, а решта 5 перетворюються в CO2. Під час процесів гниття в товстій кишці з триптофану утворюються скатол та індол.
При введенні з їжею 14C-триптофану значна частина ізотопу включається до складу білків, однак істотна частина виявляється в сечі в складі різних катаболітів. Атоми вуглецю бічного ланцюга й ароматичного кільця можуть цілком переходити в амфіболічні інтермедіати при трансформації триптофану кінуренін-антранілатним шляхом[4], який відіграє важливу роль у деградації триптофану та його перетворенні в нікотинамід.
Триптофаноксигеназа (триптофанпіролаза) каталізує розкриття індольного кільця зі включенням двох атомів молекулярного кисню в N-формілкінуренін, що утворюється в результаті. Цей фермент є металопротеїном, що містить залізопорфірин. Синтез N-формілкінуреніну в печінці індукується адренокортикостероїдами і триптофаном. Значна частина синтезованого ферменту перебуває в латентній формі і потребує активації. Триптофан стабілізує оксигеназу відносно протеолітичних ферментів. Вона інгібується за принципом зворотного зв'язку похідними нікотинової кислоти, в тому числі NADPH.
Гідролітичне видалення формільної групи N-формілкінуреніну каталізується в печінці ссавців кінуренінформілазою. Гідроліз H218O приводить до включення атома 18O у форміат, що утворюєся. Фермент також каталізує аналогічні реакції з різними арилформіламінами.
Продуктом реакції, каталізованої кінуренінформілазою, є кінуренін. Він може бути дезамінованим у результаті реакції переамінування з переносом аміногрупи бічного ланцюга на α-кетоглутарат. Утворена при цьому кетопохідна проходить спонтанну циклізацію, перетворюючись в кінуренову кислоту. Ця сполука є побічним продуктом катаболізму кінуреніну і не належить до катаболітів, які утворюються на головному шляху. Подальший хід метаболізму кінуреніну включає його перетворення в 3-гідроксикінуренін і далі в 3-гідроксиантранілат. Гідроксилювання відбувається за участі молекулярного кисню і здійснюється в NADPH-залежній реакції гідроксилювання, аналогічної реакції гідроксилювання фенілаланіну.
Кінуренін і гідроксикінуренін перетворюються в гідроксиантранілат за участі піридоксальфосфат-вмісного ферменту кінуренінази. Нестача вітаміну B6 веде до часткової втрати здатності до катаболізму цих кінуренінових похідних. У позапечінкових тканинах вони перетворюються в ксантуренат. Цей за норми відсутній катаболіт з'являється в сечі людини, мавп і щурів при недостатній кількості в їжі вітаміну B6. В цих умовах введення наднормових кількостей триптофану призводить до екскреції ксантуренату зі сечею.
У багатьох тварин перетворення триптофану в нікотинову кислоту робить необов'язковим надходження цього вітаміну з їжею. У щурів, кроликів, собак і свиней триптофан з їжі може цілком його замінити. У людини, а також у низки тварин, надлишкове споживання триптофану з їжею підвищує екскрецію зі сечею похідних нікотинової кислоти (наприклад, N-метилнікотинаміду). При недостатності вітаміну B6 порушення утворення з триптофану нікотинової кислоти може спричинити порушення синтезу піридинових нуклеотидів — NAD+ і NADP+. Якщо ввести в організм достатню кількість нікотинової кислоти, нормальний синтез піридинових нуклеотидів відновлюється навіть за відсутності вітаміну B6.
Функції в організмі людини[ред. | ред. код]
Триптофан регулює функцію ендокринної системи, що попереджає анемію, регулює кров'яний тиск, відповідає за синтез гемоглобіну. Споживання триптофану змушує гіпофіз виробляти більшу кількість гормону росту. Припускають, що ця амінокислота стимулює секрецію інсуліну, що у свою чергу активує синтез жирних кислот у печінці.
Особливе значення ця амінокислота має у фармакології, де вона та її похідні застосовуються як інгредієнти багатьох лікарських препаратів. При таких захворюваннях, як рак, туберкульоз та діабет триптофан сприяє нормальному функціонуванню різних систем організму. Нестача його веде до розвитку пелагри, погіршення стану зубів, помутніння рогівки ока, катаракти.
Під час вагітності підвищується необхідність жіночого організму у таких амінокислотах як триптофан і лізин, а для немовлят — триптофан та ізолейцин.
Триптофан, як попередник серотоніну, має антидепресантну дію на організм. Сприяє зняттю гіперактивності та нав'язливих станів у дітей, тривожності перед менструацією у жінок, фіброміалгії і синдрому хронічної втоми. Як попередник мелатоніну, сприяє хорошому засинанню і нормальному сну як у ранньому, так і у літньому віці.
Під час регенеративних процесів збільшується потреба організму у незамінних амінокислотах.
Триптофан бере участь у виправленні помилок процесу подвоєння ДНК. Разом з лізином вони утворюють трипептид лізин—триптофан—лізин, який виправляє помилки, котрі виникають при подвоєнні ДНК. Ця властивість триптофану має першорядне значення під час вагітності, та для запобігання утворення ракових клітин.
Джерела надходження[ред. | ред. код]
Триптофан не синтезується організмом людини, а надходить з їжею. Добова потреба дорослої людини в ній становить 0,25 г (3,5 мг/кг маси тіла[5]), дітей до 7 років — 1 г.
| Продукт | Білок [г/100 г їжі] |
Триптофан [g/100 g їжі] |
Триптофан/Білок [%] |
|---|---|---|---|
| сухий яєчний білок | |||
| спіруліна, сушена | |||
| атлантична тріска, сушена | |||
| соя, сира | |||
| гарбузове насіння | |||
| сир Пармезан | |||
| кунжут | |||
| сир чеддер | |||
| соняшникове насіння | |||
| свинина | |||
| індичка | |||
| курятина | |||
| яловичина | |||
| лосось | |||
| баранина | |||
| атлантичний окунь | |||
| яйця | |||
| пшеничне борошно | |||
| шоколад | |||
| молоко | |||
| білий рис | |||
| вівсянка (приготована) | |||
| картопля | |||
| банани |
Порушення метаболізму[ред. | ред. код]
Основний шлях метаболізму триптофану приводить до синтезу аміду нікотинової кислоти, що відіграє дуже важливу роль у життєдіяльності організму, будучи простетичною групою низки окисних ферментів — нікотинамідаденіндинуклеотиду (НАД) і його відновленої форми нікотинамідаденін-динуклеотидфосфату (НАДФ). Тому при недостатності нікотинової кислоти та її аміду порушуються багато обмінних реакцій, а при значному дефіциті цих речовин розвивається пелагра. Порушення обміну триптофану може проявитися також у зміні кількості утвореного з нього серотоніну[8]. Ураження нирок викликається підвищеною екскрецією метаболітів триптофану. Вроджена відсутність триптофан-піролази (ферменту, що окислює триптофан) призводить до розумової відсталості. Порушення обміну триптофану у людини може сигналізувати про низку захворювань, як то: туберкульоз, рак, діабет.
Гіпертриптофанемія[ред. | ред. код]
- Основна стаття: Hypertryptophanemia[en]
Синдром Хартнапа[ред. | ред. код]
Синдром Хартнапа[en] — спадкове захворювання, що характеризується пелагроподібним дерматитом, періодичними нападами мозочкової атаксії, гіпераміноацидурією та підвищеною нирковою екскрецією індолацетату (α-N-[індол-3-ацетил]глутамін) і триптофану. У деяких дітей виявляється розумова недостатність.
Успадковується за автосомно-рецесивною ознакою. Синдром Хартнапа зумовлений порушенням транспорту триптофану на рівні клітин слизової оболонки кишці і проксимального відділу ниркових канальців. Це приводить до підвищеного виділення триптофану зі сечею і зниження його абсорбції у кишці. Накопичення триптофану у кишці сприяє розкладанню його бактеріями й утворенню великої кількості індольних сполук, що всмоктуються у кров і у більшій кількості виділяються зі сечею. Підвищення вмісту цих сполук у крові, ймовірно, обумовлює підвищену чутливість шкірних покривів до дії сонячних променів. Виведення ж значної кількості індикану нирками, у зв'язку з ушкодженням проксимальних канальців, викликає гіпераміноацидурію.
Характерним є пелагроподобне ураженням шкіри, що характеризується появою на відкритих ділянках тіла гіперемії, лущення. Ці зміни підсилюються літньої пори під впливом сонячних променів. На шкірі, найчастіше в ділянці носа, виявляються атрофічні ділянки як результат світлової травми, тому хворому рекомендують уникати інсоляції.
При лікуванні застосовують вітаміни В6, РР і B1. У періоди загострення — обмеження вживання білків, проведення цукрово-фруктових днів, антибактеріальні препарати для зменшення утворення індольних похідних за рахунок бактеріального розкладання триптофану.
Синдром Тада[ред. | ред. код]
Синдром Тада — спадкове захворювання з автосомно-рецесивним типом успадковування. Вперше описаний К. Тада в 1963 році. Під час цього захворювання спостерігається недостатність ферменту триптофанпіролідази, який каталізує перетворення триптофану в кінуренін. Клінічно виявляється подібність зі синдромом Хартнапа, відрізняється від нього більшою виразністю враження ЦНС і нанізмом. Лабораторні дані також ідентичні, за винятком рівня триптофану в крові, що при даному синдромі завжди підвищений. Порушення пов'язані з ендогенним дефіцитом нікотинової кислоти й надлишком індольних сполук. Синдром Тада спричиняє глибоку розумову відсталість, нанізм та мозочкову атаксію.
Індиканурія[ред. | ред. код]
Захворювання спричиняється порушенням всмоктування триптофану в кишці з утворенням надлишкової кількості індолу, який всмоктується, окислюється, сульфатується і виділяється у формі індикану. Останній окислюється під дією повітря до голубого індикану, який забарвлює пелюшки хворої дитини в синій колір. При індиканурії спостерігається гіперкальциємія, нефрокальциноз, періодична гіпертермія.
Синдром Прайса[ред. | ред. код]
Генетичний дефект кінуренінгідроксилази. Спостерігається надлишкове виділення зі сечею кінуреніну через заблокованість ферменту. Головний прояв синдрому Прайса — склеродермія.
Флуоресценція[ред. | ред. код]
Триптофан має найсильнішу серед 20 головних природних амінокислот флуоресценцію. Поглинаючи світло з довжиною хвилі (на піці) 280 нм, триптофан сольватохромно випромінює в діапазоні 300—350 нм. Цей ефект часто використовується в дослідженнях біофізики білків. Окрім того взаємодія з нуклеїновими основами часто призводить до падіння інтенсивності флюоресценції («quenching»), що дозволяє спостерігати роль амінокислоти в протеїн—ДНК взаємодіях.
У масовій культурі[ред. | ред. код]
- У документальному фільмі «Світ згідно з Монсанто» (World According to Monsanto) триптофан пов'язується зі синдромом еозинофілії-міалгії[en].
Примітки[ред. | ред. код]
- ↑ L-tryptophan
- ↑ http://bse.sci-lib.com/article112229.html
- ↑ Д. П. Бойків, Т. І. Бондарчук, О. Л. Іванків — Клінічна біохімія. Підручник. За ред. О. Я. Склярова. — К.: Медицина, 2006. — 432 с.
- ↑ http://medbiol.ru/medbiol/biochem/reactions/kataminsuc.htm Катаболизм аминокислот, образующих ацетил-CoA: метаболическая карта
- ↑ Березов Т. Т., Коровкин Б. Ф. — Биологическая химия. — М.: Медицина, 1983. — 752 с.
- ↑ Joanne Holden, Nutrient Data Laboratory, Agricultural Research Service. USDA National Nutrient Database for Standard Reference, Release 22. United States Department of Agriculture. Архів оригіналу за 25 червня 2013. Процитовано 29 листопада 2009.
- ↑ Rambali B, Andel I van, Schenk E, Wolterink G, Werken G van de, Stevenson H, Vleeming W (2002). [The contribution of cocoa additive to cigarette smoking addiction] (PDF). RIVM (report 650270002/2002).- The National Institute for Public Health and the Environment (Netherlands)
- ↑ Петрик О. І., Валецька Р. О. — Основи загальної патології. — Львів, 1996—228 с.
Посилання[ред. | ред. код]
- ТРИПТОФАН //Фармацевтична енциклопедія
- Екзогенні амінокислоти // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
| |||||||||||
|