Старіння
| Старіння | |
| Код ICPC 2 | P05 |
|---|---|
| | |

Старіння — процес поступового руйнування і втрати важливих функцій організму або його частин, зокрема здатності до розмноження і регенерації.[джерело?] Внаслідок цього організм стає менш пристосованим до умов навколишнього середовища, зменшує свою здатність боротися із хижаками та хворобами. Явище старіння у тій чи іншій мірі спостерігається практично у всіх живих організмів. Термін «старіння» також може використовуватися і для опису руйнування неживих систем, і для опису соціальних ефектів старіння людини. Наука, що вивчає старіння, називається геронтологією; її галузь, що має справу з біологічними ефектами старіння — біогеронтологією[джерело?].
Старіння різних організмів[ред. | ред. код]
Старіння та розмноження[ред. | ред. код]
Розмноження — істотна функція життя організмів: усі інші життєві процеси, зокрема старіння і смерть, адаптовані до його потреб. Для розуміння процесу старіння важливо підкреслити відмінність між одноплідними та багатоплідними стратегіями розмноження. Одноплідні організми розмножуються за допомогою єдиного акту розмноження протягом життя організму. Більшість одноплідних організмів — однорічні та дворічні рослини, але серед них багато комах і кілька хребетних тварин, зокрема горбуша та вугор. Багатоплідні організми, з іншого боку, розмножуються періодично протягом діапазону статевої зрілості, який зазвичай складає велику частину життя.
Одноплідні організми[ред. | ред. код]
У одноплідних форм розмноження має місце під кінець життєвого періоду, після якого організм проходить через стадію дуже швидкого старіння, яке приводить до смерті організму. У рослин фаза старіння зазвичай є складовою частиною відтворного процесу, важливою для його завершення. Розповсюдження насіння, наприклад, супроводжується процесами визрівання, падіння плодів та висихання насіння — процесів, невіддільних від процесу старіння рослини. Це швидке старіння викликається за допомогою певних гормонів, рівень яких змінюється залежно від стану розвитку рослини та екологічних умов. Якщо, наприклад, запобігти виділенню гормону росту рослин — ауксину — експериментальними засобами, рослина живе довше і проходить через нетипове для неї повільне старіння.
Подібна картина старіння спостерігається і в деяких комах, які вирізняються двома чіткими стратегіями адаптивного забарвлення: захисне забарвлення, за допомогою якого комахи маскуються від потенційних хижаків, та відлякуюче забарвлення, яке зазвичай вказує на отруйність комахи. Ці два приклади адаптації мають різні оптимальні стратегії виживання видів: комахи з захисним забарвленням вмирають щонайшвидше після завершення розмноження, тим самим скорочуючи можливість для хижаків навчитися розпізнавати їх,— тоді як комахи з відлякуючим забарвленням живуть дуже довго після розмноження, збільшуючи можливість хижаків запам'ятати їх. Обидві стратегії адаптацій знайдені серед представників родини метеликів-сатурній, на прикладі яких було показано, що тривалість їхнього життя після розмноження контролюється гормональною системою, яка також контролює долю часу, що комахи проводять в польоті: метелики з захисним забарвленням проводять більше часу в польоті, виснажують себе і швидко вмирають, тоді як метелики з відлякуючим забарвленням літають менше, зберігають енергію, і в результаті — живуть довше[1].
Ці приклади ілюструють випадок, коли в одноплідних форм, яким повна сила і функціональність потрібні фактично до кінця життя, старіння проходить дуже швидко і пов'язане зі завершенням процесу розмноження, та часто активно управляється відносно простими гормональними механізмами, які можуть розвиватися під дією природного відбору. Такі специфічні генетично контрольовані процеси старіння — є зразком запрограмованого закінчення життя, які проявляються, коли таке старіння надає перевагу для виживання молоді. Проте в інших випадках швидке старіння одноплідних організмів є результатом виснажування організмів, більше не потрібних після розмноження.
Багатоплідні організми[ред. | ред. код]

Багатоплідні форми включають більшість хребетних тварин, більшість довгоживучих комах, ракоподібних і павуків, головоногих та черевоногих молюсків, та довголітні рослини. На відміну від одноплідних форм, багатоплідним організмам не потрібно виживати до кінця їхньої відтворної фази (фази розмноження) для того, щоб розмноження пройшло успішно, і середня тривалість життя відносно періоду розмноження дуже значно змінюється у різних особин та залежно від виду: маленькі гризуни і дикі птахи виживають в середньому тільки від 10 до 20 відсотків їхнього потенційного періоду розмноження, тоді як кити, слони, мавпи та інші великі ссавці в природних умовах виживають більш ніж 50 відсотків своїх періодів розмноження, і часто навіть переживають його.
У багатоплідних організмів старіння має поступовий характер: без очевидних специфічних системних або екологічних механізмів, які б ініціювали цей процес. Старіння перш за все проявляється як зниження можливостей організму до розмноження. У видів, які досягають фіксованого розміру тіла, зниження можливостей до розмноження починається досить рано — і прискорюється із віком. У великих плазунів, які досягають статевої зрілості ще маючи невеликий розмір і продовжують рости протягом довгого відтворного періоду, число відкладених яєць збільшується віком з протягом досить довгого періоду, але кінець кінцем зрівнюється і поступово знижується. Відтворний період у таких випадках коротший ніж тривалість життя.
Ще однією особливістю багатоплідних організмів є залежність швидкості процесу старіння від здатності розмножатися та від можливостей виживання потомства — найплодовитіші організми старіють набагато швидше, ніж менш плодовиті. Така залежність дозволяє виживати тваринам з малою тривалістю життя за рахунок значного потомства, а неплодовитим тваринам — за рахунок більшого числа можливостей для розмноження.
Для математичного описання старіння багатоплідних організмів інколи використовується так званий закон смертності Ґомпертца-Мейкгама[1] (або просто Ґомпертца), згідно з яким ймовірність смерті експоненційно зростає з віком: , де x — вік, а p — відносна ймовірність смерті за певний проміжок часу, a і b — коефіцієнти. Таким чином, при відсутності постійного члена a, розмір популяції знижується з віком за подвійною експонентою [2]. Цей закон емпіричний та має місце не для всіх тварин і не на всіх проміжках часу, але він найлегший для порівняння старіння різних організмів, і тому коефіцієнт b часто використовується як показник швидкості старіння.
Слід відзначити, що закон Ґомпертца-Мейкгама є лише наближенням, вірним у середньому віковому діапазоні. В області малого віку спостерігається значно вища смертність, ніж передбачається цим законом. Наприклад, північна тріска під час нересту може відкласти до 6 мільйонів ікринок, але лише невелика кількість з них виживає до моменту статевої зрілості[3]. Ця смертність є переважно результатом нездатності молоді уникати хижаків, боротися із хворобами, та також може бути результатом вроджених дефектів, і не є результатом старіння. В області пізнього віку, навпаки, спостерігається зменшення смертності порівняно із законом Ґомпертца, точніше вихід ймовірності смерті за одиницю часу на плато[4]. Як і у випадку дитячої смертності, це загальний закон, що спостерігається навіть у неживій природі[5]. І хоча одним з можливих пояснень цього явища могла би бути гетерогенність популяції, сучасні дані чітко вказують на зв'язок виходу смертності на плато із уповільненням процесу старіння[6].
Для багатоплідних організмів очевидний вплив факторів популяційної динаміки на еволюцію реплікативного (відтворного) та соматичного (тілесного) старіння. Пропорційний внесок індивідуума в швидкість збільшення розміру багатоплідної популяції зменшується з віком у міру зменшення здатності розмножатися. Ці факти пропонують наявність оптимального розміру потомства від одної особини. Наскільки це може направляти еволюцію специфічного старіння або методів захисту проти старіння, викликаного іншими чинниками, — усе ще залишається відкритим питанням, з якого немає згоди серед дослідників[1].
Старіння у різних таксономічних групах[ред. | ред. код]
Багатоклітинні тварини[ред. | ред. код]
Ефект старіння тварин зазвичай спостерігається тільки в захищених середовищах (наприклад, лабораторіях та зоопарках). У природних умовах домінуючою причиною смерті є хижаки, хвороби або нестача їжі, тому старіння проявляється дуже рідко. Зазвичай, природна тривалість життя тварини лише ненабагато перевищує час досягнення статевої зрілості, а максимальна тривалість життя до смерті від старості є в кілька разів більшою (проте, існують кілька винятків із цього правила). У наступній таблиці приведена таблиця максимальної зареєстрованої тривалості життя деяких організмів до смерті від старості, складена переважно засновуючись на даних, отриманих у захищених середовищах.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- Примітки:
- а Ця таблиця є скороченим варіантом таблиці, наведеної у статті Максимальна тривалість життя з ціллю показати приблизний діапазон тривалостей життя для основних груп організмів. Посилання на джерела кожного значення наведені у повному варіанті. При складанні таблиці вказувалися всі знайдені значення віку, хоча їхня достовірність різна. Найкращим джерелом віку для більшості організмів є AnAge Database [Архівовано 27 січня 2018 у Wayback Machine.] через те, що ця база даних у більшості випадків містить детальні посилання на першоджерела використаної інформації та обговорює їхню достовірність. Детальніше див. тут.
- б Слід відзначити, що людина в найбільшій мірі з усіх тварин здатна користуватися послугами медицини, крім того, випадки довгого життя людини набагато краще задокументовані. В результаті тривалість життя людини здається довшою, ніж для подібних тварин.
Фактори, що мають вплив на тривалість життя. Тривалість життя дуже сильно різниться між видами тварин. Кілька факторів мають свій вплив на неї. У більшості випадків тривалість життя залежить від плодовитості тварини: чим більше потомства вона дає, тим менше живе. Крім того, тривалість життя залежить від розміру тварини, розміру її мозку та метаболічної активності. Наприклад, зазвичай менші за розміром тварини мають меншу, а більші за розміром — більшу тривалість життя.
Ссавці. Найкраще досліджена залежність тривалості життя від таксономічної групи серед ссавців. Примати, загалом, — найбільш довгоживуча група, хоча деякі невеликі мавпи Нового Світу мають досить коротке життя. Мишоподібні гризуни недовговічні, тоді як білячеподібні гризуни досягають втричі довшого віку, ніж мишоподібні. Довготривалість життя залежить від трьох окремих факторів: ваги мозку, ваги тіла, і швидкості обміну речовин (метаболізму)[1][9]. Залежність тривалості життя від цих факторів може бути виражена у формі емпіричного рівняння: L = 5,5 E0,54 S−0,34 M−0,42. Тривалість життя (L) ссавців в місцях залежить від мозкової ваги (E) і ваги тіла (S) в грамах і від швидкості обміну речовин (М) в калоріях на грам за годину. Позитивний показник експоненти для E (0,54) указує, що довговічність ссавців сильно і позитивно залежить від розміру мозку незалежно від розміру тіла або швидкості обміну речовин. Негативний коефіцієнт для швидкості обміну речовин вказує, що тривалість життя зменшується з ростом активності організму. Негативний показник для ваги тіла указує, що тенденція довшої тривалості життя великих тварин є результатом не більшого розміру тіла, а більшої мозкової ваги.
Типова залежність дещо порушається у випадку порід собак. Більші за розміром породи собак, хоча і досягають статевої зрілості повільніше, живуть значно менше, різниця становить близько 2 разів між найбільшими та найменшими породами. Цей приклад був першим експериментом, який показав, що селекція в принципі здатна змінювати тривалість життя.
Птахи. Такий самий вигляд залежність L від E, S і М має і для птахів, але птахи загалом живуть довше, ніж ссавці, не зважаючи на вищі температури тіла і швидкості природного обміну.
Плазуни. Великі плазуни мають тривалості життя, що перевищують тривалості життя ссавців відповідного розміру, але швидкість їхнього природного обміну у десятки разів менша. Таким чином, повна витрата енергії за життя у плазунів менша, ніж у ссавців.
Гризуни. Експеримент: Протягом 4 тижнів група дослідників на чолі з професором Кешавом Сінгхом додавала до їжі гризунів антибіотик доксициклін, що призвело до генної мутації та, як наслідок, мітохондріальної дисфункції. В результаті шкіра піддослідних покрилася зморшками, шерсть випала, а та, що залишилася, посивіла. Коли препарат перестав потрапляти до організмів мишей, то доволі швидко їхня шкіра розгладилася, а шерсть знову стала густою та природного кольору. Фактично, вчені змогли зістарити грузинів, а потім повернути до молодого стану.[10]
Членистоногі. Тривалість життя різних видів членистоногих може складати від кількох днів до кількох десятиліть. Якщо життєвий цикл недовговічних комах характеризується єдиною короткою відтворною фазою, то відносно довгоживучі павуки і ракоподібні належать до числа багатоплідних організмів з річними відтворними циклами.
Витрати енергії Великі тварини з дуже розвиненим мозком, особливо примати, виробляють протягом життя найбільшу кількість енергії. Наприклад, повне вироблення енергії за життя людини на грам тканини становить близько 1,2 млн калорій, а за життя таких домашніх тварин, як коти і собаки, лише 0,4 млн калорій.
Приведена вище залежність має місце для теплокровних тварин. Холоднокровні тварини, які впадають у періоди щоденної неактивності або зимової сплячки, можуть значно скорочувати свою метаболічну активність, часто більш ніж вдесятеро. Комахоїдні кажани помірних широт — найвідоміший приклад — хоча вони мають тривалості життя більш ніж у 20 років, майже 80 відсотків цього часу витрачається в глибокій сплячці. В результаті, витрата ними енергії протягом життя не перевищує витрати енергії іншими маленькими ссавцями.
Повільно старіючі хребетні тварини. Хоча у більшості тварин старіння очевидне, у деяких тварин воно незначне. Прикладами таких тварин є деякі великі плазуни, у першу чергу черепахи. Наприклад, галапагоська черепаха (Geochelone nigra) здатна жити до 177 років[11], а деякі риби, наприклад осетер досягають віку більш ніж у 150 років[12]. Проте, тривалість життя та старіння цих тварин досліджені дуже погано. Крім того, навіть протягом довгого життя, витрати енергії цих організмів незначні, набагато менші, ніж у ссавців. Крім того, ці тварини поступово збільшуються у розмірі навіть після досягнення статевої зрілості, що дозволяє їм розбавляти старіючі клітини тіла новими.
Одноплідні тварини. Як вже вказувалося, картина старіння одноплідних організмів дуже відмінна. Одним з дуже цікавих прикладів такого старіння є життєвий цикл рожевого лосося. Звичайна тривалість життя риби становить біля 2-х років. Мальки лосося вилуплюються у прісноводних водоймах, мігрують вниз течією до моря, де й проводять більшу частину життя. Після досягнення статевої зрілості, лосось великою зграєю піднімається вверх проти течії до місць нересту, під час цієї подорожі старість риб ще не помітна, а риби повинні бути у відмінній фізичній формі, щоб підніматися через пороги. Проте, вже через тиждень після нересту, лосось вмирає від старості, що легко зауважити за деградацією майже всіх тканин організму. Хоча тривалість життя значно відрізняється у споріднених видів, всі вони мають лише одну можливість нересту, після якої всі риби вмирають[13].
Подібну картину старіння має і періодична цикада (Magicicada spp.), також відома як «17-річна сарана». Її личинки живуть у землі 17 років, після чого перетворюються на дорослих крилатих комах, спаровуються, відкладають яйця, та вмирають. Звичайно всі комахи у «виводку» на території сотень тисяч км² досягають дорослого стану разом у 24-годинний період, що, здається, є стратегією виживання, коли птахи та інші хижаки не мають можливості впоратися з величезною кількістю цикад, крім того, полегшуються пошук партнера для спаровування. Тривалість життя дорослих комах складає лише кілька тижнів[13].
Зношування незамінних органів. Для деяких тварин причиною смерті може стати зношування важливих незамінних органів, навіть при незначному старінні решти організму. Наприклад, тривалість життя деяких травоїдних тварин обмежується сточуванням їхніх зубів під час пережовування жорсткої трави. Тоді як людина може виростити тільки два набори зубів, найбільш довгоживуча травоїдна тварина, слон, може виростити шість, що дозволяє заміняти сточені зуби новими. Проте, через відносно повільне старіння та невелике число природних хижаків, слони часто доживають до віку, коли останні набір зубів сточується, і тварина вмирає від голоду[13].
Довговічність деяких примітивних тварин. Ряд примітивних видів тварин практично запобігають старіння за рахунок швидкого оновлення клітин усіх тканин свого тіла, що можливо за рахунок простої та децентралізованої структури тіла. Прикладами таких організмів є морські актинії та прісноводні гідри. У найдетальнішому дослідженні, опублікованому в 1998 році[14], було показано, що за зовнішніми, мікроскопічними ознаками та здатністю до розмноження, гідра не проявляла ознак старіння протягом всього дослідження терміном у 4 роки. Навіть якщо ця істота можливо й може старіти, різниця між тривалістю життя і часом досягнення статевої зрілості, який складає лише близько тижня, є вражаючою.
Рослини[ред. | ред. код]
| Організм | Тривалість життя (оцінка) |
|---|---|
| Креозотовий кущ* (Larrea tridentata) | 11 000[15] |
| Секвоядендрон (Sequoiadendron giganteum) | 4 000[16][15] |
| Дуб черешчатий (Quercus robur) | 2 000[16] |
| Модрина європейська (Larix decidua) | 700[16] |
| Цибуля (Allium ursinum) | 8-10[17] |
| Молочна віка (Astragalus utahensis) | 3[17] |
- Примітка: * У цьому випадку можливі проблеми з ідентифікацією окремого організму (того ж «індивідуума») та його природних клонів.
У випадку рослин поняття старіння виражено не так чітко, як для тварин. Такі поняття, як старіння, визрівання, смерть, розвиток, хлороз, некроз, висушування, погано розмежовані і часто перекриваються[18]. Крім того, не ясно що робити у випадку насіння, яке може зберігатися досить довго, не проявляючи ніякої фізіологічної активності, або з частинами рослин, які дають початок новим рослинам в результаті вегетативного розмноження. Тривалість життя дуже сильно різниться серед представників Царства рослин. Деякі види дерев можуть жити кілька сотень років, тоді як деякі рослини завершують свій життєвий цикл за декілька тижнів[19].

Розглядаючи тривалість життя рослин, важливо мати на увазі, що смертність клітин дуже висока протягом всього життя рослини, а відмирання тканин, або, у випадку одноплідних організмів, цілих рослин, регулюється системою гормонів. Ріст судинних рослин залежить від активності меристем, які складаються із клітин, аналогічних стовбуровим клітинам тварин, і по суті являють собою ембріональні тканини. У випадку багатьох багатополідних (багаторічних) рослин, цей ріст може продовжуватися практично необмежено. Решта тканин рослини, проте, постійно відмирає. Наприклад, більша частина маси дерева складається з мертвих клітин деревини. Окремі органи рослини, такі як листя, мають тривалість життя значно меншу, ніж тривалість життя всього організму. Листя вигідно підтримувати тільки якщо воно сприяє виживанню всієї рослини. Це можливо прослідкувати на прикладі листопадних рослин помірного поясу: в умовах зменшення світлового дня або зниження температури, в рослинах запускається запрограмована смерть клітин, яка зазвичай приводить до зміни забарвлення листя та його опадання.
Це «жовтіння» листя в літературі часто називається старінням листя або синдромом старіння[20]. За допомогою процесу старіння, поживні речовини вмираючого листа мобілізуються для використання іншими частинами рослини, що дозволяє підтримувати їхній ріст. Наявність поживних речовин, в першу чергу азоту, є головним обмежувальним фактором росту. Окрім того, рослини не можуть змінювати свого положення в ґрунті, і таким чином виснажують своє оточення. В результаті існує сильний добірний тиск розвитку систем повторної переробки необхідних для життя компонентів.
Є багато факторів, які можуть ініціювати програму старіння та переробки поживних речовин. У деяких видах її може викликати потреба в поживних речовинах в іншому місці, наприклад для розвитку насіння[21]. Так саме програма відмирання листя або інших частин рослини може бути викликана поступовим зниженням їхньої продуктивності з віком за рахунок старіння фотосинтетичного апарату або судинної системи цих частин організму, аналогічно процесу старіння тварин[19][20].
Процес старіння, аналогічний старінню багатоплідних тварин, також трапляється у рослин при відсутності запрограмованого старіння. Цей процес характеризується змінами клітинної структури, подібними до змін структури тваринних клітин.
Одноклітинні організми[ред. | ред. код]

Одноклітинні організми, як і багатоклітинні, підлягають старінню та інтенсивно досліджуються через подібність їхнього старіння до клітинного старіння багатоклітинних організмів. Модельним організмом для вивчення клітинного старіння є дріжджі, що брунькуються, (Saccharomyces cerevisiae), які, як еукаріоти, володіють біохімічними процесами, подібними до біохімічних процесів старіючих клітин вищих тварин і рослин. Проте, дослідження були проведені і серед деяких бактерій, зокрема Escherichia coli та Caulobacter crescentus.
У одноклітинних організмах були досліджені дві різні форми процесів старіння[22]. Перша — старіння, специфічне для материнської клітини при клітинному поділі, при якому материнська клітина старіє, тоді як дочірня клітина при кожному поділі обнуляє клітинний годинник (омолоджується). Старіння материнської клітини проявляється у поступовому уповільненні клітинного циклу, після чого клітина втрачає здатність до нових поділів, так зване реплікативне старіння. Цей процес був спочатку знайдений у клітин з асиметричним поділом, тобто в дріжджах, що брунькуються, а потім у асиметричної бактерії Caulobacter crescentus, де визначення материнської клітини очевидне[23]. Пізніше спостереження за поділом клітин дозволило визначити материнську клітину і в організмі з симетричним поділом — бактерії E. coli, де материнської клітиною є клітина із «старим кінцем», хоча пізніше були знайдені і незначні морфологічні відмінності між материнськими та дочірніми клітинами[24].
Вік в даному випадку визначається за числом поділів, через які пройшла клітина, а не календарним часом. Типова середня тривалість життя лабораторних дріжджів (Saccharomyces cerevisiae) дикого типу становить близько 25 поколінь. Функція розподілу тривалості життя індивідуальних клітин слідує закону Ґомпертца, так само, як і тривалість життя вищих тварин[22]. У бактерії Caulobacter crescentus середня тривалість життя становить від 100 до 130 поділів[23].
Другий процес старіння, також знайдений у цих трьох модельних організмах, — хронологічне старіння клітин, відоміший як умовне старіння (через те, що цей процес проявляється тільки в певних умовах навколишнього середовища). Цей процес проявляється у поступовій деградації і втраті життєздатності клітин протягом стаціонарної фази[22][25][26].
На прикладі дріжджів було знайдено, що, подібно до процесу реплікативного старіння, специфічного для материнських клітин, умовне старіння є як процесом зношування внутріклітинних структур, так і генетичної програми. Наприклад, клітинна стінка в стаціонарній фазі проходить через ряд генетично запрограмованих структурних змін з метою підвищити життєздатність та тривалість життя організму. Проте, врешті решт клітина старіє та вмирає[22].
Спадкування довголіття[ред. | ред. код]
Спадкування довголіття в популяціях таких тварин, як плодові мухи і миші, може бути визначене, якщо порівнювати таблиці тривалості життя природних популяцій і деяких мутантів та гібридів. Згідно з експериментальними даними, близько 30 відсотків варіації довголіття самиць та 20 відсотків довголіття самців визначається генетично. Ці значення подібні до наслідування таких фізіологічних рис, як кількість відкладених яєць і виробництво молока домашніми тваринами[1].
Коефіцієнт експоненти функції Ґомпертца вказує швидкість старіння. Відмінності в довголітті між видами є результатом передусім відмінностей у швидкості старіння, і тому виражаються у відмінностях в цьому коефіцієнті.
Порівняння таблиць смертності різних штамів мишей одного виду вказує, що відмінності між штамами перш за все походять від відмінностей в незалежному від віку члені функції Ґомпертца. Якщо штами відрізняються тільки незалежним від віку членом, менш довголітні штами мають більшу смертність, вищу на постійну величину протягом всього життя, що проявляється у вертикальному зсуві функції Ґомпертца. При цьому часто трапляється, що гібриди першого покоління (F1) двох природних штамів живуть довше, ніж будь-який з батьків. Хоча досліджень біохімічних процесів таких гібридів не проводилося, таблиці тривалості життя указують, що гібриди відрізняються від батьківських штамів тільки незалежним від віку членом, але не зміною швидкості старіння. Інші дослідження також показали, що у значній мірі варіації в тривалості життя між штамами мишей пояснюються відмінностями в успадкованій сприйнятливості до певних хвороб.
Спадкування довголіття людей складніше досліджувати, тому що на тривалість життя впливають соціально-економічні та інші зовнішні чинники, які ускладнюють кореляції між близькими родичами. Проте, дослідження вказують на деяку, хоча і невелику, спадковість тривалості життя та сприйнятливості до таких хвороб як рак і хвороби серця, перш за все через те, що однояйцеві (генетично ідентичні) близнюки прагнуть мати більш подібні частоти цих захворювань, ніж відповідні різнояйцеві (генетично різні) близнюки.
Зміни організму під час старіння[ред. | ред. код]
Фізіологія старіння[ред. | ред. код]
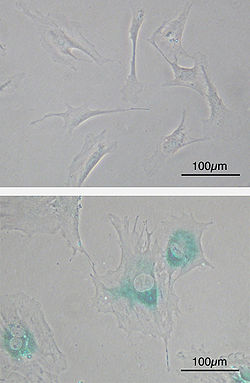
Верх: Первинні фібробласти мишей (MEF) до старіння.
Низ: MEF старіють після досягнення межі Гейфліка. Клітини збільшуються, отримують плоску форму та експресують нові гени, характерні для старіння (SABG, синій колір).
Серед всіх організмів найкраще вивчені зміни, що відбуваються в організмах ссавців, перш за все через спорідненість цих організмів до людини, але також і через те, що симптоми старіння найчіткіше виражені серед них.
Всі ссавці є багатоплідними організмами, у яких старіння має повільний характер та охоплює практично всі системи організму. Загальні зміни включають зниження основної маси тіла (живих клітин та кісток) при зростанні повної маси за рахунок зростання кількості жирових відкладень та вмісту води. Основний обмін, тобто мінімальний рівень метаболічної активності, знижується у всіх тканинах, як і рівень добровільної активності, але остання сильно залежить від виду тварини та фізичної навантаження протягом попереднього життя.
Через формування перехресних зв'язків між молекулами колагену, основного структурного міжклітинного білка організму ссавців, та кальціфікацію гладких м'язів та стінок судин, збільшується жорсткість сполучної тканини. Проте, одночасно проходить декальціфікація скелетних кісток, в результаті чого кістки стають тоншими, менш щільними і менш міцними. Через потоншення хребців зменшується ріст тіла.
У більшості тканин відбувається атрофія клітин і навіть цілих структур, особливо це помітно в деяких тканинах, що не відновлюються, перш за все центральній нервовій системі. Хоча навіть кількість периферійних нервових волокон людини зменшується на 20 відсотків до 90-літнього віку, найбільше страждають клітини кори головного мозку. Ця втрата нейронів є головною причиною зниження розумових здібностей старих людей, хоча деякий ефект має і зниження постачання кисню.
Також для багатьох тканин характерні відкладення інертних та потенційно шкідливих речовин. Наприклад, пігмент ліпофусцин, відсутній в молодості, в старості становить до 3 % маси серцевого м'язу. Дуже відомі відкладення і у кровоносних судинах — атеросклероз.
Також помітні зміни в ендокринній системі, яка уповільнює відповідь на зміни зовнішнього середовища, в результаті організм стає уразливішим до будь-яких несприятливих факторів (стресу).
Через старіння імунної системи збільшується ймовірність автоімунних реакцій при загальному зниженні активності тимус-залежної підсистеми. В результаті, як збільшується ймовірність ракових клітин розвитися у пухлину, так і виникає ризик автоімунних хвороб.
На клітинному рівні старіння проявляється в уповільненні поділу клітин. Частково цей ефект є результатом так званої межі Гейфліка поділу соматичних клітин. Ця межа пов'язана із відсутністю активної теломерази, в результаті чого кінцеві ділянки хромосом, теломери, скорочуються при кожному поділі. У людини соматична клітина максимально може поділитися близько 52 разів, після чого теломери зникають, і в клітини запускається програма апоптозу, «альтруїстичного самогубства» клітини. Хоча межа Гейфліка і вважається основною причиною зменшення рівня клітинного поділу, навіть стовбурові клітини, у яких ця межа відсутня, стають менш активними, уповільнюють свій поділ і не так часто перетворюються на соматичні клітини.
Генетика старіння[ред. | ред. код]
Генетика старіння еукаріотів[ред. | ред. код]
Під час старіння клітини проходять через ряд генетичних змін, які тим ти іншим чином впливають на хід процесу старіння. Дослідження старіння еукаріотів були проведені за допомогою цілого ряду модельних організмів, таких як домашня миша (Mus musculus), плодова муха (Drosophila melanogaster), круглі черви Caenorhabditis elegans, філаментарні гриби Podospora anserina і дріжджі Saccharomyces cerevisiae. Дослідження цих організмів виявили присутність як мінімум двох збережених шляхів, що активізуються під час старіння.
| Podospora | Saccharomyces | Caenorhabditis | Drosophila | Миша |
|---|---|---|---|---|
| grisea | LAG1 | daf-2 | sod1 | Prop-1 |
| LAC1 | age-1/daf-23 | cat1 | p66shc | |
| RAS1 | daf-18 | mth | mclk1 | |
| RAS2 | akt-1/akt-2 | |||
| PHB1 | daf-16 | |||
| PHB2 | daf-12 | |||
| CDC7 | ctl-1 | |||
| BUD1 | old-1 | |||
| RTG2 | spe-26 | |||
| RPD3 | clk-1 | |||
| HDA1 | mev-1 | |||
| SIR2 | ||||
| SIR4-42 | ||||
| UTH4 | ||||
| YGL023 | ||||
| SGS1 | ||||
| RAD52 | ||||
| FOB1 |
Один з цих шляхів залучає ген SIR2, NAD+-залежну гістонову деацетилазу. У дріжджах білок Sir2 потрібний для супресії генів в трьох локусах (місцеположеннях): локусі спаровування дріжджів та генах теломер і рибосомної ДНК (рДНК). У деяких видів дріжджів симптоми реплікативного старіння можуть частково викликатися гомологічною рекомбінацією між повторами рРНК; вилучення повторів рРНК провидить до утворення екстрахромосомної циклічної рРНК (ЕЦР або ERC, від англ. Exctachtomosomal rRNA circles). Ці ЕЦР реплікуються і переважно акумулюються в материнській клітині під час поділу, та викликають клітинне старіння за рахунок конкурентного зв'язування з важливими ядерними факторами. ЕЦР не спостерігалися в інших видах дріжджів (які також проявляють реплікативне старіння) та у вищих організмах, таких як людина. Екстрахромосомна циклічна ДНК (ехцДНК, англ. eccDNA) була знайдена в червів, мух і людини. Роль ехцДНК в старінні, якщо є, невідома.
Не зважаючи на відсутність зв'язку між циклічною ДНК і старінням у вищих організмах, додаткові копії гомологів Sir2 здібні до збільшення тривалості життя як червів, так і мух. Механізми, якими гомологи Sir2 у вищих організмах регулюють тривалість життя, залишаються неясними, але було встановлено, що людський білок SIRT1 деацетилює p53, Ku70 і сімейство факторів транскрипції forkhead. SIRT1 також може також регулювати інші ацетильовані білки, такі як CBP/p300[en], і може деацетилювати деякі амінокислоти гістонів.
RAS1 і RAS2 також впливають на старіння в дріжджах і мають людські гомологи. Було показано, що надмірна експресія RAS2 збільшує тривалість життя дріжджів.
Кілька інших генів регулюють старіння в дріжджах, збільшуючи опір окислювальному стресу. Супероксидна дісмутаза, білок, що захищає клітину проти ефектів активних форм кисню (АФК) мітохондрій, може уповільнити умовне старіння дріжджів, якщо надмірно експресується протягом стаціонарної фази.
Сильно пов'язаним із старінням вищих організмів є шлях інсуліну/IGF-1. Мутації, що впливають на інсуліно-подібну передачу сигналів у червів, мух і миш, часто пов'язані із збільшеною тривалістю життя. Цей шлях пригнічується за умовами обмеження калорій, і у свою чергу впливає на тривалість життя через механізм, залежний від білків p53/p21/Akt[27].
У дріжджах, активність Sir2 регулюється нікотинамідазою PNC1. Виробництво PNC1 збільшується на рівні транскрипції за умовами стресу, наприклад, під час низькокалорійної дієти, теплового або осмотичного шоку. Перетворюючи нікотинамід на ніацин, він усуває нікотинамід, який інгібує активність Sir2. Нікотинамідаза знайдена і у людини, де вона відома як PBEF і, можливо, виконує подібну функцію, а секретована форма PBEF, відома як вісфатін, можливо, допомагає регулювати рівень інсуліну в сироватці. Не відомо, проте, чи ці механізми також існують у людини через значні відмінності в фізіології миші та людини.
Було показано, що активність Sir2 зростає за умовами обмеження калорій в дієті мишей. Через відсутність доступної глюкози в клітинах утворюється більше вільного NAD+, що приводить до активації Sir2. Резвератрол, поліфенол знайдений в деяких фруктах, збільшує тривалість життя дріжджів, червів та мух за рахунок активізації діяльності Sir2 та імітації ефекту низькокалорійної дієти.
За деякими даними, процесу старіння можуть сприяти і флуктуації в експресії багатьох генів[28]. Індивідуальні, генетично ідентичні клітини можуть мати істотно різні відповіді на зовнішні стимули і помітно різні тривалості життя, указуючи, що епігенетичні фактори грають важливу роль у експресії генів і старінні.
Генетика старіння бактерій[ред. | ред. код]
Набагато менше відомо про старіння бактерій, незважаючи на їхню простішу структуру та зручність дослідження. Серед бактерій найкраще відомі зміни, що відбуваються під час умовного старіння (хронологічного старіння у стаціонарній фазі) бактерії E. coli[29].
Більшість генетично контрольованих змін під час умовного старіння E. coli відбуваються через зміну в рівні експресії сігма-фактору σs, який відповідає за експресію генів, пов'язаних за ремонт пошкоджених білків, аналогічно гену C. elegans daf-16 та генам дріжджів RAS/PKA. σs конкурує з іншим сігма-фактором, σ70, який відповідає за ріст бактерії, і ніколи не експресується у «повну силу». Таким чином, бактерія продовжує обмежений ріст навіть в умовах стаціонарної фази, що надає їй можливість швидко відновити ріст, якщо умови змінюються, але недоліком є неможливість σs впоратися із значним окислювальним стресом. Таким чином, залишкова активність σ70 у стаціонарній фазі є прикладом так званої антагоністичної плейотропії (див. нижче), типу генетичної системи, яка розвивається за рахунок позитивного ефекту на одних стадіях життя, незважаючи на негативний ефект на інших, рідкісніших, стадіях.
Причини старіння[ред. | ред. код]
Історія дослідження[ред. | ред. код]
Перші спроби наукового пояснення старіння почалися наприкінці 19 століття. У одній з перших робіт Вейсман[30] запропонував теорію походження старіння як риси, що виникла в результаті еволюції. Згідно з ним, «старіючі організми не тільки не є корисними, вони шкідливі, тому що займають місце молодих», що, згідно з Вайсманом, повинно було привести еволюцію до виникнення старіння.
Важливим кроком у дослідженні старіння була доповідь професора Пітера Медавара перед Лондонським королівським товариством в 1951 році під назвою «Нерозв'язана проблема біології»[31]. У цій лекції він підкреслив, що тварини в природі рідко доживають до віку, коли старіння стає помітним, таким чином еволюція не могла впливати на процес розвитку старіння. Ця робота поклала початок цілої серії нових досліджень.
Протягом наступних 25 років дослідження мали переважно описовий характер. Проте, починаючи з кінця 70-х років, виникає велика кількість теорій, які намагалися пояснити старіння. Наприклад, у відомому огляді, опублікованому Калебом Фінчем в 1990 році, нараховувалося близько 4 тис. посилань[32]. Тільки наприкінці 1990-х років ситуація почала прояснятися, і більшість авторів почали приходити до спільних висновків.
Всі теорії старіння можливо умовно поділити на дві великі групи: еволюційні теорії та теорії, засновані на випадкових пошкодженнях клітин. Перші пропонують, що старіння є не необхідною рисою живих організмів, а запрограмованим процесом. Згідно з ними, старіння розвинулося в результаті еволюції через деякі переваги, які воно надає цілій популяції. На відміну від них, теорії пошкодження пропонують, що старіння є результатом природного процесу накопичення пошкоджень з часом, з якою організм намагається боротися, а відмінності старіння між організмами є результатом різної ефективності цієї боротьби. Зараз останній підхід вважається встановленим в біології старіння[33][34][35]. Проте, деякі дослідники все ще захищають еволюційний підхід[13], а деякі інші зовсім відкидають поділ на еволюційні теорії та теорії пошкоджень. Останнє ствердження є частково результатом зміни термінології: у деяких роботах останнього часу термін «еволюційні теорії» посилається не на теорії «запрограмованого старіння», що пропонують еволюційне виникнення старіння як корисного явища, а на підхід, що описує чому організми повинні старіти у протилежність питанню про біохімічні та фізіологічні основи старіння.
Чому виникає старіння[ред. | ред. код]
Еволюційно-генетичний підхід[ред. | ред. код]
Перша ідея, що лягла в основу генетичного підходу, була запропонована Пітером Медаваром в 1952 році[31] і відома зараз як «теорія накопичення мутацій» (англ. Mutations accumulation theory). Медавар відмітив, що тварини в природі дуже рідко доживають до віку, коли старіння стає помітним. Згідно з його ідеєю, алелі, що проявляються протягом пізніх періодів життя і що виникають в результаті мутацій зародкових клітин, піддаються досить слабкому еволюційному тиску проти себе, навіть якщо в результаті них страждають такі риси, як виживання та розмноження. Таким чином, ці мутації можуть накопичуватися в геномі протягом багатьох поколінь. Проте, будь-яка особина, що зуміла уникнути смерті протягом довгого часу, випробує на собі їхню дію, що проявляється як старіння. Те ж саме вірно і для тварин у захищених умовах.
На додаток, у 1957 році Д. Вільямс[36] запропонував існування плейотропних генів, які мають різний ефект на виживання організмів протягом різних періодів життя, тобто корисні у молодому віці, коли ефект природного відбору сильний, та шкідливі пізніше, коли ефект природного відбору слабкий. Ця ідея зараз відома як «антагоністична плейотропія» (англ. Antagonistic pleiotropy).
Разом ці дві теорії складають основу сучасних уяв про генетику старіння[35]. Проте, ідентифікація відповідних генів мала лише обмежений успіх. Свідоцтва про накопичення мутацій залишаються спірними[37], тоді як свідоцтва наявності плейотропічних генів сильніші, але й вони бракують деталей. Прикладами плейотропних генів можна назвати теломеразу у еукаріотів та сігма-фактор σ70 у бактерій. Хоча відомо багато генів, що впливають на тривалість життя різних організмів, інших чітких прикладів плейотропних генів все ще немає[38].
Еволюційно-фізіологічний підхід[ред. | ред. код]
Хоча і відомо кілька специфічних генів, запропонованих теоріями накопичення мутацій та антагоністичної плейотропії, безпосереднього зв'язку із старінням показано не було, тим більш не було показано, що ефект цих генів типовий для всіх організмів та відповідає за всі аспекти старіння. Тобто ці гени можуть розглядатися лише як кандидати на роль генів, передбачених теорією. З іншого боку, ряд фізіологічних ефектів, передбачених в роботі Вільямса 1957 року про антагоністичну плейотропію[36], показані без визначення генів, що відповідають за них. Часто ми можемо розмовляти про компроміси, аналогічні передбаченим цією теорією, без чіткого визначення генів, від яких вони залежать. Фізіологічна основа таких компромісів закладена у так званій «теорії одноразової соми» (англ. Disposable soma theory)[39]. Ця теорія задається питанням, як організм має розпорядитися своїми ресурсами (у першому варіанті теорії мова йшла тільки про енергію) між підтримкою та ремонтом соми та іншими функціями, необхідними для виживання. Необхідність компромісу виникає через обмеженість ресурсів та необхідність вибору найкращого шляху їхнього використання.
Підтримка соми повинна виконуватися лише настільки, наскільки це необхідно протягом звичайного часу виживання у природі. Наприклад, оскільки 90 % диких мишей вмирає протягом першого року життя, переважно від холоду, інвестиції ресурсів у виживання протягом довшого часу будуть стосуватися лише 10 % популяції. Таким чином, 3-річна тривалість життя мишей повністю достатня для всіх потреб у природі, а з точки зору еволюції, ресурси слід витрачати, наприклад, на покращення збереження тепла або розмноження, замість боротьби із старістю. Таким чином, тривалість життя миші найкраще відповідає екологічним умовам її життя.
Теорія одноразової соми робить кілька передбачень щодо фізіології процесу старіння. Згідно з цією теорією, старіння виникає в результаті неідеальних функцій ремонту і підтримки соматичних клітин, що адаптовані для задоволення екологічних потреб. Пошкодження, у свою чергу, є результатом стохастичних процесів, пов'язаних з життєдіяльністю клітин. Довголіття контролюється за рахунок контролю генів, що відповідають за ці функції, а безсмертя генеративних клітин, на відміну від соми, є результатом більших витрат ресурсів та, можливо, відсутності деяких джерел пошкоджень.
Як виникає старіння[ред. | ред. код]
Молекулярні механізми[ред. | ред. код]
Існують свідоцтва кількох найважливіших механізмів пошкодження макромолекул, які звичайно діють паралельно один одному або залежать один від одного[35]. Здається, будь-який з цих механізмів може займати домінуючу роль за певними обставинами.
У багатьох з цих процесів важливу роль приймають активні форми кисню (зокрема вільні радикали), набір свідоцтв про їхній вплив був отриманий досить давно і зараз відомий під назвою «вільно-радикальної теорії старіння». Зараз, проте, механізми старіння набагато більше деталізовані.
Теорія соматичних мутацій. Багато робіт показали збільшення з віком числа соматичних мутацій та інших форм пошкодження ДНК, пропонуючи репарацію (ремонт) ДНК як важливий фактор підтримання довголіття клітин. Пошкодження ДНК типові в клітинах, та викликаються такими факторами як жорстка радіація та активні форми кисню, і тому цільність ДНК може підтримуватися тільки за рахунок механізмів репарації. Дійсно, існує залежність між довголіттям та репарацією ДНК, як це було продемонстровано на прикладі ферменту полі-АДФ-рибоза-полімераза-1 (PARP-1), важливого гравця в клітинній відповіді на викликане стресом пошкодження ДНК[40]. Вищі рівні PARP-1 асоціюються з більшою тривалістю життя.
Накопичення сміття і змінених білків. Також важливим для виживання клітини є кругообіг білків, для якого критичне усунення пошкоджених та зайвих білків. Окислені та карбонільовані білки є типовим результатом впливу активних форм кисню, що утворюються в результаті багатьох метаболічних процесів клітини та часто перешкоджають коректній роботі білка. Проте, механізми репарації не завжди можуть розпізнати пошкоджені білки[29] та стають менш ефективними з віком[35] за рахунок зниження активності протеасом[41]. У деяких випадках, білки є частиною статичних структур, таких як клітинна стінка, які не можуть бути легко зруйновані. Кругообіг білків залежить також і від білків-шаперонів, які допомагають білкам отримувати належну конформацію. Проте, з віком спостерігається зниження їхньої активності[42], хоча це зниження може бути результатом перевантаження шаперонів (та протеазом) пошкодженими білками.
Існують свідоцтва, що накопичення пошкоджених білків дійсно відбувається з віком та може відповідати за такі асоційовані з віком захворювання як хвороба Альцгеймера, хвороба Паркінсона та катаракта.
Мітохондріальна теорія. Важливий зв'язок між молекулярним стресом та старінням був запропонований, засновуючись на накопиченні мутацій в мітохондріальній ДНК (мтДНК)[43]. Ці дані були підкреплені спостереженням зростання з віком числа клітин, що бракують цитохром-с-оксидази (COX), асоційованих з мутаціями мтДНК. Такі клітини часто мають порушення у виробництві АТФ та клітинному енергетичному балансі.
Втрата теломер. В багатьох клітинах людини втрата здатності клітин до поділу пов'язана із втратою теломер на кінцях хромосом, що витрачаються після певної кількості поділів. Це трапляється через відсутність ферменту теломерази, який звичайно експресується тільки у зародкових та стовбурових клітинах. Нещодавно було знайдено, що окислювальний стрес (надмірне виділення активних форм кисню) також може мати ефект на втрату теломер, значно прискорюючи цей процес у певних тканинах[44].
Системні та мережеві механізми[ред. | ред. код]
На перших етапах дослідження старіння, численні теорії розглядалися як конкуруючі в поясненні ефекту старіння. Проте, зараз здається, що багато механізмів пошкодження клітин діють паралельно, і клітини також повинні витрачати ресурси на боротьбу з багатьма механізмами. Для дослідження взаємодії між всіма механізмами боротьби та пошкодження був запропонований системний підхід до старіння, який намагається одночасно прийняти до уваги багато таких механізмів. Більш того, цей підхід здатний чітко розрізнити механізми, що діють на різних стадіях життя організму. Наприклад, поступове накопичення мутацій у мітохондріальній ДНК з часом приводить до накопичення активних форм кисню та зниження виробництва енергії, що у свою чергу приводить до збільшення швидкості пошкодження ДНК та білків клітини.
Іншій аспект, який робить системний підхід привабливим, це розуміння різниць між різними типами клітин та тканин організму. Наприклад, клітини, що активно діляться, ймовірніше постраждають від накопичення мутацій та втрати теломер, ніж диференційовані клітини. Проте, диференційовані клітини ймовірніше постраждають від пошкодження білків, які швидко розбавляються новими білками в клітинах, що щвидко діляться. Навіть якщо клітина втрачає здатність до проліферації за рахунок процесів старіння, баланс механізмів пошкодження в ній зсувається.
Популяційний підхід[ред. | ред. код]
Іншим підходом до вивчення старіння є дослідження популяційної динаміки старіння. Всі математичні моделі старіння можна приблизно розбити на два головних типи: моделі даних і системні моделі[45]. Моделі даних — це моделі, які не використовують і не намагаються пояснити будь-яких гіпотез про фізичні процеси в системах, для яких ці дані отримані. До моделей даних відносяться, зокрема, і всі моделі математичної статистики. На відміну від них, системні моделі будуються переважно на базі фізичних законів і гіпотез про структуру системи, головним в них є перевірка запропонованого механізму.
Першим законом старіння є закон Ґомпертца, що пропонує просту кількісну модель старіння. Цей закон надає можливість відокремити два типи параметрів процесу старіння. Дослідження відхилення закону старіння від кривої Ґомпертца можуть надати додаткову інформацію щодо конкретних механізмів старіння даного організму. Найвідоміший ефект такого відхилення — вихід смертності на плато у пізньому віці замість експоненціального зростання, спостережений у багатьох організмах[6]. Для пояснення цього ефекти було запропоновано кілька моделей, серед яких варіації моделі Стрелера-Мілдвана[46] та теорії надійності[47].
Системні моделі загалом розглядають багато окремих факторів, подій і явищ, що безпосередньо впливають на виживання організмів і породження потомства. Ці моделі загалом розглядають старіння як баланс і перерозподіл ресурсів як в фізіологічному (впродовж життя одного організму), так і в еволюційному аспектах. Зазвичай, особливо в останньому випадку, мова йде про розподіл ресурсів між безпосередніми витратами на породження потомства і витратами на виживання батьків[45].
Клітинна відповідь на старіння[ред. | ред. код]
Важливим питанням старіння на рівні клітин та тканин є клітинна відповідь на пошкодження. Через стохастичну природу пошкоджень, окремі клітини старіють, наприклад через досягнення межі Гейфліка, швидше за решту клітин. Такі клітин потенційно можуть загрожувати здоров'ю всієї тканини. У найбільшій мірі така загроза проявляється серед стовбурових клітин та клітин, що проходять через швидкий поділ, таких як клітини кісткового мозку або епітелію кишечника, через великий потенціал таких тканин до створення мутантних, можливо ракових, клітин. Відомо, що саме клітини цих тканин швидко відповідають на пошкодження ініціацією програми апоптозу. Наприклад, навіть низькі дози радіації (0,1 Gy) викликають апоптоз в клітинах епітелію кишечника, а навіть слабкий хімічний стрес викликає апоптоз стовбурових клітин старих мишей.
Як правило, в таких тканинах масовий апоптоз є ознакою зростання числа пошкоджень клітин. Проте, в інших тканинах відповіддю на зростання рівню пошкоджень може бути арешт клітини на певній стадії клітинного циклу для припинення поділу[35]. Баланс між апоптозом та арештом пошкоджених клітин найважливіший як компроміс між старінням та раком[48]. Тобто, або організм повинен вбити пошкоджені клітини, або дати їм можливість існувати, збільшуючи ризик виникнення раку. Таким чином, p53 і скорочення теломер, важливі фактори у викликанні апоптозу клітин, можуть розглядатися як приклад антагоністичної плейотропії, як було вказано вище.
У підсумку, згідно з сучасними поглядами, клітина старіє через накопичення пошкоджень. Швидкість цього накопичення визначається, у першу чергу, генетично визначеними витратами на ремонт та підтримку клітинних структур, які у свою чергу визначаються організмом для задовольняння своїх екологічних потреб. Довго-живучі організми мають більші витрати (інколи повільніший метаболізм), що приводить до повільнішого накопичення пошкоджень. Для боротьби з ризиком, який створюють пошкоджені клітини, організм має систему механізмів для боротьби з ними, які часто залучають другий ряд компромісів.
Старіння і людина[ред. | ред. код]
Старіння людини звичайно має особливе значення. Століттями філософи обговорювали причини старіння, алхіміки шукали еліксир молодості, а багато релігій надавали старінню сакральне значення. Зараз успіхи медицини та покращення рівня життя дозволили значно підвищити середню тривалість життя, проте, незважаючи на інтенсивні дослідження, дослідники ще далекі до подолання старіння. Збільшення тривалості життя у багатьох країнах привело до старіння населення, і у зв'язку із збільшенням долі старих людей, які мають інші потреби, ніж решта населення, останніми роками виникло багато соціальних питань пов'язаних із старінням.
Демографія старіння[ред. | ред. код]

Головним демографічним ефектом успіхів медицини та загального покращення умов життя протягом останнього століття є падіння смертності та значне збільшення тривалості життя. На додаток, народжуваність у більшості країн світу знижується, що приводить до так званого старіння населення, особливо у розвинених країнах світу.
Віковий склад населення звичайно зображується у вигляді статево-вікових пірамід, на яких доля населення у кожному віці зображується залежно від віку. На таких пірамідах старіння населення виглядає як зростання долі старих людей наверху піраміди за рахунок молоді унизу. Процес старіння, таким чином, може бути двох типів: «старіння знизу», або зменшення народжуваності, та «старіння зверху», або збільшення середньої тривалості життя. У більшості країн світу старіння знизу є найбільшим з двох факторів, а у пост-радянських країнах, включаючи Україну, — єдиним. В Україні старіння населення частково компенсується падінням тривалості життя (з 71 року в 1989 році до 68 в 2005[49]), як через погіршення медичного обслуговування та збільшення соціальної нерівності, так і через розповсюдження епідемії СНІДу. Загалом у світі, згідно з даними ООН, відсоток населення старше 60 років становив 8 % у 1950 році, 10 % у 2000, та очікується на рівні 21 % у 2050.
Старіння населення має значний вплив на суспільство. Старі люди ймовірніше зберігатимуть гроші замість витрачання їх на товари широкого споживання. Це приводить до значного дефляційного тиску на економіку. Деякі економісти, особливо японські, бачать переваги в цьому процесі, виключно можливість просування автоматизації виробництва без загрози збільшення безробіття та рішення проблеми перенаселення. Проте, негативний ефект відчувається у системі соціального забезпечення та пенсій, які у багатьох країнах, переважно у Європі, фінансуються за рахунок податків з працюючої частини населення, яка постійно зменшується. Крім того, значний вплив здійснюється і на освіту, що проявляється як в зниженні державних витрат, так і в погіршенні загального рівня грамотності через повільнішу можливість старіючого населення пристосовуватися до зростаючих стандартів. Таким чином, контроль старіння населення та адаптація суспільства до нових умов є найважливішими задачами демографічної політики.
Соціологія старіння[ред. | ред. код]
Юридичні аспекти[ред. | ред. код]
Хоча у більшості країнах деякі права та обов'язки надаються людині починаючи з певного віку (такі як право голосу, право купувати алкоголь або кримінальна відповідальність), часто старі люди позбавляються деяких прав. Типовим прикладом є право водити машину, яке обмежується у багатьох країнах максимальним віком (звичайно 70-75 років).
Економічні аспекти[ред. | ред. код]
Старі люди перш за все відрізняються тенденцією зберігання та інвестування грошей замість витрачання їх на споживчі товари. Крім того, загалом старе населення вибуває з числа робочої сили, збільшуючи навантаження на активних працівників, але й відкриваючи дорогу до автоматизації виробництва, як було вказано вище.
Охорона здоров'я[ред. | ред. код]
Через велику кількість хвороб похилого віку та загальне зниження працездатності з віком, старе населення вимагає більших витрат на медичне та соціальне обслуговування. Багато розвинених країн очікують значне старіння населення найближчим часом, і тому турбуються щодо значного збільшення витрат для збереження якості охорони здоров'я на належному рівні. Напрямок діяльності з ціллю подолання цієї проблеми полягає в поліпшенні ефективності роботи системи охороно здоров'я, цілеспрямованіше надання допомоги, підтримка альтернативних організацій надання медичної допомоги та вплив на демографічну ситуацію.
Культурні варіації[ред. | ред. код]
Існує багато варіацій між країнами як у визначенні старіння, так і у відношенні до нього. Наприклад, пенсійний вік варіюється між країнами у діапазоні від 55 до 70 років. На додаток, у багатьох суспільствах, переважно традиційних аграрних культурах, старість є ознакою мудрості, а старі люди мають великий вплив на суспільство.
«Успішне старіння»[ред. | ред. код]
У країнах Заходу зараз набирає популярність концепція «успішного старіння», що визначає, як найкращим чином повинно протікати старіння, використовуючи сучасні досягнення медицини та геронтології. Ця концепція може бути прослідкована до 1950-х років, але була популяризована у роботі Роуї та Кана 1987 року[50]. Згідно з авторами, попередні дослідження старості перебільшили ступень, до якої недоліки здоров'я, такі як діабет або остеопороз, можуть бути приписані старості, та критикували дослідження в геронтології за перебільшення однорідності досліджених людей.
У наступній публікації[51], автори визначили поняття «успішного старіння» як комбінацію наступних факторів, що повинні супроводжувати старіння:
1. Низька імовірність хвороб або інвалідності;
2. Високі можливості до навчання та фізичної діяльності;
3. Активне втягнення у життя суспільства.
Ці цілі можуть бути досягнуті як за допомогою суспільства, так і завдяки свідомим зусиллям старих людей з навчання та підтримки соціальних зв'язків, особливо з людьми молодшої вікової групи.
Омолодження та збільшення тривалості життя[ред. | ред. код]
Великою гілкою досліджень з геронтології (так звана біомедична геронтологія) є спроби збільшення тривалості життя, особливо людини. Помітне збільшення тривалості життя вже відбувається зараз на глобальному масштабі за допомогою таких факторів як загальне покращення медичного обслуговування і покращення рівня життя.
На рівні індивідуума омолодження біологічного віку і збільшення тривалості життя можливо за рахунок комплексного впливу на основні механізми старіння[52][53], що включає впровадження принципів здорового способу життя[54], раціонального харчування, регулярних фізичних вправ[55] та достатньої фізичної активності, використанню різноманітних методик та інструментів біохакінгу та омолодження, таких як біологічно активні добавки[56][57], різноманітні гаджети, лікування стовбуровими клітинами[58], методики обмеження калоражу (інтервальне голодування)[59], та запобігання потенційно токсичних факторів, таких як неякісне харчування, малорухливий спосіб життя, хронічний стрес[60], вживання алкоголю, паління.[54] Крім того, комплексне мультиомічне дослідження молекулярних цілей для омолоджувальної терапії[61][62], та потенційне впровадження в загальнодоступну практику регенеративної медицини та таких методик, як генотерапія[63][64][65], редагування генома[66], наномедицина, тканинна інженерія, включно з інженерією нервової тканини та друком органів, та інших, зможуть вивести омолодження та збільшення тривалості життя на новий рівень, не обмежений рамками в 120 років.
Наприклад, рандомізоване клінічне дослідження 2021 року 43 здорових людей у віці від 50 до 72 років показало, що 8 тижнів здорового способу життя — рослинна дієта, достатній та якісний сон, фізичні вправи та активне розслаблення, а також прийом пробіотиків та фітонутрієнтів — омолодили біологічний (епігенетичний) вік людей у середньому на 3.2 роки (p=0.018).[54]
Також у 2021 році було задокументовано омолодження епігенетичного віку людини на 5 років всього за 7 місяців, за допомогою щоденної різноманітної рослинної дієти (особливо горіхи, овочі, насіння, ягоди та несолодкі фрукти), великої кількості різних дієтичних добавок (колаген, креатин, спермідин, лецитин, амінокислоти, вітаміни[67], поліфеноли, глюкозамін та інші).[68][69][70]
Крім того є багато досліджень на тваринах, які показують значне зменшення біологічного віку у тварин.[58][63][65][71][72][73][74]
Користь для суспільства[ред. | ред. код]
Дослідження 2021 року[75], проведене Ендрю Дж. Скоттом (Лондонська школа бізнесу та фінансів), Девідом Сінклером (Гарвардська медична школа) і Мартіном Еллісоном (Оксфордський університет), оцінило цінність подовження тривалості життя, зменшення захворюваності та боротьби зі старінням. Вони оцінили економічну перспективу, використовуючи модель статистичної вартості життя (VSL), відкалібровану відповідно до поточних економічних, медичних і демографічних даних США. Дослідження показало, що уповільнення старіння зменшує швидкість біологічних пошкоджень, покращує здоров'я та зменшує смертність. Автори підрахували, що уповільнення старіння, яке збільшує середню тривалість життя всього на один рік, має цінність для суспільства в 38 трильйонів доларів США на кожен рік після продовження тривалості життя на 1 рік (на прикладі США). Ци приблизно півтора ВВП США, на рік.
Див. також[ред. | ред. код]
- Старіння людини
- Старість
- Геронтологія
- Механізми старіння
- Клітинне старіння
- Апоптоз
- Смерть
- Закон смертності Ґомпертца-Мейкгама
- Список країн за очікуваною тривалістю життя
- Популяційна динаміка старіння
- Максимальна тривалість життя
- Омолодження
- Сенолітик
Примітки[ред. | ред. код]
- ↑ а б в г д Aging. Encyclopedia Britannica (англійська) . Архів оригіналу за 29 вересня 2007. Процитовано 7 липня 2007.
- ↑ Gompertz curve. Wolfram MathWorld (англійська) . Архів оригіналу за 13 вересня 2007. Процитовано 7 липня 2007.
- ↑ Northern Cod -A Matter of Survival (англійська) . Архів оригіналу за 27 вересня 2007. Процитовано 31 липня 2007.
- ↑ Late-Life Mortality Deceleration, Mortality Levelling-off, Mortality Plateaus. Unraveling the Secrets of Human Longevity (англійська) . Архів оригіналу за 20 липня 2007. Процитовано 31 липня 2007.
- ↑ Angelos Economos (1979). A non-Gompertzian paradigm for mortality kinetic of metazoan animals and failure kinetics of manufactured products (PDF). Age (англійська) . 2: 74—76. Архів оригіналу (PDF) за 30 вересня 2007. Процитовано 31 липня 2007.
- ↑ а б Rose MR, Rauser CL, Mueller LD, Benford G (2006). A revolution for aging research. Biogerontology. 7 (4): 269—277. PMID 16612665.
- ↑ Bavestrello, Giorgio; Christian Sommer; Michele Sarà (1992). Bi-directional conversion in Turritopsis nutricula (Hydrozoa). Scientia Marina. 56 (2–3): 137—140.
- ↑ Piraino, Stefano; F. Boero; B. Aeschbach; V. Schmid (1996). Reversing the life cycle: medusae transforming into polyps and cell transdifferentiation in Turritopsis nutricula (Cnidaria, Hydrozoa). Biological Bulletin. 190 (3): 302—312. doi:10.2307/1543022. JSTOR 1543022. PMID 29227703.
- ↑ John R. Speakman (2005). Body size, energy metabolism and lifespan. Journal of Experimental Biology. 208: 1717—1730. PMID 15855403. Архів оригіналу за 7 серпня 2007. Процитовано 25 вересня 2007.
- ↑ Вчені зістарили мишу, а потім повернули їй молодість. Tokar.ua (uk-UA) . 2 серпня 2018. Архів оригіналу за 30 листопада 2018. Процитовано 30 листопада 2018.
- ↑ Some Animals Age, Others May Not. senescence.org (англійська) . Архів оригіналу за 16 липня 2007. Процитовано 7 липня 2007.
- ↑ Finch, C. E. (1990). The University of Chicago Press (ред.). Longevity, Senescence, and the Genome. Chicago and London. ISBN 0226248895.
- ↑ а б в г The Evolution of Aging (англійська) . Архів оригіналу за 30 червня 2007. Процитовано 25 вересня 2007.
- ↑ Martínez DE (1998). Mortality patterns suggest luck of senescence in Hydra (PDF). Experimental Gerontology (англійська) . 33: 217—225. PMID 9615920. Архів оригіналу (PDF) за 9 липня 2007. Процитовано 25 вересня 2007.
- ↑ а б Maximum Life Span of Some Plants and Animals. Microsoft Encarta (англійська) . Архів оригіналу за 9 жовтня 2007. Процитовано 25 вересня 2007.
- ↑ а б в Maximum Ages for Some Seed Plants. Encyclopedia Britannica (англійська) . Архів оригіналу за 15 лютого 2008. Процитовано 9 липня 2007.
- ↑ а б Life Span of some Medicinal Plants (PDF). Архів оригіналу (PDF) за 16 липня 2007. Процитовано 9 липня 2007.
- ↑ Thomas Howard та ін. (2003). Defining senescence and death. Journal of experimental botany (англійська) . 54 (385): 1127—1132. PMID 15936607.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ а б Leonard Guarente, Gary Ruvkun, and Richard Amasino (1998). Aging, life span, and senescence. PNAS (англійська) . 95 (19): 11034—11036. PMID 9736682.
- ↑ а б Bleecker, A. & Patterson, S. (1997). Senescence, Abscission, and Meristem Arrest in Arabidopsis. Plant Cell (англійська) . 9: 1169—1179. PMID 9254934.
- ↑ Nood, E., L. D. & Guiamet, J. J. в книзі Edward L. Schneider, John W. Rowe, Thomas E. Johnson, Nikkij Holbrook, John Morrison, ред. (1996). Handbook of the Biology of Aging (вид. 4th). Academic Press. с. 194—118. ISBN 0126278733.
- ↑ а б в г Peter Laun та ін. (2006). Yeast as a model for chronological and reproductive aging – A comparison. Experimental gerontology. 41: 1208—1212. PMID 17126512.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ а б Martin Ackermann та ін. (2003). Senescence in a Bacterium with Asymmetric Division. Science. 300. PMID 12817142.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Eric J. Stewart та ін. (2005). Aging and Death in an Organism That Reproduces by Morphologically Symmetric Division. PLoS Biology. 3 (2): e45. PMID 15685293.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Dukan S, Nyström T (1998). Bacterial senescence: stasis results in increased and differential oxidation of cytoplasmic proteins leading to developmental induction of the heat shock regulon. Genes and Development. 12: 3431—3441. PMID 9808629. Архів оригіналу за 27 вересня 2007. Процитовано 7 липня 2007.
- ↑ Thomas Nystroem (2005). Bacterial senescence, Programmed Death, and Premeditated sterility (PDF). ASM News. 71 (8): 363. Архів оригіналу (PDF) за 29 лютого 2008. Процитовано 7 липня 2007.
- ↑ Tohru Minamino, Issei Komuro (2007). Critical Roles of Insulin-Induced Senescence in Diabetic Vasculopathy. Vascular Disease Prevention. 4 (3): 194—200. PMID 16574905. Архів оригіналу за 12 червня 2018. Процитовано 25 вересня 2007.
- ↑ Ryley J, Pereira-Smith OM (2006). Microfluidics device for single cell gene expression analysis in Saccharomyces cerevisiae. Yeast (англійська) . 23 (14-15): 1065—73. PMID 17083143. Архів оригіналу за 23 жовтня 2007. Процитовано 11 липня 2007.
- ↑ а б Thomas Nyström (2003). Conditional senescence in bacteria:death of the immortals. Molecular Microbiology. 48 (1): 17—23. PMID 12657042.
- ↑ Weissmann A. (1889). Oxford Clarendon Press (ред.). Essays upon Heredity and Kindred Biological Problems. Т. 1.
- ↑ а б Medawar P.B. (1952). Lewis (ред.). An Unresolved Problem in Biology. London.
- ↑ Finch C. (1990). The University of Chicago Press (ред.). Senescence, Longevity, and the Genome. ISBN 0226248887.
- ↑ Robin Holliday (2006). Aging is No Longer an Unresolved Problem in Biology. Annals of New York Academy of Sciences (англійська) . 1067: 1—9. PMID 16803964.
- ↑ Leonard Hayflick (2007). Biological Aging is No Longer an Unresolved Problem. Annals of New York Academy of Sciences (англійська) . 1100: 1—13. PMID 17460161.
- ↑ а б в г д Thomas B.L. Kirkwood (2005). Understanding the Odd Science of Aging. Cell (англійська) . 120: 437—447. PMID 15734677.
- ↑ а б Williams G.C. (1957). Pleiotropy, natural selection, and the evolution of senescence. Evolution. 11: 398—411.
- ↑ Shaw F.H., Promislow D.E.L., Tatar M., Huges K.A., Geyes C.J. (1999). Toward reconciling inferences concerning genetic variation in senescence in Drosophila melamogaster. Genetics (англійська) . 152: 553—566. PMID 10353899.
- ↑ Leroi A.M., Barke A., De Benedictics G., Francecshi C., Gartner A., Feder M.E., Kivisild T., Lee S., Kartal-Ozer N. та ін. (2005). What evidence is there for the existence of individual genes with antagonistic pleiotropic effects?. Mech. Ageing Dev. (англійська) . 126: 421—429. PMID 15664630.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Kirkwood T.B.L. (1977). Evolution of ageing. Nature (англійська) . 270: 301—304. PMID 593350.
- ↑ Burke A. (2001). Physiology and pathophysiology of poly(ADP-rebosyl)ation. Bioessays (англійська) . 23: 795—806. PMID 11536292.
- ↑ Carrard G., Bulteau A.L., Petropoulos I., Friguet B. (2002). Impairment of proteasome structure and function in aging. International journal of Biochemistry and Cell Biology (англійська) . 34: 1461—1474. PMID 12200039.
- ↑ Soti C. and Csermely P. (2003). Aging and molecular chaperones. Experimental Gerontology (англійська) . 38: 1037—1040. PMID 14580856.
- ↑ Wallace D.C. (1999). Mitochondrial diseases in man and mouse. Science (англійська) . 283: 1482—1488. PMID 10066162.
- ↑ Von Zglinicki T. (2002). Oxidative stress shortens telomeres. Trends in biochemical sciences (англійська) . 27: 339—344. PMID 12114022.
- ↑ а б Новосельцев В. Н., Новосельцева Ж. А., Яшин А.И. (2003). Математическое моделирование в геронтологии - стратегические перспективы. Успехи геронтологии (російська) . 12: 149—165. PMID 14743613.
- ↑ Mueller L. D., Rose M. R. (1996). Evolutionary theory predicts late-life mortality plateaus. Proceedings of the National Academy of Sciiences of the USA. 93: 15249—15253. PMID 8986796.
- ↑ Gavrilov LA, Gavrilova NS (2006). Academic Press (ред.). Reliability Theory of Aging and Longevity (PDF) (вид. Sixth Edition). San Diego, CA, USA. с. 3—42. ISBN 0-12-088387-2. Архів оригіналу (PDF) за 20 липня 2007. Процитовано 20 липня 2007.
{{cite book}}: Проігноровано|work=(довідка) - ↑ Tyner S.D., Venkatachalam S., Choi J., Jones S., Ghebranious N., Igelmann H., Lu X., Soron G., Gooper B., Brayton C. та ін. (2002). p53 mutant mice that display early aging-associated phenotypes. Nature. 415: 45—53. PMID 12115733.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ В странах СНГ ожидаемая продолжительность жизни при рождении не достигает 74 лет... Демоскоп Weekly (російська) . Архів оригіналу за 11 вересня 2007. Процитовано 15 липня 2007.
- ↑ Rowe, J.D. & Kahn, R.L. (1987). Human ageing: Usual and successful. Science. 237: 143—149.
- ↑ Rowe, J.D. & Kahn, R.L. (1997). Successful ageing. The Gerontologist. 37 (4): 433—440.
- ↑ López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (6 червня 2013). The Hallmarks of Aging. Cell (English) . Т. 153, № 6. с. 1194—1217. doi:10.1016/j.cell.2013.05.039. ISSN 0092-8674. Процитовано 19 березня 2023.
- ↑ Cohen, Alan A.; Ferrucci, Luigi; Fülöp, Tamàs; Gravel, Dominique; Hao, Nan; Kriete, Andres; Levine, Morgan E.; Lipsitz, Lewis A.; Olde Rikkert, Marcel G. M. (2022-07). A complex systems approach to aging biology. Nature Aging (англ.). Т. 2, № 7. с. 580—591. doi:10.1038/s43587-022-00252-6. ISSN 2662-8465. Процитовано 19 березня 2023.
- ↑ а б в Fitzgerald, Kara N.; Hodges, Romilly; Hanes, Douglas; Stack, Emily; Cheishvili, David; Szyf, Moshe; Henkel, Janine; Twedt, Melissa W.; Giannopoulou, Despina (12 квітня 2021). Potential reversal of epigenetic age using a diet and lifestyle intervention: a pilot randomized clinical trial. Aging (англ.). Т. 13, № 7. с. 9419—9432. doi:10.18632/aging.202913. ISSN 1945-4589. PMID 33844651. Процитовано 29 листопада 2022.
- ↑ Carapeto, Priscila Viana; Aguayo-Mazzucato, Cristina (13 травня 2021). Effects of exercise on cellular and tissue aging. Aging. Т. 13, № 10. с. 14522—14543. doi:10.18632/aging.203051. ISSN 1945-4589. PMC 8202894. PMID 34001677. Процитовано 19 березня 2023.
- ↑ Sekhar, Rajagopal V (1 грудня 2021). GlyNAC Supplementation Improves Glutathione Deficiency, Oxidative Stress, Mitochondrial Dysfunction, Inflammation, Aging Hallmarks, Metabolic Defects, Muscle Strength, Cognitive Decline, and Body Composition: Implications for Healthy Aging. The Journal of Nutrition (англ.). Т. 151, № 12. с. 3606—3616. doi:10.1093/jn/nxab309. ISSN 0022-3166. Процитовано 19 березня 2023.
- ↑ Soma, Mounica; Lalam, Satya Kumar (2022-10). The role of nicotinamide mononucleotide (NMN) in anti-aging, longevity, and its potential for treating chronic conditions. Molecular Biology Reports. Т. 49, № 10. с. 9737—9748. doi:10.1007/s11033-022-07459-1. ISSN 1573-4978. PMID 35441939. Процитовано 19 березня 2023.
- ↑ а б Chang, Le; Fan, Weiwen; Pan, Xinghua; Zhu, Xiangqing (20 квітня 2022). Stem cells to reverse aging. Chinese Medical Journal (амер.). Т. 135, № 8. с. 901. doi:10.1097/CM9.0000000000001984. ISSN 0366-6999. PMC 9276428. PMID 35089883. Процитовано 19 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Green, Cara L.; Lamming, Dudley W.; Fontana, Luigi (2022-01). Molecular mechanisms of dietary restriction promoting health and longevity. Nature Reviews Molecular Cell Biology (англ.). Т. 23, № 1. с. 56—73. doi:10.1038/s41580-021-00411-4. ISSN 1471-0080. PMC 8692439. PMID 34518687. Процитовано 19 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Poganik, Jesse R.; Zhang, Bohan; Baht, Gurpreet S.; Tyshkovskiy, Alexander; Deik, Amy; Kerepesi, Csaba; Yim, Sun Hee; Lu, Ake T.; Haghani, Amin (21 квітня 2023). Biological age is increased by stress and restored upon recovery. Cell Metabolism (англ.). doi:10.1016/j.cmet.2023.03.015. ISSN 1550-4131. Процитовано 23 квітня 2023.
- ↑ Mavromatis, Lucas A.; Rosoff, Daniel B.; Bell, Andrew S.; Jung, Jeesun; Wagner, Josephin; Lohoff, Falk W. (19 квітня 2023). Multi-omic underpinnings of epigenetic aging and human longevity. Nature Communications (англ.). Т. 14, № 1. с. 2236. doi:10.1038/s41467-023-37729-w. ISSN 2041-1723. PMC 10115892. PMID 37076473. Процитовано 14 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Aging Atlas Consortium; Liu, Guang-Hui; Bao, Yiming; Qu, Jing; Zhang, Weiqi; Zhang, Tao; Kang, Wang; Yang, Fei; Ji, Qianzhao (8 січня 2021). Aging Atlas: a multi-omics database for aging biology. Nucleic Acids Research (англ.). Т. 49, № D1. с. D825—D830. doi:10.1093/nar/gkaa894. ISSN 0305-1048. PMC 7779027. PMID 33119753. Процитовано 14 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б Macip, Carolina Cano; Hasan, Rokib; Hoznek, Victoria; Kim, Jihyun; Metzger, Louis E.; Sethna, Saumil; Davidsohn, Noah (5 січня 2023). Gene Therapy Mediated Partial Reprogramming Extends Lifespan and Reverses Age-Related Changes in Aged Mice (англ.). с. 2023.01.04.522507. doi:10.1101/2023.01.04.522507v1.full. Процитовано 19 березня 2023.
- ↑ Sewell, Patrick E (8 листопада 2021). Safety Study of AAV hTert and Klotho Gene Transfer Therapy for Dementia. Journal of Regenerative Biology and Medicine (англ.). doi:10.37191/Mapsci-2582-385X-3(6)-097. ISSN 2582-385X. Процитовано 14 червня 2023.
- ↑ а б Lu, Yuancheng; Brommer, Benedikt; Tian, Xiao; Krishnan, Anitha; Meer, Margarita; Wang, Chen; Vera, Daniel L.; Zeng, Qiurui; Yu, Doudou (2020-12). Reprogramming to recover youthful epigenetic information and restore vision. Nature (англ.). Т. 588, № 7836. с. 124—129. doi:10.1038/s41586-020-2975-4. ISSN 1476-4687. PMC 7752134. PMID 33268865. Процитовано 19 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Wang, Wei; Zheng, Yuxuan; Sun, Shuhui; Li, Wei; Song, Moshi; Ji, Qianzhao; Wu, Zeming; Liu, Zunpeng; Fan, Yanling (6 січня 2021). A genome-wide CRISPR-based screen identifies KAT7 as a driver of cellular senescence. Science Translational Medicine. Т. 13, № 575. с. eabd2655. doi:10.1126/scitranslmed.abd2655. ISSN 1946-6242. PMID 33408182. Процитовано 19 березня 2023.
- ↑ Baker, Laura D.; Manson, Joann E.; Rapp, Stephen R.; Sesso, Howard D.; Gaussoin, Sarah A.; Shumaker, Sally A.; Espeland, Mark A. (14 вересня 2022). Effects of cocoa extract and a multivitamin on cognitive function: A randomized clinical trial. Alzheimer's & Dementia (англ.). с. alz.12767. doi:10.1002/alz.12767. ISSN 1552-5260. Процитовано 29 листопада 2022.
- ↑ https://twitter.com/maxhertan/status/1595213398358171649. Twitter (англ.). Процитовано 26 листопада 2022.
- ↑ blueprint. blueprint.bryanjohnson.co (англ.). Процитовано 19 березня 2023.
- ↑ How to Be 18 Years Old Again for Only $2 Million a Year. Bloomberg.com (англ.). 25 січня 2023. Процитовано 19 березня 2023.
- ↑ Browder, Kristen C.; Reddy, Pradeep; Yamamoto, Mako; Haghani, Amin; Guillen, Isabel Guillen; Sahu, Sanjeeb; Wang, Chao; Luque, Yosu; Prieto, Javier (2022-03). In vivo partial reprogramming alters age-associated molecular changes during physiological aging in mice. Nature Aging (англ.). Т. 2, № 3. с. 243—253. doi:10.1038/s43587-022-00183-2. ISSN 2662-8465. Процитовано 19 березня 2023.
- ↑ Yang, Jae-Hyun; Hayano, Motoshi; Griffin, Patrick T.; Amorim, João A.; Bonkowski, Michael S.; Apostolides, John K.; Salfati, Elias L.; Blanchette, Marco; Munding, Elizabeth M. (19 січня 2023). Loss of epigenetic information as a cause of mammalian aging. Cell (English) . Т. 186, № 2. с. 305—326.e27. doi:10.1016/j.cell.2022.12.027. ISSN 0092-8674. PMID 36638792. Процитовано 19 березня 2023.
- ↑ Parker, Aimée; Romano, Stefano; Ansorge, Rebecca; Aboelnour, Asmaa; Le Gall, Gwenaelle; Savva, George M.; Pontifex, Matthew G.; Telatin, Andrea; Baker, David (29 квітня 2022). Fecal microbiota transfer between young and aged mice reverses hallmarks of the aging gut, eye, and brain. Microbiome. Т. 10, № 1. с. 68. doi:10.1186/s40168-022-01243-w. ISSN 2049-2618. PMC 9063061. PMID 35501923. Процитовано 19 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Juricic, Paula; Lu, Yu-Xuan; Leech, Thomas; Drews, Lisa F.; Paulitz, Jonathan; Lu, Jiongming; Nespital, Tobias; Azami, Sina; Regan, Jennifer C. (2022-09). Long-lasting geroprotection from brief rapamycin treatment in early adulthood by persistently increased intestinal autophagy. Nature Aging (англ.). Т. 2, № 9. с. 824—836. doi:10.1038/s43587-022-00278-w. ISSN 2662-8465. Процитовано 19 березня 2023.
- ↑ Andrew J. Scott, David A. Sinclair, Martin Ellison (8 січня 2021). All’s Well That Ages Well: The Economic Value of Targeting Aging (PDF). https://www.nature.com/articles/s43587-021-00080-0 (eng) . Nature Aging. doi:10.1038/s43587-021-00080-0.
Література[ред. | ред. код]
Наукові журнали[ред. | ред. код]
- Nature Aging
- Aging Cell
- Aging Research Reviews
- GeroScience
- Age and Ageing
- The Journal of Gerontology
- Neurobiology of Aging
- Frontiers in Aging Neuroscience
- Mechanisms of Aging and Development
- Experimental Gerontology
- Biogerontology
- Aging Clinical and Experimental Research
Книги[ред. | ред. код]
- The Longevity Code: Slow Down the Aging Process and Live Well for Longer—Secrets from the Leading Edge of Science / Kris Verburgh, The Experiment, New York, 2019. ISBN 1615194975 & ISBN 9781615194971.
- Життєвий план: Чому ми старіємо і як цього уникнути / Девід Сінклер, Метью Лаплент, вид. BookChef, 2021. ISBN 978-966-993-576-2
Ключові статті[ред. | ред. код]
- Hallmarks of aging: An expanding universe. / López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (19 січня 2023). Cell (English) 186 (2). С.243–278. DOI:10.1016/j.cell.2022.11.001
- The Hallmarks of Aging. / López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido. (2013). Cell 153 (6). с.1194–1217. ISSN 0092-8674. DOI:10.1016/j.cell.2013.05.039
- A complex systems approach to aging biology / Cohen, A.A., Ferrucci, L., Fülöp, T. et al. (2022). Nat Aging 2, 580–591. DOI:10.1038/s43587-022-00252-6
Окремі теорії[ред. | ред. код]
- Theodore Goldsmith. The Evolution of Aging. (Стаття, що захищає «Теорію запрограмованої смерті» або «Еволюційну теорію» виникнення старіння.) (англ.)
- Evolutionary Theories of Aging and Longevity [Архівовано 9 серпня 2007 у Wayback Machine.] (Огляд еволюційного підходу до старіння.) (англ.)
- The Reliability Theory of Aging and Longevity [Архівовано 20 липня 2007 у Wayback Machine.] (Стаття про «Теорію надійності» виникнення старіння.) (англ.)
- Leonard Hayflick (2007). Biological Aging Is No Longer an Unsolved Problem. Annals of the New York academy of Sciences. 1100: 1—13. Архів оригіналу за 6 липня 2007. Процитовано 20 липня 2007. (Стаття проти еволюційної теорії, написана Леонардом Гейфліком, відкривачем межі Гейфліка, колишнім головою Геронтологічного Інституту США та засновником Національного Інституту Старіння США.) (англ.)
- Thomas Nystrom (2003). Conditional senescence in bacteria:death of the immortals. Molecular Microbiology. 48.[недоступне посилання з травня 2019] (Огляд умовного старіння бактерій.) (англ.)
- Peter Launa та ін. (2006). Yeast as a model for chronological and reproductive aging – A comparison. Experimental Gerontology. 41 (12): 1208—1212.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка)[недоступне посилання з вересня 2019] (Огляд старіння дріжджів.) (англ.)
Енциклопедії[ред. | ред. код]
- Microsoft Encarta: Aging, Life Span (англ.)
- Encyclopaedia Britannica : Aging , Life Span
Посилання[ред. | ред. код]
Організації, списки ресурсів[ред. | ред. код]
- Люди (науковці та дослідники), що займаються проблематикою старіння та омолодження
- Компанії, що займаються проблематикою старіння та омолоджння
- Lifespan.io — некомерційна організація, яка займається сприянням подовженню здорової тривалості життя людини. Містить багато акутальних досліджень.
- Основні гіпотези старіння [Архівовано 2 лютого 2014 у Wayback Machine.] (укр.);
- Biologicalgerontology.com [Архівовано 27 квітня 2006 у Wayback Machine.] Ресурси щодо біології старіння та збільшення тривалості життя.) (англ.)
- Unraveling the Secrets of Human Longevity [Архівовано 17 липня 2007 у Wayback Machine.] (Ресурси щодо біології старіння та збільшення тривалості життя.) (англ.)
- Senescence.info [Архівовано 5 січня 2010 у Wayback Machine.] (Ресурси щодо біології старіння.) (англ.)
- Cellular Senescence Information Center (Ресурси щодо клітинного старіння.) (англ.)
- American Academy of Anti-Aging Medicine [Архівовано 15 липня 2007 у Wayback Machine.] (Американська Асоціація Медицини проти Старіння.) (англ.)
- American Federation for Aging Research [Архівовано 14 листопада 2007 у Wayback Machine.] (Американська Асоціація Дослідження Старіння.) (англ.)
- Aging Research Centre (ARC) [Архівовано 21 лютого 2010 у Wayback Machine.] (Центр Дослідження Старіння.) (англ.)
- See the artproject «Dialogue with the High Age» [Архівовано 8 листопада 2007 у Wayback Machine.]
|
|
Ця стаття належить до вибраних статей Української Вікіпедії. |
|
|
Ця стаття належить до добрих статей української Вікіпедії. |
|

![{\displaystyle s(x)=exp[-m(b^{x}-1)]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c26ed314af895c5a482ff82d45685acbacc6a108)

