Фотосистема II
| Ця стаття є сирим перекладом з іншої мови. Можливо, вона створена за допомогою машинного перекладу або перекладачем, який недостатньо володіє обома мовами. (липень 2015) |

Фотосистема II (друга фотосистема, фотосистема два, ФСІІ), або H2O-пластохіноноксідоредуктаза — перший функціональний комплекс електрон-транспортного ланцюга (ЕТЛ) хлоропластів. Він розташований в мембранах тилакоїдів усіх рослин, водоростей і ціанобактерій. Поглинаючи енергію світла в ході первинних фотохімічних реакцій, він формує сильний окисник — димер хлорофілу а (П680+), який через ланцюг окисно-відновних реакцій здатний викликати окиснення води.
Окиснюючи воду, фотосистема II постачає електрони до ЕТЛ хлоропласту, де вони використовуються для відновлення НАДФ+ або циклічного фосфорилювання. Окрім цього, окиснення води призводить до утворення протонів і формування протонного градієнту, використовуваного надалі для синтезу АТФ[1]. Фотохімічне окиснення води, яке здійснює фотосистема II, супроводжується виділенням молекулярного кисню. Завдяки цьому процесу рослинний фотосинтез є основним джерелом кисню на Землі.
Історія відкриття[ред. | ред. код]
Реакційний центр ФСІІ був виділений 1971 року Л. Верноном. У вивченні його структурної організації особливий внесок внесли дослідження Г. Т. Вітта (1962), в яких методом диференціальної спектрофотометрії був виділений пігмент П680, і лабораторії О. А. Красновський (В. В. Климов, В. А. Шувалов, О. А. Красновський, 1977), в яких методом імпульсної спектроскопії був знайдений первинний акцептор реакційного центру II — феофітин[2]. Протягом декількох десятиріч різні групи дослідників намагалися визначити просторову структуру компонентів, що складають комплекс фотосистеми II. У підсумку методом рентгеноструктурного аналізу 2001 року А. Зоуні з колегами уперше вдалося отримати просторову структуру ФСІІ з ціанобактерії Synechococcus elongatus із роздільною здатністю 3,8 Å. При цьому фермент був в активній формі, тобто ФСІІ у кристалічній формі розщеплювала воду під впливом світла[3].
Відмінності від фотосистеми I[ред. | ред. код]
Основна функція фотосистеми II — генерація сильного окиснювача, який індукує процес окиснення води і перенесення її електронів на мембранний переносник[en]. Основна функція фотосистеми I — наситити ці низькорівневі електрони й енергією, щоб за їхньою допомогою здійснити відновлення НАДФ+. Оскільки енергія сумарного процесу занадто велика, щоб здійснити його в рамках одного реакційного центру, в ході еволюції з'явилися дві фотосистеми, які роздільно здійснюють різні частини цієї реакції. Їхні специфічні функції якраз визначають особливості їхньої будови. Так, фотосистема I симетрична, тобто в ній працюють дві гілки електронного транспорту, що робить його значно швидшим, тим часом як фотосистема II асиметрична і володіє тільки однією робочою гілкою, що вповільнює транспорт електронів, але робить його керованішим. Обидві фотосистеми значно відрізняються за будовою антен, додатковими субодиницями, способами регуляції і положенням у мембрані[4]. Отже, фотосистема I володіє інтегральною антеною, хлорофіли якої розташовані безпосередньо на головних білках комплексу — А і B, тим часом як у фотосистеми II вони винесені на зовнішні білки CP47 і CP43. За кількістю додаткових малих регуляторних субодиниць ФСІІ значно перевершує ФС, що пов'язано з необхідністю тонкої регуляції процесу окиснення води, який є потенційно вкрай небезпечним для клітини. Цим же пояснюється неоднорідний розподіл фотосистем у мембрані тилакоїду: ФС розташовується переважно в області маргінальних, торцевих і стромальних[en] мембран, а ФСІІ практично повністю знаходиться в області спарених мембран, що забезпечує клітці додатковий захист від продукованих нею активних форм кисню.
Головна відмінність фотосистеми II від фотосистеми I — це наявність великого зверненого в люмен домену, який складається з марганцевого кластера та оточувальних його захисних білків. Саме тут відбувається процес фотохімічного окиснення води, супроводжуваний виділенням кисню і протонів[4].
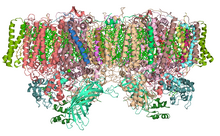
Структурна організація фотосистеми II[ред. | ред. код]
 | |
| Ідентифікатори | |
|---|---|
| Код КФ | 1.10.3.9 |
| Бази ферментів | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Пошук | |
| PMC | статті |
| PubMed | статті |
| NCBI | NCBI proteins |
Фотосистема II складається з наступних білкових субодиниць і кофакторів[7][8][9][10]:

| Субодиниці | Опис |
|---|---|
| D1 | 32 кДа, інтегральний коровий білок, несе три хлорофіла а і один β-каротин |
| D2 | 33 кДа, інтегральний коровий білок, несе три хлорофіла а і один β-каротин |
| B(CP47) | 47 кДа, близько 510 амінокислот, пов'язує 16 молекул хлорофілу і 5 молекули β-каротину, інтегральна антена ФСІІ, люмінальний домен зв'язується з марганцевим кластером |
| C(CP43) | 43 кДа, близько 470 амінокислот, пов'язує близько 13 молекул хлорофілу і 5 молекули β-каротину, інтегральна антена ФСІІ, гомологічний B (CP47), менш щільно пов'язаний з ядром ФСІІ, що може грати важливу роль при репарації після фотодеструкції |
| E | 9 кДа, у вищих рослин близько 81 амінокислот, α-субодиниця цитохрома b[en]559 |
| F | 4 кДа, у вищих рослин близько 38 амінокислот, β-субодиниця цитохрому b559 |
| H | 7,7 кДа, мабуть, грає роль у регуляції перенесення електрона з QA на QB, стабілізується CP47 і CP43 |
| I | 4,8 кДа, мало різниться у різних видів, необхідний для складання і функціонування ФСІІ, сприяє утворенню димера фотосистем |
| J | 4,2 кДа, важлива для збірки ФСІІ, регулює потік електронів на пул пластохинонів |
| K | 4,1 кДа, у всіх оксигенних організмів, дуже консервативна, утворення димера ФСІІ, стабілізує ядро фотосистеми |
| L | 4,3 кДа, необхідний для роботи сайту Qa, запобігає повернення електрона з сайту Qb на Qa |
| M | 4,7 кДа, у всіх оксигенних організмів, стабілізує димер ФСІІ |
| O | 27 кДа, захищає ВОК, пов'язує іон кальцію |
| P | 20 кДа, немає у ціанобактерій, захищає ВОК, регулює іонне оточення |
| Q | 17 кДа, немає у ціанобактерій, захищає ВОК, регулює іонне оточення |
| R | 12,8 кДа, відіграє роль якоря, пов'язуючи субодиницю P і стабілізуючи її |
| S | 22 кДа, відсутня у ціанобактерій, бере участь у нефотохімічному гасінні СЗКІІ |
| T(Tc) | 3,8 кДа, стабілізує сайт Qa, стабілізує димер |
| T(Tn) | 3 кДа, тільки у рослин і водоростей, має бісульфідний місток, знаходиться в люмені, функція невідома |
| U | 10 кДа, тільки у ціанобактерій, бурих і червоних водоростей, розташована в люмені, можливо поставляє іони кальцію і хлору роботи ВОК, зв'язується з ФСІІ через субодиницю O або V |
| V | 12,1 кДа тільки у ціанобактерій, бурих і червоних водоростей, відома як цитохром c550, несе гем, оптимізує роботу ВОК |
| W | 6,1 кДа, тільки у рослин і водоростей, бере участь в утворенні димеру, збірці і репарації ФСІІ |
| X | 4,2 кДа, функція невідома |
| Y | 4,7 кДа, функція невідома |
| Z | 6,5 кДа, забезпечує взаємодію з тримером СЗКІІ |
| Пігменти | |
| Хлорофіл a | 35 молекул в антенній системі |
| Хлорофіл a | 2 молекули супроводжувальних хлорофілів (ХлD,ХлZ) |
| Хлорофіли а й a' | спеціальна пара П680 |
| β-каротин | 12 молекул |
| Коферменти/Кофактори | |
| Гем b559 | Протопорфірин IX, що містить атом заліза |
| Феофітин | Первинний акцептор електронів |
| Пластохінон | Мобільний переносник електронів |
| Марганцевий кластер | Також відомий як водоокиснювальний комплекс або ВОК |
| Fe2+ | Здійснює перенос електрона від QA до QB |
| Ca2+ | іон кальцію |
| Cl- | іон хлору |
| HCO3- | гідрокарбонат аніон |
В еукаріотів більшість малих субодиниць, а також субодиниць, що оточують водоокиснювальний комплекс (ВОК) — psbO, psbP, psbQ, psbR, psbS, psbTn, psbW, psbX, psbZ — кодуються в ядрі. Там же знаходяться гени сімейства cab, що кодують білки світлозбирального комплексу II (СЗКІІ). Такий спосіб розподілу генів, коли великі корові субодиниці білка залишаються у хлоропласті, а відносно малі субодиниці, що виконують регуляторні функції, переносяться до ядра, дозволяє еукаріотичній клітці краще контролювати процес фотосинтезу і допомагає скоординувати роботу двох геномів[11].
Субодиниця G була виключена зі списку субодиниць фотосистеми II, оскільки було показано, що вона кодується геном ndh, який відповідальний за синтез фередоксин-НАДФ+-редуктази[en], а відтак, не є частиною фотосистеми II[11]. Субодиниця N, розташована в тому ж опероні, що і psbB, як виявилося, не є частиною комплексу фотосистеми II, проте знаходиться в мембрані тилакоїду і здійснює збірку і організацію її реакційного центру та інших субодиниць, що входять у коровий комплекс[12]. Сумнівів викликає і субодиниця S, яка відсутня в суперкомплексі ФСІІ-СЗКІІ, проте це питання залишається спірним, оскільки надходять повідомлення, що її можна виявити в димері ФСІІ[8].
За останнє десятиріччя було відкрито безліч додаткових білків, що беруть участь у роботі фотосистеми II. Так, Psb27 грає важливу роль у репарації і організації марганцевого кластера, Psb28 бере участь у біогенезі CP47, Psb29 — у біогенезу ФСІІ в арабідопсиса і Synechocystis[en], Psb30 широко поширений в геномах фотосинтезувальних організмів і необхідний для стабільної роботи ФСІІ, а Psb31 був виявлений у водоокиснювальному комплексі діатомової водорості Chaetoceros gracilis[13]. Для деяких з цих білків було показано, що вони зв'язуються зі зрілою фотосистемою II або приєднуються до неї на певних етапах її дозрівання і збирання, але наразі немає переконливих доказів, що дозволяють стверджувати, що вони є конститутивною частиною цього білкового комплексу. Процес виділення і дослідження малих субодиниць ФСІІ вкрай утруднений через їхню малу молекулярну масу, велику гідрофобність і відсутність явно вираженої кислотності-основності. З цієї, а також з ряду інших причин, досі не існує єдиної моделі будови фотосистеми II[8].
Окисно-відновні (редокс) агенти, які беруть участь в транспорті електронів, розташовуються в центральній частині — ядрі — комплексу ФСІІ і пов'язані з інтегральними білками D1 і D2. Вони мають дуже високий ступінь гомології один з одним за первинним амінокислотним складом, а також з L- і M-поліпептидами реакційного центру пурпурових бактерій. Цікаво відзначити, що, на відміну від вищих рослин і водоростей, в яких D1 і D2 представлені тільки однією копією на геном, у деяких ціанобактерій може бути кілька копій D1 і D2, по-різному експресованих в залежності від зовнішніх умов[11]. Білки утворюють по п'ять трансмембранних α-спіралей, амінокислотні залишки яких пов'язують компоненти реакційного центру ФСІІ, наприклад, на цих білках організований димер П680. Крім того, кожен з білків приєднує ще по три молекули хлорофілу a (додаткові та супроводжуючі хлорофіли), молекулу феофітину а, β-каротин і пластохінон (QA пов'язаний з білком D2, а QB — з білком D1). Між QA і QB знаходиться іон двовалентного заліза, в координації якого беруть участь обидва інтегральних білка. Люменальний домен пептиду D1 приєднує чотири іона марганцю і формує марганцевий кластер. Окрім білків D1 і D2, до складу ядра ФСІІ входять білки CP47 і CP43 (пов'язують ХлZ і ХлD, розташовані між П680 і феофітинами), які складають внутрішню антену, а також цитохром b559. Подібно реакційному центру пурпурових бактерій, у фотосистемі II, зважаючи на її асиметричність, працює тільки одна гілка електронного транспортування, розташована на білку D1. Сутність явища асиметрії полягає в тому, що редокс-агенти утворюють різну кількість водневих зв'язків на білках D1 і D2. Це впливає на їх окисно-відновний потенціал і унеможливлює прямий транспорт електронів через білок D2[10].
Оптимізацію роботи водоокиснювального комплексу забезпечують три гідрофільних білка: P, Q і O (O, V і U у ціанобактерій). Вони складають периферійний домен фотосистеми II. Ця група білків, звана білками водоокиснювального комплексу, розташовується на люменальній стороні мембрани поблизу марганцевого кластера і грає структурну, захисну і регуляторну роль у процесі окиснення води. Білок O впливає на стан марганцевого кластера, а два інших білка важливі для створення в його області необхідних для окислення води концентрації іонів кальцію і хлора. Хоча переважна кількість білків обох фотосистем майже повністю складається з α-спіралей, субодиниці P, Q і O, навпаки збагачені β-структурами, що робить їх міцнішими і стійкішими до окиснення[10].
Білок ядра фотосистеми I А гомологічний білкам D1+СP43 (молекулярна маса білка А відповідає сумі молекулярних мас білків D1 і СP43) з фотосистеми II, а білок В гомологічний білкам D2+CP47 відповідно[14].
Tyrz[ред. | ред. код]
Tyrz — залишок тирозину білка D1 (Tyr-161). Це проміжний переносник електронів, що переносить електрони між марганцевим кластером і П680. Перенесення електронів відбувається з утворенням нейтрального радикала (Tyrz•)[10].
Спеціальна пара П680[ред. | ред. код]
П680, в англійській літературі P680 (від англ. pigment — пігмент) — це пара хлорофілів a, з максимумом поглинання при довжині хвилі в 680 нм. Поглинаючи енергію світла, вона віддає один електрон на феофітин, а сама окиснюється і стає сильним окиснювачем П680+ з окисно-відновним потенціалом +1,12 В[15], що дозволяє їй індукувати процес окиснення води, потенціал якої +0,8 В. Тим же часом редокс-потенціал фотозбудженого П680 перебуває в негативній області (менше -0,6 В). На відміну від спеціальної пари фотосистеми I і пари бактеріофілів у фотосистемі пурпурових бактерій, в П680 хлорофіли знаходяться на значно більшій відстані (5,2 Å проти 3,6 Å в П700 і 3,5 Å у П870), а їх площини дещо нахилені відносно один одного, що значно знижує енергію екситонного сполучення та уповільнює швидкість захоплення енергії світла, що своєю чергою робить повільнішим процес поділу зарядів на парі хлорофілів. Повільна швидкість захоплення енергії дозволяє регулювати рівні збудження в антені ФСІІ, що захищає реакційний центр від фотоінгібування[16]. Фотосистема II, так само як і реакційний центр пурпурових бактерій, асиметрична, і дві молекули в димері нееквівалентні. Одна молекула хлорофілу а (П1) утворює водневі зв'язки з амінокислотами білка D1 за допомогою кетоетрних груп у C9 і C10 положеннях, а друга молекула хлорофілу а (П2) утворює лише один водневий зв'язок. Оскільки П1 утворює більшу кількість водневих зв'язків, його редокс-потенціал вище і електронрушійна сила більша. У момент порушення димера електрон переходить від П2 до молекули хлорофілу П1 і утворюється диполь. Через виникнення локального електричного поля відбувається зміна конформації спеціальної пари, що полегшує подальше перенесення електрона на феофітин, а позитивний заряд локалізується на одному з хлорофілів[17].
- Відповідно з наступним рівнянням П680 переходить у збуджений стан, поглинаючи квант світла або через перенесення енергії збудження від інших хлорофілів фотосистеми II, в результаті чого один з його електронів переходить з основного підрівня S0 на перший синглетний підрівень S1:
Феофітин[ред. | ред. код]
Феофітин — перший акцептор електронів у фотосистемі II. Саме тут, між феофітином (Eо‘ = –0,53 В) і фотозбудженим пігментом П680, відбувається первинне фотохімічне розділення зарядів. Перенесення електрону здійснюється протягом декількох пікосекунд[18].
- Фотозбуджений П680* віддає один електрон феофітину, в результаті чого відбувається поділ зарядів, і утворюється первинна радикальна пара:
Пластохінон QA і QB[ред. | ред. код]

У ФСІІ є два сайти зв'язування пластохінон: в одному з них (QA·Fe2+) постійно знаходиться пов'язаний пластохінон в комплексі з залізом, а другий сайт (QB) здатний оборотно зв'язувати вільні пластохінон та мембрани[en]. Обидва пластохінони грають роль вторинних акцепторів електрона, приймаючи його від феофітина. Перенесення електрона між феофітином і пластохіноном відбувається в перші 200 пікосекунд. Спочатку відбувається перенесення електрона від феофетіна і одноелектронне відновлення QA, в результаті чого він переходить в форму вільного радикала — семіхінонів а. Амінокислотне оточення сайту QA робить його вкрай нестабільним і підвищує його відновну здатність (Eо‘ = –0,13 В), так що він відразу ж передає електрон на QB. При цьому QA окиснюється і готовий прийняти наступний електрон від феофітина, а QB залишається у формі семіхінонів до наступного акту передачі електронів, стабілізований своїм амінокислотним оточенням. Отримавши від QA другий електрон, QB повністю відновлюється, використовуючи два протона з стромального простору. У формі QBH2 він дисоціює з комплексу ФСІІ в гідрофобну фазу мембрани і стає компонентом пулу пластохінонів [19].
- Феофітин віддає електрон QA з утворенням семіхінонів — радикала:
- Q A відновлює Q B , який теж переходить у стан семіхінонів — радикала:
- Q B отримує другий електрон від QA і завершує своє відновлення, приєднуючи два протона з строми і дифундуючи в ліпідний бішар:
Цитохром b559[ред. | ред. код]
Цитохром b559 — гетеродимерний білок, що складається з однієї альфа (PsbE) і однієї бета (PsbF) субодиниці, між якими розташований гем. Цей білок є одним з основних компонентів ядра фотосистеми II. Хоча цитохром b 559 і не бере участі в основному транспорті електронів, він відіграє найважливішу роль у допоміжному або циклічному транспорті електронів, який дозволяє відновити окиснений П 680 при заблокованому потоці електронів від води.
У ФСІІ виявлені дві форми цитохрому b559: високопотенційна (b559H Eо‘ = +0,37 В) і низькопотенційна (b559L Eо‘ = +0,08 В). Високопотенційна форма протонована, низькопотенційна — депротонована. За певних умов спостерігається взаємоперетворення однієї форми в іншу, тому цитохром b559 може здійснювати не тільки циклічний транспорт електронів, а й транспорт протонів у люмен в ході окисно-відновних реакцій[20].
Водоокиснювальний комплекс[ред. | ред. код]

Марганцевий кластер складається з чотирьох атомів марганцю в ступеня окиснення від +3 до +5, п'яти зв'язують їх атомів кисню й одного атома кальцію. Точна структура марганцевого кластера досі залишається предметом суперечок і припущень. Вкрай недостовірними виявилися його структури, отримані методом рентгено-кристалогоргафії, оскільки було показано, що атоми марганцю можуть відновлюватися під впливом рентгенівського випромінювання. Однак кристалографія в комбінації з іншими, більш щадними спектроскопічними методами, такими як EXAFS[en] і ЕПР, допомогли вченим отримати досить гарне уявлення про базової організації кластера. Також вважають, що в підтримці структури марганцевого кластера може брати участь гідрокарбонат — аніон, який зв'язується з люменальним доменом D1[21].
Механізм окиснення води в даний час ще не цілком ясний, але можна вважати експериментально доведеним наступне. Рушійною силою окиснення води є утворення в ході первинних фотохімічних реакцій дуже сильного окиснювача П680 з потенціалом +1,12 В. Між марганцевим кластером і П680 існує проміжний переносник електронів TyrZ — залишок тирозин а білка D1 (Tyr-161), який послідовно переносить чотири електрона від води на спеціальну пару хлорофілів.

Послідовність реакцій представляється наступним чином. TyrZ окиснюється і відновлює П680+. Окиснення тирозин а йде з утворенням нейтрального радикала (TyrZ•), що вказує на спряженість процесу зняття електрона від гідроксила тирозину з процесом передачі його протона на акцептор. Як акцептори протона можуть виступати залишки гістидину H190 і глутамінової кислоти E189 білка D1, розташовані поблизу тирозина-161. Далі протон може бути переданий по ланцюжку амінокислот до люменальной поверхні мембрани, де відбувається його викид у люменальний простір. Тирозин ж відновлюється за рахунок роботи марганцевого кластера та окиснення води: утворився нейтральний радикал TyrZ• відриває атом водню від молекули води, пов'язаної з атомами марганцю в кластері. Тільки один з іонів марганцю, а саме четвертий Mn, пов'язує молекулу води як субстрат і забирає від неї електрони. Передбачається, що безпосередньо перед формуванням O=O зв'язку четвертого Mn переходить у стан Мn+5 . У цьому випадку O=O зв'язок може бути утворена за рахунок нуклеофільної атаки на електрон-дефіцитний комплекс Мn+5=O другою молекулою води, яка пов'язана із прилеглим іоном кальцію. Повне окиснення води й утворення кисню вимагає чотириразового повторення описаних подій [19].
Світлозбиральний комплекс[ред. | ред. код]

Внутрішня антена фотосистеми II складається з двох кодованих хлоропластним геномом білків — CP43 і CP47, які впритул примикають до центрального гетеродімери D1/ D2(CP43 розташовується поблизу D1, а CP47 — близько D2). Білок CP43 асоційований з 13 молекулами хлорофілу а і 3-5 молекулами β-каротину. CP47 несе 16 молекул хлорофілу а і 5 молекул β-каротину. З цими антенами контактують зовнішні «мінорні» антени: CP29, CP26 і CP23, також відомі як Lhcb4-6, причому CP26, CP29 і СЗКІІ знаходяться в контакті один з одним. Кожен з цих білків містить по 18 молекул хлорофілу а, 9 молекул хлорофілу b і 6 молекул каротиноїду[22]. Завдяки своєму становищу мінорні білки здійснюють функцію регулювання стоку енергії від зовнішніх антен на реакційний центр ФСІІ. Саме в мінорних білках протікає віолоксантиновий цикл, який грає фотопротекторну роль при надмірному освітленні та допомагає підготувати рослину до зміни дня і ночі[23].
Зовнішня мобільна антена складається з Lhcb1-3 (маса близько 26 кДа), організованих у тример. Всі три білка кодуються в ядрі. Кожен з білків мобільної антени містить 7 молекул хлорофілу а, 6 молекул хлорофілу b, 2 перехрещені молекули лютеїну, і по одній молекулі неоксантину[en] і віолоксантина[en] (або зеаксантину). При фосфорилюванні цієї антени спеціальними ферментами її заряд стає негативнішим, і вона мігрує від фотосистеми II в область розташування фотосистеми I, де асоціюється з її зовнішньою антеною. Таким чином здійснюється перерозподіл енергії між двома фотосистемами і тонке настроювання фотосинтезу[22].
Захист від фотоінгібування[ред. | ред. код]
Циклічний транспорт електронів[ред. | ред. код]
Крім основного, нециклічного потоку електронів, в ході якого відбувається перенесення низькорівневих електронів від води на пул пластохінон, фотосистема II може здійснювати циклічний транспорт електронів усередині самої себе, коли електрон курсує по замкнутому шляху всередині фотосистеми. Такий вид транспорту реалізується в умовах, коли інтенсивність світла перевищує можливості ЕТЛ утилізувати його енергію або при пошкодженні водоокиснюючого комплексу. У ході цього процесу відбувається зворотний перенос електронів від відновленого первинного хінона QB на цитохром c559, потім на допоміжний хлорофіл ХлZ, а далі на β-каротин, який відновлює окиснений пігмент П680+. В екстремальних умовах можливе протікання псевдоциклічного транспорту електронів (перенесення електронів від води на кисень)[24].
П680+ є найсильнішим окиснювачем і тому представляє серйозну небезпеку для клітини. У нормальних фізіологічних умовах[en] донором електронів для нього є TyrZ, проте в екстреному відновленні, наприклад в умовах низької температури, у його відновленні можуть брати участь TyrD, ХлZ і ХлD, а також β-каротин білка D1[24]. В результаті відновлення П680+ β-каротин окиснюється з утворенням каротин-радикала (Car+), що поглинає при 950 нм. Відновлення Car+ можливо через цитохром b559[25].
Захисна функція каротиноїдів[ред. | ред. код]
Крім участі в циклічному транспорті, у каротиноїдів реакційного центру є й інша функція — здійснювати гасіння триплетного хлорофілу. На D1 і D2 білках симетрично розташовані дві молекули β-каротину. На D1 β-каротин знаходиться у формі всі — транс, тобто всі його зв'язки знаходиться в транс-положенні, в той час як на D2 β-каротин має одну цис-зв'язок у 15-му положенні. Якщо в результаті фотозбудження утворюється вкрай реакційно-активна триплетна форма одного з хлорофілів пігменту П680, β-каротин поглинає частину його надлишкової енергії, переводячи електрон в основний стан. При цьому відбувається спонтанний перехід зв'язку в 15-му положенні з цис — в транс-, а надлишкова енергія триплетного електрона виділяється у вигляді тепла[26].
Репарація фотосистеми II[ред. | ред. код]
Ще один механізм захисту від Фотоінгібування[en] — заміна «жертовного» білка D1. Через високий вміст фотоактивних редокс-агентів і ароматичних амінокислот, а також внаслідок близькості до водоокиснювального комплексу, цей білок дуже нестійкий до дії світла, тому при інтенсивній інсоляції він швидко окиснюється або зазнає процес фотодеструкції. Інтенсивність синтезу D1 білка становить 50 % від усіх синтезованих в хлоропласті білків, тоді як його частка від білків хлоропласта — 0,1 %. Час напівжиття цього білка всього 30 хвилин.
Процес репарації відбувається за такою схемою. Спочатку відбувається розбирання комплексу ФСІІ: йдуть білки ВОК, знімаються атоми Mn, від'єднуються CP43 і CP47. Далі відбувається видалення «зіпсованого» білка: «відгризати» виступаючі з мембрани ділянки білка D1 (працює спеціальна протеаза degP2), а спеціальний білок AtFtsH «виштовхує» його останки з мембрани і протеолітичних розкладає їх. Синтез нового білка D1 йде в ламел, після чого він зазнає процесинг (віддаляється N-кінцевий метіонін, що залишився треонін ацетилюється, цей треонін може оборотно фосфорильованій). Потім відбувається міграція D1 в грани: білок пальмітується і в такому вигляді вбудовується в мембрану гран, після чого відбувається зворотна збірка ФСІІ[27][28].
Локалізація в мембрані тилакоїда[ред. | ред. код]
Фотосистема II, генеруючи сильний окиснювач і будучи потенційним джерелом активних форм кисню, представляє серйозну небезпеку для клітини. Тому не дивно, що більша частина цього комплексу розташована в області спарених мембран — у максимально віддаленому і захищеному місці[29].
На відміну від фотосистеми I, яка у вищих рослин присутня лише у вигляді мономера, фотосистема II здатна утворювати димери в усіх трьох фотосинтезувальних групах.
Примітки[ред. | ред. код]
- ↑ (англ.) Loll B. et al. Towards complete cofactor arrangement in the 3.0 Å resolution structure of photosystem II // Nature. — Грудень 2005. — Т. 438, № 7070. — С. 1040-1044. — DOI:. — PMID 16355230 .
- ↑ Єрмаков, 2005, с. 155.
- ↑ (рос.) А. Г. Габдухлаков, М. В. Донцова. Структурні дослідження фотосистеми II ціанобактерій // Успіхи біологічної хімії. — Інститут білка РАН, Пущино, Московська область, 2013. — Т. 53. — С. 323-354. Архівовано з джерела 2 квітня 2015. Процитовано 7 травня 2015.
- ↑ а б Єрмаков, 2005, с. 121.
- ↑ PDB 2AXT
- ↑ (англ.) Bernhard Loll, Jan Kern,Wolfram Saenger, Athina Zouni & Jacek Biesiadka (Грудень 2005). Towards complete cofactor arrangement in the 3.0 Å resolution structure of photosystem II. Nature (438): 1040—1044. doi:10.1038/nature0422410.1021/bi0348260. PMID 16355230.
- ↑ (англ.) Ohad I, Dal Bosco C, Herrmann RG, Meurer J (Березень 2004). Photosystem II proteins PsbL and PsbJ regulate electron flow to the plastoquinone pool. Biochemistry. 43 (8): 2297—308. doi:10.1021/bi0348260. PMID 14979726.
- ↑ а б в (англ.) Lan-Xin Shia, b, Wolfgang P. Schröder (Січень 2004). The low molecular mass subunits of the photosynthetic supracomplex, photosystem II. Biochim Biophys Acta. 15 (1608): 75—96. doi:10.1016/j.bbabio.2003.12.004. PMID 14871485.
- ↑ (англ.) Govindjee, Jan F Kern, Johannes Messinger, John Whitmarsh. Photosystem II (PDF). Архів оригіналу (PDF) за 5 березня 2016. Процитовано 10 грудня 2017.
- ↑ а б в г Єрмаков, 2005, с. 168–170.
- ↑ а б в The Photosynthetic Apparatus: Molecular Biology and Operation / Lawrence Bogorad, Indra K. Vasil. — USA/UK : Academic Press, Ink, 1991. — Vol. 7. — P. 524. — ISBN 9780323147231.
- ↑ (англ.) Torabi S, Umate P, Manavski N, Plöchinger M, Kleinknecht L, Bogireddi H, Herrmann RG, Wanner G, Schröder WP, Meurer J. (Березень 2014). PsbN is required for assembly of the photosystem II reaction center in Nicotiana tabacum. Plant Cell. 26 (3): 1183—99. PMID 24619613.
- ↑ (англ.) Peter D. Mabbitt, Sigurd M. Wilbanks, Julian J. Eaton-Rye (Серпень 2014). Structure and function of the hydrophilic Photosystem II assembly proteins: Psb27, Psb28 and Ycf48. Plant Physiology and Biochemistry. 81: 96—107. doi:10.1016/j.plaphy.2014.02.013.
- ↑ Гелдт, 2011, с. 99.
- ↑ (англ.) Grzegorz Raszewski, Bruce A. Diner, Eberhard Schlodder and Thomas Renger (2008). Spectroscopic properties of reaction center pigments in photosystem II core complexes: Revision of the multimer model. Biophys. J. 95: 105—119. doi:10.1529/biophysj.107.123935.
- ↑ Єрмаков, 2005, с. 161.
- ↑ (англ.) Rutherford AW, Faller P (29 січня 2003). Photosystem II: evolutionary perspectives. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 358 (1429): 245—253. doi:10.1098/rstb.2002.1186. PMC 1693113. PMID 12594932.
- ↑ (англ.) Suleyman I. Allakhverdiev, Tatsuya Tomo, Yuichiro Shimada, Hayato Kindo, Ryo Nagao, Vyacheslav V. Klimov, and Mamoru Mimuro (23 лютого 2010). Redox potential of pheophytin a in photosystem II of two cyanobacteria having the different special pair chlorophylls. PNAS. 107 (8): 3924—3929.
- ↑ а б Єрмаков, 2005, с. 168-170.
- ↑ (англ.) Daniel I. Arnon and George M.-S. Tang (1988). Cytochrome b-559 and proton conductance in oxygenic photosynthesis. Proc Natl Acad Sci US A. 85 (24): 9524—9528. PMID 16594007.
- ↑ (англ.) Ferreira KN, Iverson TM, Maghlaoui K, Barber J, Iwata S (March 2004). Architecture of the photosynthetic oxygen-evolving center. Science. 303 (5665): 1831—8. doi:10.1126 /science.1093087. PMID 14764885.
{{cite journal}}: Перевірте значення|doi=(довідка) - ↑ а б Страсбургер, 2008, с. 107.
- ↑ Єрмаков, 2005, с. 145.
- ↑ а б Єрмаков, 2005.
- ↑ Єрмаков, 2005, с. 146.
- ↑ (англ.) Carbonera D, Agostini G, Morosinotto T, Bassi R (Червень 2005). Quenching of chlorophyll triplet states by carotenoids in reconstituted Lhca4 subunit of peripheral light-harvesting complex of photosystem I. Biochemistry. 44 (23): 8337—46. PMID 15938623.
- ↑ (англ.) Yin Lan (28 квітня 2014). Molecular mechanisms optimizing photosynthesis during high light stress in plants (PDF). University of Gothenburg. Faculty of Science: 178—182. Архів оригіналу (PDF) за 24 лютого 2015. Процитовано 7 травня 2015.
- ↑ (англ.) Peter J. Nixon, Myles Barker, Marko Boehm, Remco de Vries and Josef Komenda (Січень 2005). FtsH-mediated repair of the photosystem II complex in response to light stress (PDF). 56 (411): 178—182.
- ↑ Єрмаков, 2005, с. 123.
Посилання[ред. | ред. код]
- Інформаційна система «Фотосинтетична мембрана» [Архівовано 2 квітня 2022 у Wayback Machine.]
- «Циклічний і нециклический потік електронів.» [Архівовано 12 травня 2021 у Wayback Machine.] В онлайн енциклопедії Фізіологія рослин







