Меркуриметрія
Меркуриметрі́я — комплексометричний метод кількісного визначення у розчині галогенідів і псевдогалогенідів (ціанідів і тіоціанатів), заснований на утворенні малорозчинних сполук при взаємодії з розчинами солей Hg(II). Титрантом зазвичай є розчин нітрату ртуті(II) Hg(NO3)2.
При взаємодії між іонами Cl-, Br- та катіоном Hg2+ відбувається осадження білих малорозчинних галогенідів (хлориду і броміду ртуті):
Однак у процесі титрування хлоридів можлива поява методичної помилки, пов'язана із реакцією між титрантом і утворюваним осадом HgCl2:
Це вимагає введення поправкового коефіцієнту.
Індикаторами для визначення хлоридів і бромідів можуть бути розчини нітропрусиду натрію, дифенілкарбазону і дифенікарбазиду. Катіони Hg(II) не взаємодіють з індикаторами, поки у розчині присутні галогеніди.
У випадку застосування нітропрусиду натрію зайва крапля титранту утворюватиме білий осад:
- ; Ks=1,0·10-9
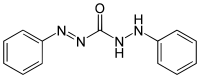
Кращим варіантом є використання дифенілкарбазону (або дифенілкарбазиду) — надлишкова кількість Hg(II) утворюватиме комплексні сполуки синьо-фіолетового кольору.
Визначення йодидів полягає у двостадійній реакції:
- спочатку катіони Hg(II) зв'язують йодид-іони у комплекси тетрайодомеркурату:
- додавання надлишкової кількості титранту призводитиме до випадіння рожево-помаранчевого осаду йодиду ртуті(II):
Кінцева точка титрування може визначатися суто візуально.

Для визначення вмісту тіоціанатів (роданідів) додатково застосовуються солі Fe(III) — вони утворюють з тіоціанатами комплекс, що забарвлює розчин у червоний колір, а подальше титрування солями Hg(II) його знебарвлює:
Нітрат ртуті(II) не відповідає вимогам до стандартних речовин, тому після приготування розчину його додатково стандартизують.
Типовим для меркуриметрії є розчин титранту концентрацією 0,1 моль/л, приготований розведенням солі у концентрованій нітратній кислоті.
Концентрацію розчину Hg(NO3)2 встановлюють за стандартним розчином хлориду натрію відомої концентрації. До аліквоти розчину NaCl додають кілька крапель дифенілкарбазону і титрують розчином Hg(NO3)2 до переходу жовтого забарвлення розчину у фіолетове. За отриманим значенням об'єму титранту, що пішов на титрування наважки NaCl, розраховують його молярну концентрацію.
- Болотов В. В., Свєчнікова О. М., Колісник С. В., Жукова Т. В. та ін. Аналітична хімія / За ред. В. В. Болотова. — Х. : Вид-во НФаУ, 2004. — С. 268—271. — ISBN 966-615-219-3.
- Жаровський Ф. Г., Пилипенко А. Т., П'ятницький І. В. Аналітична хімія. — 2-е. — К. : Вища школа, 1982. — С. 471—475.


![{\displaystyle \mathrm {Hg^{2+}+HgCl_{2}\longrightarrow 2[HgCl]^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8fc44f1c5d921a2df2642aae8804b812818a79a)
![{\displaystyle \mathrm {Hg^{2+}+[Fe(CN)_{5}NO]^{2-}\longrightarrow Hg[Fe(CN)_{5}NO]\downarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a3aeadf0c101cb074d577993cf6deb537255488)
![{\displaystyle \mathrm {Hg^{2+}+4I^{-}\longrightarrow [HgI_{4}]^{2-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa017d90c776e1e8bec4d9363b155e6346942f06)
![{\displaystyle \mathrm {Hg^{2+}+[HgI_{4}]^{2-}\longrightarrow 2HgI_{2}\downarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e8ddaada2c75a9838e7430b0290d26e2acae317)
![{\displaystyle \mathrm {Fe^{3+}+3SCN^{-}\longrightarrow [Fe(SCN)_{3}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4dad797f48482ba8680385b5ac7a4080ee3d84a)
![{\displaystyle \mathrm {3Hg^{2+}+2[Fe(SCN)_{3}]\longrightarrow 3[Hg(SCN)_{2}]+2Fe^{3+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/dcf407a96a2e3ffff3efc6301e7f55d1e1398784)