Флуоресценція в біологічних дослідженнях: відмінності між версіями
| [неперевірена версія] | [неперевірена версія] |
| Рядок 1742: | Рядок 1742: | ||
Як і класичне [[імунофарбування]], цей метод базується на використанні антитіл. Антитіла це білкові молекули молекули що з високою афінністю та селективністю звязуються зі своїми мішенями. Кожне антитіло розпізнає свій певний [[антиген]]. Отримання антитіл є надійною процедурою. |
Як і класичне [[імунофарбування]], цей метод базується на використанні антитіл. Антитіла це білкові молекули молекули що з високою афінністю та селективністю звязуються зі своїми мішенями. Кожне антитіло розпізнає свій певний [[антиген]]. Отримання антитіл є надійною процедурою. |
||
В іммунофлуоресцентному фарбуванні використовують одразу два типи антитіл. Первинне антитіло звязується безпосередньо з обєктом фарбування. Після цього вторинне антитіло, яке ковалентно модифіковане молекулою флуорофору, звязується з первинним антитілом. Таким чином, мішень що буне нести антиген буде забарвлена за рахунок утворення комплексу з двома антитілами <ref name="demchenko2009 />. |
В іммунофлуоресцентному фарбуванні використовують одразу два типи антитіл. Первинне антитіло звязується безпосередньо з обєктом фарбування. Після цього вторинне антитіло, яке ковалентно модифіковане молекулою флуорофору, звязується з первинним антитілом. Таким чином, мішень що буне нести антиген буде забарвлена за рахунок утворення комплексу з двома антитілами <ref name="demchenko2009" />. |
||
Використання двох антитіл, первинного і вторинного, необхідне для забезпечення гнучкості методи, тобто можливості варіювати забарвлення різних цілей без необхідності отримання і хімічної модифікації нових антитіл. |
Використання двох антитіл, первинного і вторинного, необхідне для забезпечення гнучкості методи, тобто можливості варіювати забарвлення різних цілей без необхідності отримання і хімічної модифікації нових антитіл. |
||
Недоліком іммунофлуоресцентного фарбування є низька проникність антитіл крізь клітинні мембрани. Внаслідок цього цей метод найчастіше використовується для фарбування фіксованих клітин. |
|||
=== Флуоресцентні білки === |
|||
| ⚫ | |||
=== Автофлуоресцентні білки === |
|||
| ⚫ | |||
Генетично запрограмовані автофлуоресцентні білки створені на базі зеленого флуоресцентного білка (GFP) та його аналогів є незамінними флуоресцентними маркерами для клітинної та молекулярної біології. |
|||
Перевагами автофлуоресцентних білків є можливість їх візуалізації в клітині без введення будь-яких додаткових барвників або хімічних реагентів. Генетичне мічення клітинних білків флуоресцентними білковими маркерами можна реалізувати не змінюючи конформацію та біохімічні властивості маркованого білка. Внаслідок чого маркування білків GFP (GFP fusion constructs) використовується для вивчення рівня експресії білків в клітинах<ref>{{Цитата:Стаття |
|||
| author = Wahlfors, J.; Loimas, S.; Pasanen, T.; Hakkarainen, T. |
|||
| year = 2001 |
|||
| month = |
|||
| ⚫ | |||
| journal = Histochemistry and Cell Biology |
|||
| volume = 115 |
|||
| issue = |
|||
| pages = 59-65 |
|||
| doi = 10.1007/s004180000219 |
|||
| id = |
|||
| url = |
|||
| format = |
|||
| accessdate = |
|||
}}</ref>. |
|||
Окрім пасивних флуоресцентних маркерів, які просто сигналізують про наявність і локалізацію білка до якого вони привязані, на базі GFP були створені флуоресцентні зонди, які змінюють флуоресценцію залежно від концентрації іонів, сигнальних молекул та інших факторів середовища в якому вони знаходяться<ref>{{Цитата:Стаття |
|||
| author = Zhang, J.; Campbell, R. E.; Ting, A. Y.; Tsien, R. Y. |
|||
| year = 2002 |
|||
| month = |
|||
| ⚫ | |||
| journal = Nature Reviews Molecular Cell Biology |
|||
| volume = 3 |
|||
| issue = 12 |
|||
| pages = 906-918 |
|||
| doi = 10.1038/nrm976 |
|||
| id = |
|||
| url = |
|||
| format = |
|||
| accessdate = |
|||
}}</ref>. |
|||
===Флуорогенні теги=== |
===Флуорогенні теги=== |
||
Версія за 02:11, 6 жовтня 2013

Флуоресценція знайшла широке застосування у різноманітних прикладних біологічних та біомедичних дослідженнях[1]. Це фізичне явище суть якого полягає в короткочасному поглинанні кванта світла флуорофором (речовиною що здатна флуоресціювати) із наступною швидкою еміссією іншого кванта, що має властивості відмінні від вихідного[2]. Багато напрямків у біофізиці, молекулярній та клітинній біології виникли та розвиваються саме завдяки впровадженню нових методів що базуються на флуоресценції. Варто відзначити декілька прикладів.
Для біолофізиків флуоресценція стала швидким та чутливим методом дослідження структури, динаміки та функцій біологічних макромолеукл — нуклеїнових кислот[3] та білків[4].
Метод секвенування ДНК за Сангером був значно вдосконалений у другій половині 1980-х років саме завдяки впровадження флуоресцентної детекції. Важливим наслідком цього стала вища швидкість та надійність секвенування. Окрім цього метод було автоматизовано[5][6]. Це відкрило технічну можливість проведення широкомасштабного (за масштабами того часу) секвенування та дозволило розпочати проект "Геном людини" на початку 1990-х років. Хоча секвенування за Сангером майже повністю вийшло з використання, Флуоресценція продовжує використовуватись у методах секвенування ДНК наступних поколінь[7][8].
Флуоресценція дала новий поштовх для розвитку клітинної біології. Завдяки конфокальній флуоресцентній мікроскопії та розробці нових флуоресцентних міток на базі зеленого флуоресцентного білка (GFP) та його аналогів з'явилась можливість отримувати специфічне контрастне забарвлення та робити фотознімки з високим розділенням великої кількості внутрішньоклітинних білкових структур. Розробка нових флуоресцентних зондів - речовин що змінюють флуоресценцію коли до них приєднується певна молекула - дала можливість детально досліджувати хімічних склад живих клітин та навіть організмів та його зміни у часі і просторі, що поклало початок флуоресцентному молекулярному імейджингу (англ. molecular imaging)[9][10].
Починаючи з середини ХХ-го століття аналітичні методи що базуються на флуоресценції почали широко використовуватись у клінічній хімії та молекулярній діагностиці. Зокрема були розроблені та впроваджені чутливі методи для швидкого аналізу стероїдних гормонів, порфіринів, катехоламінів, метаболітів медичних препаратів та інших діагностично важливих хімічних речовин у сечі та плазмі крові[11]. За допомогою імуноферментного аналізу (ELISA) із використанням флуорогенних субстратів проводять визначення біомаркерів різних захворювань.
Активно розроблюються методи флуоресцентної діагностики in vivo[12][13]. Зокрема створені флуоресцентні зонди що селективно забарвлюють злоякісні утворення та допомагають виявляти їх під час ендоскопічного обстеження або томографії[14]. Також на основі флуоресцентного забарвлення тканин були розроблені новітні методики проведення хірургічних операцій для видалення злоякісних пухлин (англ: image-guided surgery). Перед операцією ракова пухлина селективно забарвлюється флуоресцентним барвником. Під час самої операції спеціальне обладнання реєструє флуоресцентний сигнал, дозволяючи хірургу більш точно розрізняти злоякісну та здорову тканину[15][16].
Фізичні основи флуоресценції
Флуоресценція це одне з явищ які можуть відбуватись під час взаємодії електромагнітного випромінювання з речовиною.

За нормальних умов переважна більшість молекул перебувають у основному електронному стані. Молекули можуть поглинати кванти електромагнітного випромінювання певної енергії та переходити у збуджений стан. Це відповідає переходу одного електрону з найвищої зайнятої на найнижчу вільну молекулярну орбіталь (НЗМО → НВМО). Відповідно до їх мультиплетності, основний та збуджений електронні стани позначають та . Збудження більшості флуорофорів () може відбуватись під дією ближнього ультрафіолетового (довжина хвилі 300—400 нм) або видимого (довжина хвилі 400—800 нм) світла. Після переходу флуорофору у збуджений стан відбувається релаксація - процес при якому молекула втрачає частину енергії; при цьому вона опускається до найнижчого коливального підрівня електронного рівня . У рідкому середовищі за нормальних умов цей процес відбувається за час порядку декількох пікосекунд (10-12 с). Згідно з правилом Каші, саме з найнижнчого коривального підрівня електронного рівня відбувається перехід в основний електронний стан, що супроводжується флуоресценцією. Через втрати енергії під час релаксації та з деяких інших причин флуоресцентне випромінення має меншу енергію (та відповідно більшу довжину хвилі) порівняно зі світлом що поглинається під час збудження[2].


На малюнку що наведено вище не показані інші процеси, які конкурують із флуоресценцією. Зокрема, за час існування молекули у збудженому стані може відбутись внутрішня конверсія, тобто безвипромінювальний перехід . Існує також можливість переходу молекули у триплетний стан за рахунок інтеркомбінаційної конверсії. Повну картину можливих переходів можна побачити на діаграмі Яблонського. Флуоресценцію не слід плутати з іншими типами люмінісценції, такими як фосфоресценція, хемолюмінісценія, біолюмінісценція тощо[17].
Детекція флуоресценції
У найпростішому випадку для спостереження флуоресценції потрібні лише розчин флуоресцентної сполуки та відповідне джерело світла для збудження. Зручним джерелом збудження є ручні ультрафіолетові лампи.
Основними приладами для вивчення флуоресценції в лабораторних умовах є спектрофлуориметри[18]. Сильно спрощена схема такого приладу показана на малюнку.
В спектрофлуориметрах використовують різні джерела збуджуючого світла, найчастіше ксенонові лампи високого тиску. Вони дають широкий спектр емісії (від ультрафіолетового до інфрачервоного світла). Випромінювання від лампи поступає в монохроматор збудження, який дає на виході світло з певною потрібною довжиною хвилі . Після цього монохроматичний промінь направляється на зразок, що призводить до флуоресценції. Важливим є те що флуоресцентна емісія ізотропна, тобто її інтенсивність однакова по всих напрямках (не залежить від кута під яким вона спостерігається). Це дає можливість легко відділити її від збуджуючого світла. Розташування детектора під кутом 90° до напрямку збудження дає можливість вловлювати виключно ті фотони, які є результатом флуоресцентної емісії. Флуоресцентне світло пропускається крізь ще один монохроматор (монохроматор еміссії, ). Після цього інтенсивність світлового потоку вимірюється за допомогою детектора.
Перераховані тут компоненти (джерело світла, монохроматори, детектор) в різних варіантах і комбінаціях присутні у всих приладах які вимірюють флуоресценцію. Залежно від призначення прилада, конфігурація та характеристики кожного з елементів системи можуть змінюватись. Наприклад, замість монохроматорів можуть використовуватись набори світлофільтрів; в якості джерел монохроматичноно світла можуть використовуватись лазери[1].
Характеристики флуоресцентної емісії
Існує ряд кількісних параметрів що описують флуоресцентне світло.
| Праметер | Позначення | Опис |
|---|---|---|
| Інтенсивність флуоресценції | , або | Цей парамер пропорційний кількості фотонів, які досягають детектора в одиницю часу. Він вимірються в кількості фотонів на секунду (cps, counts per second), або у відносних одиницях (A.U., arbitrary units). Цей параметр залежить як від досліджуваного зразка, так і від прилада на якогому проводять виміри. |
| Спектр флуоресценції | Спектр флуоресценції це залежність інтесивності флуоресценції від довжини хвилі детекції (λem), записана за сталого значення довжини хвилі збудження (λex). В найпростішому випадку вона має вигляд асиметричної кривої з одним максимумом. Позиція максимуму емісії показує, яким кольром флуоресціює сполука. Так, максимум флуоресценції на 450 нм приблизно відповідє синьому світлу, максимум в 650 нм означає червону флуоресценцію, тощо. Ширина спектру флуоресценції органічних барвників складає від кількох десятків до кількох сотень нанометрів. Ширина спектра флуоресценції квантові точок є меншою і складає кілька десятків нанометрів. | |
| Час життя флуоресценції | Для кожної флуоресцентної сполуки можна виміряти величину, що має розмірність часу та має назву "час життя флуоресценції". Ця величана складає наносекунд для більшості флуорофорів. Вона показує усереднений час існування молекули у збудженому стані. Якщо побудувати графік затухання флуоресценції у часі, він буде мати вигляд екпоненційної кривої. У найпростішому випадку спадання буде моноекспоненційним, тобто буде мати вигляд прямої у логарифмічних кординатах.
 Час життя в 1 нс не означає що флуоресценція зразка повністю зникне за одну наносекунду. Ця величина означає середній час існування збудженого флуорофору у великій популяції. Флуоресценція, подібно до радіоактивного розпаду, є стохастичним процесом. Тобто кожна окрмо взята молекула може випромінити фотон за час як коротший, так і довший [1]. | |
| Квантовий вихід флуоресценції | Показує яка частка поглинутих фотонів випромінюється у вигляді флуоресценції. Як зазначалось вище, флуоресценція конкурує з рядом інших процесів, такими як внутрішня та інтеркомбінаційна конверсія. Окрім них існує також можливість руйнування флуорофору шляхом хімічного перетворення. Внаслідок цього кількість фотонів що випромінюються внаслідок фулоресценції завжди нижча ніж кількість поглинутих фотонів (Ф < 1). |
Суміжні явища важливі для біологічних застосувань
У дослідженнях біологічних система корисними є деякі явища які повязані з флуоресценцією.
| Явище | Опис та основні характеристики |
|---|---|
| Анізотропія флуоресценції | Показує наскільки змінюється орієнтація збуджених молекул за час існування збудженого стану[1][17]. Для вимірювання анізотропії флуоресценції необхідні спектрофлуориметри що обладнані поляризаторами збуджуючого та флуоресцентного свіла. Знаючи інтенсивність флуоросцентного світла поляризованого у паралельній та перпендикулярній площинах, анізотропію можна розрахувати за формулою:
Анізотропія флуоресценції показує наскількі вільно обертається молекула за час існування збудженого стану. Вільні флуорофори у рідких розчинниках за нормальних умов обертаються швидко, що викликає повну деполяризацію (r = 0). Якщо флуорофор звязаний з великою біомолекулою, наприклад з білковою глобулою, такий комплекс обертається в просторі повільніше, що призводить до ненульових значень анізотропії. Теоретично можливий максимум дорівнює 0.4[17]. Анізотропія флуоресценції широко використовується для вивчення біків та взаємодій між ними[19]. |
| Гасіння флуоресценції | Інколи інтенсивність флуоресценції суттєво зменшується за наявності певних сполук в розчині. Таке явище називається гасінням флуоресценції, а сполуки що його викликають — гасниками (англ.quencher)  Класичним прикладом є кисень, який є гасником для великої кількості органічних флуорофорів[1]. Математично гасіння флуоресценції описується рівнянням Штерна-Вольмера. Тут - відношення початкової флуоресценції до флуоресценції в присутності гасника; - константа Штерна-Вольмера; - концентрація гасника. Графік в координатах — називається графіком Штерна-Вольмера. Гасіння буває статичним і динамічним. При статичному гасінні флуорофор у основному електронному стані утворює нефлуоресцентний комплекс з гасником. При динамічному гасінні утворюється звичайний збуджений стан, який руйнується гасником ще до того як встигає відбутись флуоресцентна еміссія[1]. Експерименти з гасінням фулоресценції триптофану акриламідом часто використовується для аналізу конформації білкових молекул[1]. Окрім того гасіння органічних флуорофорів використовується при розробці флуоресцнтних зондів [17] |
| FRET - Фьостерівський перенос резонансної енергії | Фёстерівський переніс резонансної енергії (англ.: Förster resonance energy transfer, FRET) - процес у якому приймає участь два флуорофори, донор (D) і акцептор (A) переносу. Під час ФРЕТ відбувається перенесення енергії від одного флуорофору до іншого. Тобто збуджуючи одну молекулу (донор), можна спостерігати фулоресценцію він іншої (акцептора).
 Для FRET необхідно дотримання декількох умов[1], а саме:
Важливим є те, що FRET відбувається на відстанях сумірних з розмірами так біологічних обєктів, таких як білкові глобули або мембрани клітин. При цьому відносна ефективність переносу енергії прямо залежить від відстані між FRET-партнерами. Ефективність FRET розраховується за за формулою.
тут є Фьостерівським радіусом, такою відстанню між донором та акцептором, при якій ефективність переносу дорівнює ½. Якщо дві молекули що мічені ФРЕТ-парою знаходяться на великій відстані, при збудженні донора буде спостерігатись тільки його власна флуоресцецнція. У випадку коли молекули зближуються, при збудженні донора буде спостерігатись емісія акцептора.  Через його залежність від відстані FRET став своєрідною "молекулярною лінійкою", яка дозволяє вимірювати відстані між молекулами кожна з яких мічена одним з партнерів переносу. FRET може спостерігатись між різними за своєю хімічною природою типами флуорофорів; можливе також використання цього явища на рівні окремих молекул[20] або у час-розділеному форматі (англ.: time-resolved FRET), що дає додаткову інформацію про динаміку та гетерогенность складних молекулярних системи[21][22]. |
Переваги флуоресцентних методів досліджень
Надвисока чутливість
Важливим показником методу детекції що базується на певному явищі є його чутливість — те яка кількість вихідного матеріалу достатня для його однозначної ідентифікації. За своєю чутилвістю флуоресценція є абсолютним рекордсменом, перевершуючи методи детекції що базуються на поглинанні світла або використанні радіоактивного розпаду[1]. Сучасні інструменти можуть ідентифікувати окремі флуоресцентні молекули. Це сприяло розвитку окремого напрямку - одномолекулярної флуоресцентної спектроскопії (ОФС, англ.: Single Molecule Fluorescence Spectroscopy)[23][24]. Одномолекулярна флуоресцентна спектроскопія відкрила нові можливості для вивчення біологічних систем на молекулярному рівні. Наприклад, якщо класичні методи дослідження біомолекул, такі як спектроскопія ядерного магнітного резонансу, мають справу з великими зразками, що містять велику кількість молекул, весь час доводититься мати справу із усередненим сигналом. Інші методи, такі як електронна мікроскопія, дозволяють фізично спостерігати за окремими молекулами; проте такі методи не дають можливість вивчати їх в біологічно-релевантних умовах. Одномолекулярна флуоресцентна спектроскопія стала важливим методом дослідження, поєднавши можливість спостерігати за окремими молекуламі із можливістю досліджувати їх у динаміці та за біологічно-релевантних умов. Наприклад, саме завдяки ОФС стало можливим вивчати згортання та динаміку білків та ДНК на рівні окремих молекул [25][26][27][20]. Також на основі ОФС були створені методи для секвенування окремих молекул ДНК та для спостереження за окремими флуоресцентними молекулами у клітині з використанням фулоресцентої мікроскопії надвисокої роздільної здатності[28][29]. За допомогою сучасних методів одномолекулярної мікроскопії можна не тільки визначити положення окремих молекул у клітині з точністю до декілької десятків нанометрів (що значно перевершує можливості традиційної світлової мікроскопії) але і слідкувати за їх перетвореннями у реальному часі[30].
Мультиплексність детекції
Існує велика кількість флуорофорів, кожний з яких характеризується певним максимумом емісії (коліром флуоресценції). Це відкриває можливість для мультиплексної детекції, тобто для спостереження за декількома обєктами одночасно, якщо вони закодовані флуорофорами з різними кольорами емісії. Спектри флуоресценції флуорофорів мають не перекриватись. Якщо використовувати флуорофори з вузькими спектрами, такі як квантові точки, можливо спостерігати навіть за пятьма внутрішньоклітинними цілями одночасно[31].

Cумісність з живими організмами
Існує можливість проводити дослідження із використанням флуоресценції на живих клітинах і навіть цілих організмах[10]. Видиме флуоресцентне світло не поглинається біологічними макромолекулами, водою та іншими компонентами живих клітин та не впливає на процеси що відбуваються в клітині.
За останні роки були розроблені числені біосумісні флуорофори та флуоресцентні зонди. Серед них особливо виділяються флуоресцентні білки. Завдяки генній інженерії флуоресцентні білкові маркери різних кольорів можуть бути приєднані до протеїнів у різних лабораторних організмах (fusion proteins). На фотографії праворуч зображені миші, в геном яких був введений ген зеленого флоуресцентного білка.
При візуалізації флуоресценції в живих тканинах певну проблему складає поглинання світла з короткими довжинами хвиль. В звязку з цим широку популярність в якості лабораторноого організму здобула Danio rerio - маленька акваріумна рибка, яка є повністю прозорою для видимого світла на перших етапах розвитку. Це робить її зручним модельним організмом для дослідження з використанням флуоресцентних міток та зондів[32].

Висока швидкість відповіді
Флуоресценція є дуже швидким процесом, який відбувається в наносекундній шкалі часу (у випадку окремих комплексів металів - у мікросекундній). За секунду одна молекула флуорофору може випромінити мільйони фотонів, кожен з яких містить інформацію про оточення в якому перебувала молекула безпосередньо перед емісією[17]. Завдяки цьому флуоресценцію зручно використовувати для дослідження швидких процесів, таких як згортання та динаміка окремих білкових глобул [26].
Високе просторове розділення
Просторове розділення методу показує на якій мінімальній відстані мають знаходитись обєкти для того щоб їх можна було однозначно розрізнити. Просторове розділення дуже важливе у дослідженнях живих систем на мікроскопічному рівні. Лінійний розмір окремих клітинних структур, таких як наприклад ядерні пори, може складати десятки нанометрів, що робить їх недосяжними для класичної оптичної мікроскопії.
Завдяки деяким особливостям процесу флуоресценції, таким як наприклад можливість керовано позбавлятись небажаної емісії на певних ділянках зразка за допомогою додаткового опромінення (stimulated emission depletion) наприкінці ХХ століття були розроблені методи оптичної мікроскопії надвисокої роздільної здатності (super resolution microscopy).
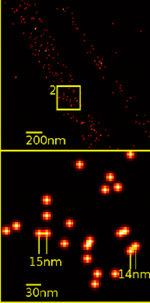
Якщо для конфокальної флуоресцентної мікроскопії максимально досяжне просторове розділення складає близько 200 нм, для методів мікроскопії надвисокої роздільної здатності (STED, PALM тощо) роздільна здатність досягає кількох десятків нанометрів[33][34].
Флуорофори
Здатністю флуоресціювати володіють далеко не всі хімічні сполуки. Наприклад, з поміж двадцяти протеїногенних амінокислот флуоресцентними властивостями володіють всього три: фенілаланін, тирозин, та триптофан[35]. Флуоресценція останнього широко використовується для вивчення конформацій, динаміки та взаємодій триптофанвмісних білків[35][1]. Пуринові та піримідинові азотисті основи що входять в склад ДНК та РНК майже не флуоресціюють за нормальних умов[36].
Існує велике розмаїття штучних флуоресцентних сполук з різними фотофізиними властивостями[37][38][39][40]. Основними класами є малі органічні барвники, координаційні сполуки лантаноїдів, фулоресцентні білки та напівпровідникові нанокристали. Кожен клас має свої специфічні особливості, переваги та недоліки.
Малі органічні флуорофори
Малі органічні флуорфори є найбільшим класом флуоресцентних сполук. В більшості випадків вони є відносно невеликими органічними речовинами що містять декілька ароматичних фрагментів. Молекулярна маса більшості органічних флуорофорів є меншою одного кілодальтона[17].
Флуоресцентними властивостями володіє надзвичайно велика кількість органічних сполук. Практичне значення мають лише обмежена кількість сполук, які є похідними декількох базових структур[41]. Це похідні кумарину, флуоресцеїну[42], родаміну[42][43], бор-дипірометену BODIPY[44], ціанінові[45] та скваринові[46] барвники.
Колір флуоресценції малих органічних барвників може змінюватись в дуже широких межах. Так, наприклад, похідні кумарину та флуоресцеїну мають синю та зелену флуоресценцію, відповідно. Похідні родаміну та BODIPY можуть мати жовто-червону флуоресценцію, тоді як на базі ціанінів та скваринів створені барвники що фулоресціюють у червоному та ближньому ультрафіолетовому кольорі. Флуоресценцію барвника можна керувати, змінюючи хімічну природу функціональних груп що приєднані до флуорофору [41].
Іншою особливістю малих органічних флуорофорів є те що їх флуоресценцію можна "вмикати" за допомогою мінімальних змін в хімічній структурі. Це широко використовуються в створенні флуоресцентних зондів на основі таких молекул. Прикладом є флуоресцеїн, який може існувати в формі двох таутомерів: нефлуоресцентній лактонній формі та флуоресцентній лактонній формі.
Нефлуоресцентні сполуки на основі "закритої" форми здатні перетворюватись на флуоресцентні під дією певних хімічних речовин[47]. Подібні реагенти що збільшують флуоресценцію в певних умовах називають "флуорогенними зондами"[48].
Перевагами органічних флуорофорів є можливість змінювати їх фотофізичні властивості за допомогою модифікацій функціональних груп. Іншими перевагами є малий розмір та можливість селективного ковалентного мічення біомолекул. Недоліками є помірні квантові виходи флуоресценції, низька яскравість та низька хімічна та фотостабільність [17].
Нещодавно розроблені нові покоління флуоресцентних барвників з покращеними властивостями[49][50]. В дослідженнях нових флуорофорів використовуються сучасні методи органічної хімії, такі як комбінаторний органічний синтез[51].
Координаційні сполуки
Флуоресцентні властивості проявляються деякими катіонами з групи лантаноїдів (Ln3+). За поглинання і випромінювання світла цими атомами відповідають переходи електронів f-підрівня, які в більшості випадків є квантовомеханічно забороненими[17]. Через це флуоресценція лантаноїдів має перні особливості, зокрема дуже довгі часи життя збудженого стану, які що на 3-4 порядки вище ніж часи життя органічних флуорофорів. Через наявність декількох можливих електронних переходів з різними енергіями, у спектрах флуорсценції лантаноїдів спостерігається набір окремих смуг характерних для кожного елементу. Колір емісії може змінюватись від блакитного (Tm) до інфрачервоного (Er)[52]. Зазвичай лантаноїди використовують у формі комплексів із органічними лігандами, які підвищують ефективність збудження атомів металу (сенсибілізація).

Флуоресцентні білки
Важливою групою флуорофорів є флуоресцентні білки (англ.: fluorescent proteins). Перший представник цього класу флуорофорів — зелений флуоресцентний білок (GFP) — був виділений з медузи Aequorea victoria в 1962 році [53] Це відносно невеликий білок із молекулярною масою 27 кДа, що поглинає синє сітло та флуоресціює зеленим.
В 1996-му році тривимірна будова дикого GFP та його мутантів була досліджена методом дифрації рентгенівских променів[54][55]. Було зясовано, що білок має структуру подібну до циліндру, який утвореного декількома бета-шарами. В центрі циліндру розташований флуорофор, який утворюється завдяки хімічній реакції між амінокислотними залишками серину, тирозину та гліцину (амінокислоти 65-67).
Дослідження показали, що згортання поліпептидного ланцюга GFP в циліндричну структуру та утворення фунціонального флуорофору є спонтанним процесом та не вимагає ніяких посттрансляційних модифікацій або кофакторів окрім молекулярного кисеню[56][57]. Як наслідок, завдяки методами генної інженеріїї GFP можна успішно експресувати в багатьох організмах які природньо не мають флуоресцентних білків.

Також була розроблена технологія використання GFP в якості маркерного протеїна, який можна приєднати до іншого внутришньоклітинного білка. Якщо поєднати ген GFP із геном що кодує певний білок, після транскрипції та трансляції утвориться новий гібридний протеін що складається з двох частин. При цьому GFP-частина самостійно перетвориться на компактну циліндричну структуру із флуорофором всередині. Оскільки GFP є відносно невеликим біохімічно інертним білком, він з високою ймовірністю не буде заважати своєму "партнеру" виконувати його функції в клітині. Але при цьому вся гібридна конструкція буде яскраво флуоресціювати, що дасть можливість спостерігати за її винекненням та переміщеннями[56]. Наприклад, якщо ввести ген GFP в гени що кодують білки цитоскелету, останній стане яскраво флуоресціювати[58].
Точковим мутагенезом та заміною окремих амінокислот в природньму GFP були отримані чисельні похідні флуоросцентні білки з покращеними властивостями. Наприклад, зміна окремих амінокислот з оточення флуорофору дала мутанти з іншими кольорами флуоресценції (синім, жовтим, червоним та інфрачервоним)[59][60] Також вдалося отримати варіанти GFP із меншим часом утворення флуоресцентної форми (дозріванням), з вищою фотостабільністю та вищіми квантовими виходами флуоресценції.
Розроблені фотоактиваційні флуоресцентні білки (англ.: photoswitchable fluorescent proteins), які можна "включати" та "вилючати" опроміненням світлом певного кольору[61][62].
На базі флуоресцентних білків були розроблені генетично програмовані флуоресцентні сенсори[63][64]. Окрім цього флуоресцентні білки знайшли широке застосування у флуоресцентній спектроскопії надвисокої роздільної здатності[65].
Революційний вплив флуоресцентних білків на сучасну біологію та біотехнологію було відзначено Нобелівською премією з хімії 2008 року, яка була вручена Осаму Шимомурі, Мартіну Шалфі та Роджеру Тсьєну [66].
Флуоресцентні наночастинки та нанокластери
Іншою групою флуоресцентних сполук є напівпровідникові нанокристали, або квантові точки (англ. Quantum dots). При зменшенні фізичних розмірів частинки наповпровідника до розмірів співрозмірних з дебройлівською довжиною хвилі для електрону вони починають проявляти властивості відмінні від обємних напівпровідників. Зокрема починають проявлятись квантові ефекти. При взаємодії квантової точки з електромагнітним випромінюванням утворюється екситон що замкнений у потенційній ямі. Рекомбінація екситону призводить до вивільнення енергії. Завдяки цьому частинки нанометрових розмірів утворені з таких напівпровідникових речовин як селенід кадмію здатні поглинати світло та флуоресціювати [17].

Через відмінність в хімічній будові та природу основного та збудженого електронного стану, фотофізичні властивості квантових точок відрізняються від властивостей органічних флуорофорів та флуоресцентних білків. По-перше, квантові точки дають вузький та симетричний спектр емісії, положення максимума якого залежить від діаметру квантової точки та метіріалу з якого вона утворена. Якщо варіювати концентрацію реагентів при синтезі, можна досягти переважного формування квантових точок переважно одного діаметру, які будуть мати свій специфічний колір флуоресценції. Так, наприклад для CdSe зміна розміру ядра від 13 до 24 нанометрів призводить до зміни флуоресценції від блакитної (λem = 500 нм) до червоної (λem = 610 нм)[17]. Важливим є те, що вигляд спектра збудження флуоресценції не залежить від діаметру; це означає що можна досягти одночасного збудження багатьох різних квантових точок використовуючи лише одну хвилю збудження, що дуже зручно для використання у флуоресцентній мікроскопії.
Іншою перевагою квантових точок над органічними флуоресцентними барвниками є високі квантові виходи флуоресценції та висока фотостабільність[17].
У той же час, квантові точки мають і ряд недоліків. По-перше, це великі фізичні розміри, що перевищують величину більшості біологічних молекул. По-друге, матеріали з яких виготовляються квантові точки (Cd, Pb, Se, Hg) є дуже токсичними для живих клітин і організмів[67]. Для зменшення токсичності застосовується багатоступеневий дизайн квантових точок. Напівпровідникове ядро (core) покривається подвійною захисною оболонкою із спорідненого метеріалу (для селеніду кадмію таким матеріалом є сульфід цинку) та гідрофільною полімерною оболонкою, яка збільшує розчинність квантової точки у водному середовищі та дає можливість хімічно привязувати до поверхні інші молекули.[68]
Квантові точки широко використовуються у флуоресцентній мікроскопії та молекулярній діагностиці in vitro[69]; також розробляються методи для використання їх у молекулярному імейджингу та діагностиці in vivo.
Окрім квантових точок, існують інші флуоресцентні частинки нанометрових розмірів. Прикладом є кремнієві наночастинки із ковалентно привязаними до поверхні органічними барвниками[70] які мають суттєво нижчу токсичність порівняно із квантовими точками. Відомі також наночастинки утворені з полімерних органічних сполук[71]. Іншим прикладом є золоті та срібні нанокластери синтезовані на матриці з ДНК, які демонструють флуоресценцтні властивості скаладаючись при цьому всього з кількох атомів металу[72][73].
Флуоресцентні зонди та мітки
Флуоресцентні речовини що застосовуються в біології можна умовно поділити на дві великі групи: флуоресцентні зонди (англ. fluorescent probes) та флуоресцентні мітки (англ. fluorescent tags, fluorescent tracers)[17][74].
- Флуоресцентні мітки служать для того щоб ідентифікувати наявність або просторове положення молекули що досліджується. Флуоресцентна мітка має бути хімічно стабільною і демонструвати стабільну флуоресценцію, яка не залежить від зовнішніх факторів і мінімально змінюється в часі. Таким чином вона діє як "маяк", який сигналізує про місця знаходження молекули до якої він прив'язаний.
- Флуоресцентний зонд є більш складним за своїми функціями. Це молекулярна конструкція яка може існувати у двох станах: "вимкненому" і "ввімкненому". Ці стани розрізняються між собою певними параметрами флуоресцентної емісії (найчастіше квантовим виходом флуоресценції, позицією максимуму в спектрі емісії або часом життя збудженого стану). Перехід між увімкненим та вимкненим станами залежить від наявності в середовищі зонду тих молекул які він має розпізнавати.
Флуоресцентні мітки
Найпоширінішими флуоресцентними мітками в клітинній та молекулярній біології є флуоресцентні білки. Мічення зеленим флуоресцентним білком (GFP-tagging) та його аналогами рутинно використовуються при вивченні структури та фукції білків у різних модельних організмах. В базі данних Pubmed міститься десятки тисяч статей що містять ключові слова "GFP", "GFP-tagging", тощо.
В наш час завдяки поєднанню технологій селективного GFP-мічення білків, високопродуктивної автоматичної мікроскопії та компьютерного аналізу зображень можливе паралельне вивчення локалізації та функцій сотень різних білків[75].
Флуоресцентні білки неможливо прямо використовувати для ковалентного мічення нуклеїнових кислот. Для того щоб досліджувати ДНК та РНК за допомогою флуоресцентних протеїнових маркерів, використовують наступний прийом. В ланцюг нуклеїнової кислоти вводять послідовність, з якою селективно звязується певний протеїн (репресор, фактор транскрипції, тощо). Сам протеїн мітять потрібним флуоресцентним білком. Флуоресцентно-марковані білки споріднені до ДНК та РНК звязуються зі своїми мішенями, показуючи їх просторову локалізацію. Практичними реалізаціями цієї стратегії є візуалізація ДНК в еукаріотичних клітинах за допомогою GFP-lac-репрессора[76], для візуалізації РНК за допомогою λN[77].
Фулоресцентні зонди
Відповідно до своєї назви, флуоресцентний зонд має мету передавати досліднику інформацію про середовище в якому він знаходиться. Флуоресцентним зондом називається молекулярна конструкція, що змінює один з параметрів флуоресценції (інтенсивність, час життя, положення максимума) коли звязується зі своєю мішенню. Флуоресцентні зонди є зручним інструментом для візуалізації та квантифікації розподілення хімічних речовин, наприклад сигнальних молекул, в клітинах[78].
Флуоресцентний зонд складається з двох основних компонентів: і) рецептора, який звязується з молекулою яку треба визначити (в аналітичній хімії її називають аналітом); іі) флуорофора, що реагує на зміну оточення змінюючи флуоресценцію[17]. Існує велика кількість механізмів що здатні трансформувати звязування між рецептором та аналітом у зміну флуоресцентного сигналу. Наприклад, при звязуванні рецептора з аналітом може змінюватись конформація молекули, що призводить до подовження або скорочення системи спряжених π-звязків[79]. Зміна конформації молекули може впливати на відстань між FRET-парою, що також призведе до помітних змін у флуоресценції. Утворення нових координаційних звязків між рецептором та аналітом може активувати/блокувати перенос електрону у збудженому стані (photoinduced electron transfer), який є одним з механізмів гасіння флуоресценції[80]. Існують також інші механізми [81].
Флуоресцентний зонд може по-різному змінювати флуоресценцію при звязуванні з аналітом. Декілька граничних впипадків наведені на малюнку.
Chen 2012 - Nature Chemistry
2013 - Grimm - The Chemistry of Small-Molecule Fluorogenic Probes
2013 - Yuan - Far-red to near infrared analyte-responsive fluorescent probes based on organic fluorophore platforms for fluorescence imaging
2013 - Ohba - Fluorescent Protein-Based Biosensors and Their Clinical Applications 2013 - Li - Quantum dots for fluorescent biosensing and bio-imaging applications
В деяких випадках флуоресцентний зонд реагує не на присутність якоїсь окремої хімічної речовини, а змінює флуоресценцію реагуючи на фізичні параметри серещовища в якому він перебуває (температури, полярності, вязкості). Важливим прикладом є сольватохромні флуоресцентні барвники — сполуки що змінюють колір флуоресценції залежно від полярності оточення. Сольватохромні флуоресцентні барвники стали важливим інструментом дослідження ліпідного складу та фазових перехоів у ліпідних мембранах клітин [82]. Інша група сполук, яку називають флуоресцентними молекулярними роторами, змінює інтенсивність флуоресценції залежно від вязкості середовища. Інтенсивність флуоресценція дуже низька у звичайних розчинника, тоді як за високих значень динамічної вязкості середовища інтенсивність флуоресценції зростає в десятки разів[83]. За допомогою флуоресцентних молекулярних роторів та конфокальної флуоресцентної мікроскопії стало можливим досліджувати вязкість середовища всередині живих клітин[84].
2013 - Santos-Figueroa - Chromogenic and fluorogenic chemosensors and reagents for anions. A comprehensive review of the years 2010–2011 - більше 500 сенсорів лише на аніони, лише за два роки.
Протягом останніх років флоуоресцнтні зонди стали незамінними засобами дослідження живих клітин, збагативши клітинну біологію новим швидким та точним методом кількісного аналізу[85][86].
Приклади використання флуоресценції
Аналіз ДНК і РНК
Секвенування ДНК
Секвенуванням називають визначення послідовності нуклеотидів в ланцюгу нуклеїнової кислоти[87]. Перші методи секвенування були розроблені в 1970-х роках ХХ сторіччя. Ними були метод хімічної деградації Максама-Гілберта[88] та метод що базується на використанні дідеокситермінаторів за Сангером[89]. Суть останнього полягала в ензиматичному подовженню праймера (короткого олігонуклеотида-затравки відомої структури) на молекулі ДНК невідомої послідовності у присутності спеціальних хімічно-модифікованих нуклеозидів - дідеокситермінаторів. Вони схожі на звичайні нуклеозид трифосфати які є вихідними сполуками для синтезу ДНК в організмі, але відрізняються від них відсутністю 3'-гідроксильної групи. Ці хімічні сполуки можуть інкорпоруватись в послідовність ДНК що синтезується ДНК-полімеразою. Але після інкорпорації дідеокситермінатора синтез обривається через відсутність вільного 3'-гідроксилу для утворення нового фосфодіестерного зв'язку з наступним нуклеозидом.
В методі Сангера відбувалось ензиматичне подовження праймера міченого радіоактивним ізотопом (32Р на 5' гідроксильній групі в чотирьох різних пробірках. До кожної з них додавався невеликий відсоток одного певного дідеокситермінатора. Через це синтез в кожній пробірці обривався в певний момент, але завжди на позиції того нуклеотиду який був у формі дідеокситермінатору. За теорією ймовірності, у суміші що містить велику кількість новоутворених молекул ДНК накопичувались всі можливі послідовності терміновані на всіх можливих позиціях що містять нуклеотид присутній у формі ddNTP. Після завершення реакції всі чотири реакційні суміші розділялись в поліакриламідному гелі на чотирьох різних доріжках, розподілення радіоактивних фрагментів зчитувалось радіоавтографією, після чого послідовність невідомої ДНК можна було прочитати прямо на гелі.

Окрім використання радіоактивних ізотопів, іншим недоліком цього методу була велика кількість операцій необхідна для проявки та зчитування радіоактивного сигналу, а також необхідність використання чотирьох доріжок для кожного аналізу, тому що неможливо було розрізнити різні нуклеозиди тільки за їх радіоактивністю.
Метод секвенування з дідеокситермінаторами був суттєво вдосконалений коли радіоактивне мічення праймеру було замінено на флуоресцентне мічення термінуючих нуклеотдиів. На малюнку показана структура дідезоксинуклеозид-трифосфатів, які містять радіоактивні барвники првязані ковалентними лінкерами до азотистих основ. Було знайдено, що такі модифікації азотистих основ мінімально впливають на розпізнавання трифосфатів ДНК-полімеразами, тому вони можуть вбудовуватись в синтезовану ДНК наряд зі звичайними дНТФ. У випадку з флуоресцентними дідеокситермінаторами, при термінації синтезу ДНК відбувається її флуоресцентне мічення. Використання флуоресцентних барвників чоторьох кольорів для кодування кожного з природних нуклеозидів дозволило проводити синтез в одній пробірці та розділення на одній доріжці гелю. Більш того, флуоресцентна детекція виявилась більш чутливою за радіоактивну, дозволяючи проводити визначення нуклеозидів в реальному часі.
В результаті в кінці 1980-х вдалося розробити повністю автоматичні системи для секвенування ДНК із розділенням термінованих фрагментів у капілярному варіанті гель-електрофорезу та з детекцією кожної "букви" в послідовності за її специфічним кольором флуоресценції.
Хоча саме завдяки цьому методу була розшифрована значна частина ДНК людини, секвенування за Сангером вже не актуальне через існування більш швидких, дешевих та ефективних методів нових поколінь. Багато з них також базується на флуоресцентній детекції. Наприклад, секвенування за допомогою синтезу (sequencing by synthesis) також використовує кодування чотирма різними кольорами флуоресценції для кожної з чотирьох літер генетичного коду[90].
Гібридизація ДНК
Молекули ДНК складаються з двох ланцюгів полінуклеотидів, які комплементарні одне одному. Азотисті основи двох ланцюгів утворюють пари, які стабілізовані водневими звязками. Характеристичною рисою нуклеїнових кислот є здатність до молекулярного впізнавання, завдяки якій одноланцюгові фрагменти ДНК мають спорідненість до комплементарних фрагментів.
На основі явища гібридизації були створені методи аналізу послідовностей нуклеїнових кислот із використанням синтетичних флуоресцентно-мічених олігонуклеотидів.
Одним з них є флуоресцентна гібридизація in situ (fluorescent in-situ hybridization, FISH), яка використовується для виявлення точної локалізації певних послідовностей ДНК на метафазних хромосомах [1]. У флуоресцентній гібридизації ін-сіту використовують синтетичні олігонуклеотиди-зонди. Кожна послідовність-зонд ковалентно зєднана з флуорофором певного кольору. Такі зонди вводяться в клітини, після чого залишаються на певний час для того щоб відбулась гібридизація між зондами та комплементарними регіонами хромосомної ДНК. Зонди які не гібридизувались видаляються промиванням, після чого характерне забарвлення хромосом вивчається за допомогою флуоресцентної мікроскопії.
Окрім локалізації одиничних генів на хромосомах, FISH дозволяє досліджувати колокалізацію фрагментів ДНК. Завдяки цьому метод є корисним для цитології та генетики. Так, якщо використовувати для гібридизації з хромосомною ДНК два зонда, мічених червоним та зеленим флуорофорами, місця колокалізації цих послідовностей на хромосомах будуть виглядати як жовті точки [1].

Часто стоїть задача визначити - чи міститься послідовність ДНК потрібної структури у розчині, наприклад у клітинному екстракті або у суміші продуктів полімеразної ланцюгової реакції. Флуоресцента гібридизація in situ для цього непридатна, тому що при звязувані міченої ДНК з мішенню не відбудеться зміни флуоресценції, а відділити звязаний та незвязаний зонд як у випадку з хромосомами неможливо через їх однакову розчинність та інші фізико-хімічні властивості.
Елегантний метод для вирішення цієї задачі був знайдений в 1996-му році[91] та отримав назву molecular beacon probes (MB-зонди, буквальний переклад: "молекулярні маяки"). Структура та принцип роботи МВ-зондів зображені на малюнку.

МВ-зонд є одноланцюговим фрагментом ДНК, що складається з двох ділянок: петлі (червона) та основи (чорна). Послідовність нуклеотидів в петлі вибирається таким чином щоб бути комплементарній тій послідовності яку треба визначити (мішені). Дві частини основи комплементарні одна одній, і тому утворюють стабільну структуру за відсутності мішені. Кінцеві гідроксильні групи одноланцюгової ДНК ковалентно модифікуються флуорофором (F) з одного боку та гасником флуоресценції (Q) з іншого. За відсутності мішені зонд перебуває у закритому стані; флуорофор і гасник знаходяться одне біля одного, через що флуоресценція "вимкнена". В присутності ДНК-мішені може утворюватись гібридна структура в якій центральна петелея комплементарна мішені, через що MB-зонд "розкривається". В такому стані кінці що початково утворювали основу зонда виявляються рознесені на значну відстань у просторі. Відповідно в такому стані гасник не може ефективно гасити флуорофор, що призводить до значного зростання інтенсивності флуоресценції[91].
Оригінальний метод визначення ДНК за допомогою МВ-зондів зазнав чисельних вдосконалень[92]. Наприклад, існують модифікації що базуються на використанні резонансного переносу енергії. Замість пари "флуорофор—гасник" кінці одноланцюгового ДНК-зонда мітили двома флуорофорами що утворюють FRET-пару; за рахунок цього наявність ДНК-мішені можна визначати за зникненням флуоресценції акцептора та зростанням флуоресценції донора[93][94].
Важливою галуззю застосування МВ-зондів стала кількісна полімеразна ланцюгова реакція. МВ-зонд комплементарний центральному регіону послідовності що ампліфікуються додають в реакціїйну суміш до початку реакції. Після старту реакції, інтенсивність флуоресценції реакціїної суміші вимірюється на кожному циклі ампліфікації. Якщо в результаті ПЛР ампліфікується фрагмент комплементарний зонду, інтенсивність флуоресценції зростає пропорційно концентрації продукту в суміші. Завдяки цьому можливо оцінити кількість вихідної ДНК що була на початку ампліфікації. Більш того, можливо спостерігати за ампліфікацією декількох варіантів послідовності ДНК в одній суміші якщо використовувати комбінацію МВ-зондів закодованих різними кольорами флуоресценції. Цей прийом знайшов використання у генетичному аналізі для ідентифікації різних аллелів одного гену[95][96].
В флуоресценцтній мікроскопії МВ - зонди використовуються для вивчення рівня експресії генів шляхом візуалізації мРНК в цитоплазмі. Коли певний ген починає транскрибуватися, в цитоплазмі зростає концентрація відповідної мРНК. Якщо синтезувати MB-зонд з петлею що комплементарна ділянці мРНК, такий зонд буде гібридизуватись з нею, збільшуючи при цьому інтенсивність своєї флуоресценції. За рахунок цього можна дізнатись локалізацію відповідної мРНК в клітині та оцінити рівень експресії за зростанням флуоресценції[97][98][99].
Мікромасиви ДНК
В організмах вищіх організмів містяться тисячі генів, сукупна робота яких визначає фенотип організму. Для швидкого одночасного дослідження великої кількості генів була розроблена технологія мікромасивів ДНК[100].
Мікромасив ДНК представляє собою тверду поверхню, на яку нанесена велика кількість індивідуальних олігонуклеотидів. Кожен елемент масиву на поверхні містить ДНК однієї певної будови, яка програмується при створені масиву. Одним з методів створення ДНК мікромасивів є хімічний твердофазний синтез ДНК із використанням фотоактивних захисних груп[101].
Ця технологія виявилась зручною для аналізу рівня експресії генів у клітинах. Для цього потрібен ДНК мікромасив що містить набір олігонуклеотидних маркерів специфічних для кожного гена що потрібно дослідити. Для того щоб порівняти рівень експресії у двох зразках, контрольному і досліджуваному, проводять наступні операції.

Клітини обох зразків обробляють спеціальними хімічними реагентами та екстрагують матричну РНК що міститься в цитоплазмі. РНК кожного зразку інкубують в присутності звортньої траскриптази та флуоресцентних маркерів певного кольору, в результаті чого утворюються флуоресцентно-мічені молекули кДНК. Так, наприклад на малюнку що зображено вище кДНК зразка А була помічена червоним флуороформ, а кДНК зразка В - зеленим. Після цього зразки змішують та гібридизують на мікромасиві. В результаті молекули кДНК гібридизуються в комірці яка відповідає їхньому гену. Аналіз кольору флуоресценції в кожній комірці показує різницю в рівні експресії відповідного гену в обох зразках. Якщо комірка має червоний колір, це значить о при гібридизації розчину на мікромасиві в ньому містилось більше кДНК з клітин А, а отже рівень експресії гену в клітинах А був вищій. Якщо комірка має зелений колір, значить рівень експресії був вищім в клітинах В. Нарешті жовтий колір свічить про те що клітини синтезували однакову кількість мРНК, отже рівень експресії цього гену в них був однаковий [100].
Флуоресцентні зонди для іонів та нейтральних молекул
Через високу чутливість флуоресценої детекції вона є привабливою технікою для дослідження хімічного складу досліджуваного обєкта. Важливим є те що при застосуванні флуоресцентних зондів для визначення концентрацій хімічних речовин цю техніку можна застосовувати не тільки для вимірювань обємних гомогенних зразків, але й для візуалізації хімічних речовин всередині живих обєктів під мікроскопом. Живі клітини мають складний та неоднорідний хімічний склад, який може швидко змінюватись у часі, наприклад при збуджені клітини або при переході між різними етапами клітинного циклу. Класичні методи аналітичної хімії, такі як гравіметричний, колориметричний чи електрохімічний аналіз вимагають кількаступеневої послідовності дій для підготовки зразків, вимагають значної кількості речовини і того не можуть бути застосовані для аналізу біологічних систем на мікроскопічному рівні.
Флуоресцентна спектроскопія та мікроскопія виявилась чудовим методом для цих досліджень через свою високу чутливість, високу швидкість відповіді.
Хіміками та біохіміками були розроблені чисельні молекулярні зонди, чиєю задачею є виявлення різних біологічно-релевантних речовин, в першу чергу неорганічних іонів та малих органічних молекул, такі як цукри, амінокислоти та нуклеозиди (АТФ, цАМП) та інші.
Найменшим, однак не найменш важливим іоном є іон водню (Н+). Концентрація іонів може вливати на розчинність та конформацію білків та інших біологічних макромолекул. Підтримання концентрації водню є ключовим елементом гомеостазу.
Існує велика кількість флуоресцентних зондів що реагують на зміни у концентрації іонів водню. Як правило вони містять іоногенну функціональну групу спряжену з флуорофором та здатну іонізуватись чи деіонізуватись у певному діапазоні значень рН 2010 - Han - Fluorescent Indicators for Intracellular pH.
Серед інших однозарядних катіонів особливо важливими є натрій і калій. Градієнт їх концентрації відповідає за створення трансмембранного потенціалу. Для обох іонів існують численні флуоресцентні зонди, які засновані на використанні краун-ефірів як розпізнавальних елементів. Valeur, B., & Leray, I. (2000). Design principles of fluorescent molecular sensors for cation recognition. Coordination Chemistry Reviews, 205(1), 3-40.
Іони кальцію грають важливу роль у передачі сигналів всередині клітини. Концентрація Ca2+ збільшується при активації певних сигнальних шляхів. Флуоресцентні зонди для іонів кальцію важливі для вивчення передачі сигналів всередині клітин, що особливо важливо для нейробіології. Класичним флуоресцентним зондом для іонів кальцію є Fura-2, який був розроблений в 1985 році майбутнім нобелівським лауреатом Роджером Тсьєном (тсьен85). Важливою особливістю Fura-2 є те що він є ратіомтеричним флуоресцентним зондом, тобто він має два максимуми в спектрі флуоресценції, відношення яких змінюється в залежності від концентрації іону аналіту. Наслідком цього є те що відношення інтенсивностей не залежить від концентрації флуорофору, що надзвичайно зручно для вимірювання внутрішньклітинних концетнтрацій (дем2010).

Існує можливість досліджувати концентрацію іонів кальцію без необхідності введення в клітину інші хімічні сполуки. Існують генетично запрограмовані зонди для іонів кальцію (нейч97). Такі молекули побудовані на базі двох молекул флуоресцентних білків різних кольорів, що утворюють ФРЕТ-пару. Флуоресцентні білки повязані між собою калмодіумом - білком, що здатен змінювати свою конформацію в залежності від навколишньої концентрації іонів кальцію. За низьких концентрацій кальцію калмодіум перебуває в розгорнутій конформації, через що відстань між флуоресцентними білками є значною, і відповідно ефективність ФРЕТ низькою. Збільшення концентрації кальцію призводить до переходу калмодіуму у жорстку згорнуту конформацію. Це зближує між собою фрагменти флуоресцентних білків, значно підвищуючи ефективність ФРЕТ і відповідно збільшуючи емісію акцептора. Значною перевагою такого флуоресцентного зонду є те що методами генної інженерії можна створити гібрид, прикріпивши цей зонд в точно визначене місце всередині клітини, наприклад до білка що розташований на зовнішній чи внутрішній поверхні клітинної або мітохондріальної мембрани, тощо.
Флуорофори модифіковані бороновими кислотами можуть змінювати флуоресценцію при звязвуванні з молекулами вуглеводів. Fluorescent Chemosensors for Carbohydrates: A Decade’s Worth of Bright Spies for Saccharides in Review
Gomes, A.; Fernandes, E.; Lima, J. L. F. C., Use of Fluorescence Probes for Detection of Reactive Nitrogen Species: A Review. Journal of Fluorescence 2006, 16, (1), 119-139.
2010 - Fluoro- and Chromogenic Chemodosimeters for Heavy Metal Ion Detection in
2003 - Fluorogenic and Chromogenic Chemosensors and Reagents for Anions - cr010421e 2012 - Du - Fluorescent chemodosimeters using mild chemical events for the detection of small anions and cations in biological and environmental media
2012 - Dutta - Recent developments in fluorescent sensors for trace-level determination of toxic-metal ions
Флуоресценцентна мікроскопія

Окремою галуззю застосування флуоресценції в біології є флуоресцентна мікроскопія — варіант оптичної мікроскопії, який базується на дослідженні флуоресцентних молекул в мікрообєктах [17]. Цей метод набув широкого розповсюдження та розквіту наприкінці ХХ-го століття. На відміну від традиційної оптичної мікроскопії, в якій контрастне зображення створюється завдяки різному поглинанню світла окремими частинами клітини, у флуоресцентній мікроскопії контрастне зображення створюється завдяки флуоресценції певних молекул у зразку. Завдяки особливостям конструкції флуоресцентних мікроскопів збуджуюче світло не попадає в обєктив, що дає змогу отримувати яскраве контрастне зображення на темному фоні. Використання фотомультиплікаторів у якості детектора робить метод дуже чутливим. Сучасні методи забарвлення зразків, такі як іммунофуоресцентне забарвлення або введення у клітину флуоресцентних маркерних білків дає змогу забарвлювати окремі елементи клітини із точністю як неможлива у класичних техніках забарвлення мікроскопічних зразків. Більш того, на базі флуоресцентної мікроскопії створені новітні методи побудови та обробки зображення, які значно перевершують розділення традиційної оптичної мікроскопії.
Методи флуоресцентного забарвлення клітин
Низькомолекулярні орагнічні флуоресцентні барвники для клітинних органел
Деякі низькомолекулярні органічні барвники виявляють афінність до певних біомолекул або до цілих клітинних органел. Це явище використовується для селективного мультикольорового забарвлення клітин у флуоресцентній мікроскопії. Окремі приклади барвників наведені у таблиці.
| Назва | Структурна формула | Колір флуоресценції | Що забарвлює |
|---|---|---|---|
| DAPI 4',6-діамідино-2-феніліндол |
 |
синій | ядерна ДНК |
| Hoechst 33342 |
 |
синій | ядерна ДНК |
| Ніл червоний (Nile Red) |
|
червоний | ліпофільні елементи клітин (мембрани, ліпосоми) |
| MitoRed |
|
червоний | Мітохондрії |
Одним з найрозповсюдженіших барвників для ядерної ДНК є 4',6-діамідино-2-феніліндол, DAPI. Він здатен селективно звязуватись з ДНК на А-Т збагачених ділянках, демонструючи яскраву синю флуоресценцію з максимумом на 461 нм[102]. Здатність забарвлювати хромосомну ДНК демонструють также такі сполуки як Hoechst 33342, а також деякі ціанінові барвники[103]. Існують також флуоресцентні барвники які переважно забарвлють G-квадруплекси[104].
Мітохондрії володіють великим негативним мембранним потенціалом (близько -180 mV), за рахунок чого можуть селективно забарвлюватись катіонними флуоресцентними барвниками, такими як MitoRed[105].
Іммунофлуоресцентне фарбування
Суттєвим недоліком використання малих органічних сполук у якості флуоресцентних барвників є низька селективність мічення клітинних цілей. Наприклад, сполуки які зв'язуються з хромосомною ДНК можуть в тій чи іншій мірі забарвлювати інші нулкеїнові кислоти, що містяться в клітині; ліпофільні барвники що забарвлюють ліпідні мембрани можуть також звязуватись з гідрофобними сайтами молекул білків.
Селективного флуоресцентного мічення внутрішньоклітинних структур можна досягти за допомогою імунофлоуресцентного фарбування клітин. Цей метод поєднує селективність традиційних методів імунофарбування із чутливістю флуоресцентної детекції.
Як і класичне імунофарбування, цей метод базується на використанні антитіл. Антитіла це білкові молекули молекули що з високою афінністю та селективністю звязуються зі своїми мішенями. Кожне антитіло розпізнає свій певний антиген. Отримання антитіл є надійною процедурою.
В іммунофлуоресцентному фарбуванні використовують одразу два типи антитіл. Первинне антитіло звязується безпосередньо з обєктом фарбування. Після цього вторинне антитіло, яке ковалентно модифіковане молекулою флуорофору, звязується з первинним антитілом. Таким чином, мішень що буне нести антиген буде забарвлена за рахунок утворення комплексу з двома антитілами [17].
Використання двох антитіл, первинного і вторинного, необхідне для забезпечення гнучкості методи, тобто можливості варіювати забарвлення різних цілей без необхідності отримання і хімічної модифікації нових антитіл.
Недоліком іммунофлуоресцентного фарбування є низька проникність антитіл крізь клітинні мембрани. Внаслідок цього цей метод найчастіше використовується для фарбування фіксованих клітин.
Автофлуоресцентні білки
Генетично запрограмовані автофлуоресцентні білки створені на базі зеленого флуоресцентного білка (GFP) та його аналогів є незамінними флуоресцентними маркерами для клітинної та молекулярної біології.
Перевагами автофлуоресцентних білків є можливість їх візуалізації в клітині без введення будь-яких додаткових барвників або хімічних реагентів. Генетичне мічення клітинних білків флуоресцентними білковими маркерами можна реалізувати не змінюючи конформацію та біохімічні властивості маркованого білка. Внаслідок чого маркування білків GFP (GFP fusion constructs) використовується для вивчення рівня експресії білків в клітинах[106].
Окрім пасивних флуоресцентних маркерів, які просто сигналізують про наявність і локалізацію білка до якого вони привязані, на базі GFP були створені флуоресцентні зонди, які змінюють флуоресценцію залежно від концентрації іонів, сигнальних молекул та інших факторів середовища в якому вони знаходяться[107].
Флуорогенні теги
Недоліками флуоресцентих білків є їх великий розмір, а також складності регуляції їх флуоресценції у часі. Формування вторинної структури та активного флуорофору в більшості випадків є спонтанним процесом і відбувається одразу пілся синтезу поліпептидного ланцюга. Більш гнучкий підхід до флуоресцентного мічення білків був розроблений на базі деяких бактеріальних білків, які є здатні самостійно модифікувати свою хімічну структуру (self-editing enzymes). Найбільш популярними є SNAP тег.
На відміну від флуоресцентних білків, флуорогенні теги залишаються безбарвними, аж поки у клітині не зявиться відповідний субстрат. Завдяки цьому можливо контролювати розвиток фулоресценції у часі. Мультикольорове забарвлення можна реалізувати використовуючи різні флуорофори мічені різними тегами.
2010 - Rabuka - Chemoenzymatic methods for site-specific protein modification 2011 - Crivat - Imaging proteins inside cells with fluorescent tags 2013 - Jung - Chemical biology-based approaches on fluorescent labeling of proteins in live cells
Флуоресцентний мікроскоп
Для використання флуоресцентної мікроскопії необхідні мікроскопи спеціальної будови[108]. Сильно спрощена схема такого мікроскопа (а саме схема скануючого конфокального епіфлуоресцентного мікроскопа) показана на малюнку внизу. Він має наступні особливості будови[17][108]:

- В якості джерел світла використовуються лазери, або комбінація звичайних джерел світла та монохроматорів. Це дає змогу селективно опромінювати зразок світлом певної довжини хвилі для збудження флуорофорів одного типу.
- Використання напівпрозорого дзеркала спрощує конструкцію даючи змогу використовувати один і той самий оптичний шлях для збуджуючого (зелені лінії на малюнку) та флуоресцентного (червоні лінії) світла.
- На відміну від класичної мікроскопії, в якій опромінюється весь зразок одночасно, епіфлуоресцентні мікроскопи направляють збуджуюче світло тільки на ту ділянку препарату яка безпосередньо знаходиться в полі зору. Всі інші частини зображення залишаються в темряві. Це дозволяє мінімізувати вицвітання нестійких флуорофорів та зменшує фототоксичні ефекти.
- Якість зображень суттєво покращується при використанні конфокальних флуоресцентних мікроскопів. В таких мікроскопах на шляху флуоресцентного світла встановлюється щілина (англ. pinhole), через що вдається спостерігати флуоресценцію лише від тієї частини зразка яка знаходиться в фокусі зображення. За допомогою конфокальних флуоресцентних мікроскопів можливо змінювати глибину проникнення в клітину, спостерігаючи за окремими її "зрізами" (фізично клітина залишається цілою). Це також дає змогу зробити тривимірну реконструкцію клітини, накопичивши достатню кількість оптичних "зрізів".
- Використання фотомультиплікатора в якості детектора дозволяє детектувати окремі фотону, що значно підвищує чутливість методу.
- У скануючому флоуресцентному мікроскопі зображення створюється компьютером після сканування зразка. Світло лазера почергово направляється в кожну точку зображення; при цьому програмне забезпечення мікроскопу записує інтенсивність флоуресценції та відносить їх до координат точки з якої вона була отримана. Після сканування всих точок в полі зору зображення реконструюється на екрані компьютера.
Окрім скануючих конфокальних мікроскопів існують інші типи цих приладів.
Флуоресцентна мікроскопія надвисокої роздільної здатності

В скануючому фулоресцентному конфокальному мікроскопі зображення створються послідовним переміщенням проміня лазера від точки до точки кадру, реєстрація флуоресценції та наступна реконструкція зображення на компьютері. Як виявилось, цей метод мав певні недоліки. Явище дифракції накладає певні фізичні обмеження на мінімальний розмір сфокусованого лазерного проміня, а отже і на максимальне просторове розділення методу.
Згодом зясувалось, що цей дифракційний барєр може бути подоланий багатьма різними методами, що відкривало можливості для оптичної флуоресцентної мікроскопії надвисокої роздільної здатності[109][110].
Одним із перших способів стала STED мікроскопія (від англ. stimulated emission depletion). В основі цього методу лежить взаємодія флуорофорів збуджених звичайним лазерним імпульсом із наступним STED-імпульсом. Якщо збуджені молекули флуорофору опромінити електромагнітним імпульсом, який за енергією відповідає очікуваній енергії випромінення флуорофору, відбувається примусове пригнічення еміссії (stimulated emission depletion). Флуорофори що попали під STED-імпульс не можуть флуоресціювати. Якщо варіювати фази збуджуючого та STED-імпульсів, можна отримати різну їх локазізацію у просторі. Так, малюнок зправа показує проекцію початкового лазерного імпульсу, форму STED-імпульсу, та ділянку що містить збуджені флуорофори після накладання двох імпульсів.
Завдяки цьому зменшено площу одначасного збудження, а отже підвищено просторове розділення методу. На фотографія внизу показане порівняння зображень одного і того самого обєкта що зроблені із використанням скануючої конфокальної та STED-мікроскопії.

Примітки
- ↑ а б в г д е ж и к л м н Joseph R. Lakowicz. Principles of Fluorescence Spectroscopy. — Springer Science+Business Media, 2006. — ISBN 978-0387-31278-1.
- ↑ а б Bernard Valeur. Molecular Fluorescence Principles and Applications. — Wiley-VCH Verlag GmbH. — ISBN 3-527-29919-X.
- ↑ Millar, David P. Fluorescence studies of DNA and RNA structure and dynamics // Current Opinion in Structural Biology. — 1996. — Т. 6. — С. 322-326. — DOI:.
- ↑ Royer, C. A. Probing Protein Folding and Conformational Transitions with Fluorescence // Chemical Reviews. — 2006. — Т. 106, вип. 5. — С. 1769-1784. — DOI:.
- ↑ Smith, L. M., Sanders, J. Z., Kaiser, R. J., Hughes, P., Dodd, C., Connell, C. R., Heiner, C., Kent, S. B. H., & Hood, L. E. (1986). Fluorescence detection in automated DNA sequence analysis. Nature, 321(6071), 674-679.
- ↑ Prober, J. M., Trainor, G. L., Dam, R. J., Hobbs, F. W., Robertson, C. W., Zagursky, R. J., Cocuzza, A. J., Jensen, M. A., & Baumeister, K. (1987). A system for rapid DNA sequencing with fluorescent chain-terminating dideoxynucleotides. Science, 238(4825), 336-341.
- ↑ Shendure, J., & Ji, H. (2008). Next-generation DNA sequencing. Nature Biotechnology, 26(10), 1135-1145.
- ↑ McGinn, S., & Gut, I. G. (2012). DNA sequencing – spanning the generations. New Biotechnology.
- ↑ Schepartz, A.; Gonzalez, R. L. Molecular imaging: sine labore nihil // Current Opinion in Chemical Biology. — 2011. — Т. 15. — С. 749–751. — DOI:.
- ↑ а б Drummen, G. P. C. Fluorescent Probes and Fluorescence (Microscopy) Techniques — Illuminating Biological and Biomedical Research // Molecules. — 2012. — Т. 17. — С. 14067-14090. — DOI:.
- ↑ O'Haver, T. C. Development of luminescence spectrometry as an analytical tool // Journal of Chemical Education. — 1978. — Т. 55, вип. 7. — С. 423—428. — DOI:.
- ↑ Rao, J.; Dragulescu-Andrasi, A.; Yao, H. Fluorescence imaging in vivo: recent advances // Current Opinion in Biotechnology. — 2007. — Т. 18. — С. 17–25. — DOI:.
- ↑ Hilderbrand, S. A.; Weissleder, R. Near-infrared fluorescence: application to in vivo molecular imaging // Current Opinion in Chemical Biology. — 2010. — Т. 14. — С. 71–79. — DOI:.
- ↑ Kobayashi, H., Ogawa, M., Alford, R., Choyke, P. L., & Urano, Y. New Strategies for Fluorescent Probe Design in Medical Diagnostic Imaging // Chemical Reviews. — 2010. — Т. 110, вип. 5. — С. 2620-2640. — DOI:.
- ↑ Gioux, S., Choi, H. S., & Frangioni, J. V. Image-Guided Surgery using Invisible Near-Infrared Light: Fundamentals of Clinical Translation // Molecular Imaging. — 2010. — Т. 9, вип. 5. — С. 237–255.
- ↑ Alander, J. T., Kaartinen, I., Laakso, A., Patila, T., Spillmann, T., Tuchin, V. V., Venermo, M., Valisuo, P. A Review of Indocyanine Green Fluorescent Imaging in Surgery. // International Journal of Biomedical Imaging. — 2012. — DOI:. — 940585.
- ↑ а б в г д е ж и к л м н п р с т Alexander P. Demchenko. Introduction to Fluorescence Sensing. — Springer Science + Business Media B.V, 2009. — ISBN 978-1-4020-9002-8.
- ↑ Udenfriend, S. Development of the spectrophotofluorometer and its commercialization // Protein Science. — 1995. — Т. 4, вип. 3. — С. 542-551. — DOI:.
- ↑ Е. В. КУДРЯШОВА, А. К. ГЛАДИЛИН, А. В. ЛЕВАШОВ. БЕЛКИ В НАДМОЛЕКУЛЯРНЫХ АНСАМБЛЯХ: ИССЛЕДОВАНИЕ СТРУКТУРЫ МЕТОДОМ РАЗРЕШЕННО–ВРЕМЕННОЙ ФЛУОРЕСЦЕНТНОЙ АНИЗОТРОПИИ // Успехи биологической химии. — 2002. — Т. 42 (19 травня). — С. 257-294.
- ↑ а б Weiss, S. Measuring conformational dynamics of biomolecules by single molecule fluorescence spectroscopy // Nature Structural Biology. — 2000. — Т. 7, вип. 9. — С. 724—729. — DOI:.
- ↑ Selvin, P. R. The renaissance of fluorescence resonance energy transfer // Nature Structural Biology. — 2000. — Т. 7, вип. 9. — С. 730-734. — DOI:.
- ↑ Klostermeier, D., Millar, D. P. Time-resolved fluorescence resonance energy transfer: A versatile tool for the analysis of nucleic acids // Biopolymers. — 2002. — Т. 61, вип. 3. — С. 159–179. — DOI:.
- ↑ Ambrose, W. P., Goodwin, P. M., Jett, J. H., Van Orden, A., Werner, J. H., & Keller, R. A. Single Molecule Fluorescence Spectroscopy at Ambient Temperature // Chemical Reviews. — 1999. — Т. 99, вип. 10. — С. 2929-2956. — DOI:.
- ↑ Tinnefeld, P., & Sauer, M. Branching Out of Single-Molecule Fluorescence Spectroscopy: Challenges for Chemistry and Influence on Biology. // Angewandte Chemie International Edition. — 2005. — Т. 44. — С. 2642–2671. — DOI:.
- ↑ Ha, T. Single-molecule fluorescence methods for the study of nucleic acids // Current Opinion in Structural Biology. — 2001. — Т. 11. — С. 287–292. — DOI:.
- ↑ а б Haran, G. Single-molecule fluorescence spectroscopy of biomolecular folding // Journal of Physics: Condensed Matter. — 2003. — Т. 15. — С. 1292-1313. — DOI:.
- ↑ Michalet, X., Weiss, S., & Jäger, M. Single-Molecule Fluorescence Studies of Protein Folding and Conformational Dynamics // Chemical Reviews. — 2006. — Т. 106, вип. 5. — С. 1785-1813. — DOI:.
- ↑ Hohlbein, J., Gryte, K., Heilemann, M., & Kapanidis, A. N. Surfing on a new wave of single-molecule fluorescence methods // Physical Biology. — 2010. — Т. 7, вип. 3. — С. 031001. — DOI:.
- ↑ Moerner, W. E.; Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy // Review of Scientific Instruments. — 2003. — Т. 74. — С. 3597—3619. — DOI:.
- ↑ Persson, F., Barkefors, I., & Elf, J. Single molecule methods with applications in living cells // Current Opinion in Biotechnology. — 2013. — Т. 24, вип. 4. — С. 737–744. — DOI:.
- ↑ Delehanty, J. B., Bradburne, C. E., Susumu, K., Boeneman, K., Mei, B. C., Farrell, D., Blanco-Canosa, J. B., Dawson, P. E., Mattoussi, H., & Medintz, I. L. Spatiotemporal Multicolor Labeling of Individual Cells Using Peptide-Functionalized Quantum Dots and Mixed Delivery Techniques // Journal of the American Chemical Society. — 2011. — Т. 133, вип. 27. — С. 10482-10489. — DOI:.
- ↑ а б Ko, S.-K.; Chen, X.; Yoon, J.; Shin, I. Zebrafish as a good vertebrate model for molecular imaging using fluorescent probes // Chemical Society Reviews. — 2011. — Т. 40, вип. 5. — С. 2120-2130. — DOI:.
- ↑ Bo Huang. Super-resolution optical microscopy: multiple choices // Current Opinion in Chemical Biology. — 2010. — Т. 14, вип. 1. — С. 10–14. — DOI:.
- ↑ Lothar Schermelleh, Rainer Heintzmann, Heinrich Leonhardt. A guide to super-resolution fluorescence microscopy // The Journal of Cell Biology. — 2010. — Т. 190, вип. 2. — С. 165. — DOI:.
- ↑ а б Alexander P. Demchenko. Ultraviolet Spectroscopy of Proteins. — Springer, 1986. — ISBN 978-3642708497.
- ↑ Crespo-Hernandez, C. E.; Cohen, B.; Hare, P. M.; Kohler, B. Ultrafast Excited-State Dynamics in Nucleic Acids // Chemical Reviews. — 2004. — Т. 104, вип. 4. — С. 1977-2020. — DOI:.
- ↑ Waggoner, A. Fluorescent labels for proteomics and genomics // Current Opinion in Chemical Biology. — 2006. — Т. 10, вип. 1. — С. 62—66. — DOI:.
- ↑ Du, W.; Wang, Y.; Luo, Q.; Liu, B.-F. Optical molecular imaging for systems biology: from molecule to organism // Analytical and Bioanalytical Chemistry. — 2006. — Т. 386, вип. 3. — С. 444—457. — DOI:.
- ↑ Lavis, L. D. Histochemistry: Live and in Color // Journal of Histochemistry & Cytochemistry. — 2011. — Т. 59, вип. 2. — С. 139—145. — DOI:.
- ↑ Ueno, T.; Nagano, T. Fluorescent probes for sensing and imaging // Nature Methods. — 2011. — Т. 8. — С. 642-645. — DOI:.
- ↑ а б Lavis, L. D.; Raines, R. T. Bright Ideas for Chemical Biology // ACS Chemical Biology. — 2008. — Т. 3, вип. 3. — С. 142-155. — DOI:.
- ↑ а б Zheng, H.; Zhan, X.-Q.; Bian, Q.-N.; Zhang, X.-J. Advances in modifying fluorescein and rhodamine fluorophores as fluorescent chemosensors // Chemical Communications. — 2012. — Т. 49. — С. 429-447. — DOI:.
- ↑ Beija, M.; Afonso, C. A. M.; Martinho, J. M. G. Synthesis and applications of Rhodamine derivatives as fluorescent probes // Chemical Society Reviews. — 2009. — Т. 38, вип. 8. — С. 2410-2433. — DOI:.
- ↑ Boens, N.; Leen, V.; Dehaen, W. Fluorescent indicators based on BODIPY // Chemical Society Reviews. — 2012. — Т. 41. — С. 1130–1172.
- ↑ Tatikolov, A. S. Polymethine dyes as spectral-fluorescent probes for biomacromolecules // Journal of Photochemistry and Photobiology C: Photochemistry Reviews. — 2012. — Т. 13, вип. 1. — С. 55–90. — DOI:.
- ↑ Beverina, L.; Salice, P. Squaraine Compounds: Tailored Design and Synthesis towards a Variety of Material Science Applications // European Journal of Organic Chemistry. — 2010. — С. 1207-1225. — DOI:.
- ↑ Chen, X.; Pradhan, T.; Wang, F.; Kim, J. S.; Yoon, J. Fluorescent Chemosensors Based on Spiroring-Opening of Xanthenes and Related Derivatives // Chemical Reviews. — 2012. — Т. 112. — С. 1910–1956. — DOI:.
- ↑ Grimm, J. B.; Heckman, L. M.; Lavis, L. D.; May, C. M. The Chemistry of Small-Molecule Fluorogenic Probes // Progress in Molecular Biology and Translational Science. — 2013. — Т. 113. — С. 1-13. — DOI:.
- ↑ Wysocki, L. M.; Lavis, L. D. Advances in the chemistry of small molecule fluorescent probes // Current Opinion in Chemical Biology. — 2011. — Т. 15, вип. 6. — С. 752—759. — DOI:.
- ↑ Sun, Y.-Q.; Liu, J.; Lv, X.; Liu, Y.; Zhao, Y.; Guo, W. Rhodamine-Inspired Far-Red to Near-Infrared Dyes and Their Application as Fluorescence Probes // Angewandte Chemie International Edition. — 2012. — Т. 51, вип. 31. — С. 7634–7636. — DOI:.
- ↑ Finney, N. S. Combinatorial discovery of fluorophores and fluorescent probes // Current Opinion in Chemical Biology. — 2006. — Т. 10, вип. 3. — С. 238-245. — DOI:.
- ↑ Bünzli, J.-C. G. Lanthanide Luminescence for Biomedical Analyses and Imaging // Chemical Reviews. — Т. 110. — С. 2729–2755. — DOI:.
- ↑ Shimomura O, Johnson F, Saiga Y (1962). "Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea". J Cell Comp Physiol 59 (3): 223–39. doi:10.1002/jcp.1030590302.
- ↑ Ormö M, Cubitt A, Kallio K, Gross L, Tsien R, Remington S. Crystal structure of the Aequorea victoria green fluorescent protein // Science. — 1996. — Т. 273. — С. 1392–1395. — DOI:.
- ↑ Yang F, Moss L, Phillips G. The molecular structure of green fluorescent protein // Nature Biotechnology. — 1996. — Т. 14, вип. 10. — С. 1246–1251. — DOI:.
- ↑ а б Tsien, R. Y. The Green Fluorescent Protein // Annual Review of Biochemistry. — 1998. — Т. 67, вип. 1. — С. 509-544. — DOI:.
- ↑ Zimmer, M. Green Fluorescent Protein (GFP): Applications, Structure, and Related Photophysical Behavior // Chemical Reviews. — 2002. — Т. 102, вип. 3. — С. 759-782. — DOI:.
- ↑ Beat Ludin, Andrew Matus. GFP illuminates the cytoskeleton // Trends in Cell Biology. — 1998. — Т. 8, вип. 2. — С. 72–77. — DOI:.
- ↑ Tsien, R. Y. Building and breeding molecules to spy on cells and tumors // FEBS Letters. — 2005. — Т. 579, вип. 4. — С. 927-932. — DOI:.
- ↑ Giepmans, B. N. G., Adams, S. R., Ellisman, M. H., & Tsien, R. Y. (2006). The Fluorescent Toolbox for Assessing Protein Location and Function. Science, 312(5771), 217-224.
- ↑ Stepanenko, O. V.; Stepanenko, O. V.; Shcherbakova, D. M.; Kuznetsova, I. M.; Turoverov, К. К.; Verkhusha, V. V. Modern f luorescent proteins: from chromophore formation to novel intracellular applications // BioTechniques. — 2011. — Т. 51. — С. 313—327. — DOI:.
- ↑ Zhou, X. X.; Lin, M. Z. Photoswitchable fluorescent proteins: ten years of colorful chemistry and exciting applications // Current Opinion in Chemical Biology. — 2013. — Т. 17, вип. 4. — С. 682-690. — DOI:.
- ↑ Ohba, Y., Fujioka, Y., Nakada, S., Tsuda, M., & May, C. M. Fluorescent Protein-Based Biosensors and Their Clinical Applications. // Progress in Molecular Biology and Translational Science. — 2013. — Т. 113. — С. 313-348. — DOI:.
- ↑ VanEngelenburg, S. B.; Palmer, A. E.,. Fluorescent biosensors of protein function // Current Opinion in Chemical Biology. — 2008. — Т. 12. — С. 60–65. — DOI:.
- ↑ Tiwari, D. K.; Nagai, T. Smart fluorescent proteins: Innovation for barrier-free superresolution imaging in living cells // Development, Growth & Differentiation. — 2013. — Т. 55, вип. 4. — С. 491-507. — DOI:.
- ↑ The Nobel Prize in Chemistry 2008
- ↑ Jyoti K. Jaiswal, Sanford M. Simon. Potentials and pitfalls of fluorescent quantum dots for biological imaging // Trends in Cell Biology. — 2004. — Т. 14, вип. 9 (19 травня). — С. 497–504. — DOI:.
- ↑ Biju, V., Itoh, T., & Ishikawa, M. (2010). Delivering quantum dots to cells: bioconjugated quantum dots for targeted and nonspecific extracellular and intracellular imaging. Chemical Society Reviews, 39(8), 3031-3056.
- ↑ Jin, Z., & Hildebrandt, N. (2012). Semiconductor quantum dots for in vitro diagnostics and cellular imaging. Trends in Biotechnology.
- ↑ Vivero-Escoto, J. L., Huxford-Phillips, R. C., & Lin, W. Silica-based nanoprobes for biomedical imaging and theranostic applications. // Chem. Soc. Rev.. — 2012. — Т. 41 (19 травня). — С. 2673–2685. — DOI:.
- ↑ Wu, C.; Chiu, D. T. Highly Fluorescent Semiconducting Polymer Dots for Biology and Medicine // Angewandte Chemie International Edition. — 2013. — Т. 52 (19 травня). — С. 3086-3109. — DOI:.
- ↑ Han, B., & Wang, E. DNA-templated fluorescent silver nanoclusters // Analytical and Bioanalytical Chemistry. — 2012. — Т. 402, вип. 1 (19 травня). — С. 129-138. — DOI:.
- ↑ Shiang, Y.-C.; Huang, C.-C.; Chen, W.-Y.; Chen, P.-C.; Chang, H.-T. Fluorescent gold and silver nanoclusters for the analysis of biopolymers and cell imaging // Journal of Materials Chemistry. — 2012. — Т. 22. — С. 12972–12982. — DOI:.
- ↑ Lemke, E. A.; Schultz, C. Principles for designing fluorescent sensors and reporters // Nature Chemical Biology. — 2011. — Т. 7. — С. 480–483. — DOI:.
- ↑ J. C. Simpson, B. Joggerst, V. Laketa, F. Verissimo, C. Cetin, H. Erfle, M. G. Bexiga, V. R. Singan, J.-K. Hériché, B. Neumann, A. Mateos, J. Blake, S. Bechtel, V. Benes, S. Wiemann, J. Ellenberg, R. Pepperkok. Genome-wide RNAi screening identifies human proteins with a regulatory function in the early secretory pathway // Nature Cell Biology. — 2012. — Т. 14 (19 травня). — С. 764–774. — DOI:.
- ↑ Susan M. Gasser. Visualizing Chromatin Dynamics in Interphase Nuclei // Science. — 2002. — Т. 2002, вип. 296 (19 травня). — С. 1412-1416. — DOI:.
- ↑ Nathalie Daigle, Jan Ellenberg. λN-GFP: an RNA reporter system for live-cell imaging // NATURE METHODS. — 2007. — Т. 4, вип. 8 (19 травня). — С. 633-636. — DOI:.
- ↑ Johnson, I. Fluorescent probes for living cells // The Histochemical Journal. — 1998. — Т. 30, вип. 3. — С. 123-140. — DOI:.
- ↑ Shi, W.; Ma, H. Spectroscopic probes with changeable π-conjugated systems // Chemical Communications. — 2012. — Т. 48. — С. 8732-8744. — DOI:.
- ↑ Liu, Z.; He, W.; Guo, Z. Metal coordination in photoluminescent sensing // Chemical Society Reviews. — 2013. — Т. 42, вип. 4. — С. 1568-1600. — DOI:.
- ↑ de Silva, A. P., Gunaratne, H. Q. N., Gunnlaugsson, T., Huxley, A. J. M., McCoy, C. P., Rademacher, J. T., & Rice, T. E. Signaling Recognition Events with Fluorescent Sensors and Switches // Chemical Reviews. — 1997. — Т. 97, вип. 5. — С. 1515-1566. — DOI:.
- ↑ Demchenko, A. P.; Mély, Y.; Duportail, G.; Klymchenko, A. S. Monitoring Biophysical Properties of Lipid Membranes by Environment-Sensitive Fluorescent Probes // Biophysical Journal. — 2009. — Т. 96, вип. 9. — С. 3461-3470. — DOI:.
- ↑ Haidekker, M. A.; Theodorakis, E. A. Molecular rotors—fluorescent biosensors for viscosity and flow // Organic & Biomolecular Chemistry. — 2007. — Т. 5. — С. 1669–1678. — DOI:.
- ↑ Kuimova, M. K. Mapping viscosity in cells using molecular rotors // Physical Chemistry Chemical Physics. — 2012. — Т. 14. — С. 12671–12686. — DOI:.
- ↑ Johnsson, N.; Johnsson, K. Chemical Tools for Biomolecular Imaging // ACS Chemical Biology. — 2007. — Т. 2, вип. 1. — С. 31-38. — DOI:.
- ↑ Terai, T.; Nagano, T. Fluorescent probes for bioimaging applications // Current Opinion in Chemical Biology. — 2008. — Т. 12, вип. 515–521. — DOI:.
- ↑ Franca, L. T. C., Carrilho, E., & Kist, T. B. L. A review of DNA sequencing techniques // Quarterly Reviews of Biophysics. — 2002. — Т. 35, вип. 02. — С. 169-200. — DOI:.
- ↑ Maxam, A. M.; Gilbert, W. A new method for sequencing DNA // Proceedings of the National Academy of Sciences. — 1977. — Т. 74, вип. 2. — С. 560-564.
- ↑ Sanger, F.; Nicklen, S.; Coulson, A. R. DNA sequencing with chain-terminating inhibitors // Proceedings of the National Academy of Sciences. — 1977. — Т. 74, вип. 12. — С. 5463-5467.
- ↑ Ju, J.; Kim, D. H.; Bi, L.; Meng, Q.; Bai, X.; Li, Z.; Li, X.; Marma, M. S.; Shi, S.; Wu, J.; Edwards, J. R.; Romu, A.; Turro, N. J. Four-color DNA sequencing by synthesis using cleavable fluorescent nucleotide reversible terminators // Proceedings of the National Academy of Sciences. — 2006. — Т. 103, вип. 52. — С. 19635-19640. — DOI:.
- ↑ а б Tyagi, S.; Kramer, F. R. Molecular Beacons: Probes that Fluoresce upon Hybridization // Nature Biotechnology. — Т. 14, вип. 3. — С. 303-308. — DOI:.
- ↑ Guo, J.; Ju, J.; Turro, N.,. Fluorescent hybridization probes for nucleic acid detection. // Analytical and Bioanalytical Chemistry. — 2011. — Т. 402, вип. 10. — С. 3115-3125. — DOI:.
- ↑ Didenko, V. V. DNA Probes Using Fluorescence Resonance Energy Transfer (FRET): Designs and Applications (pdf) // BioTechniques. — 2001. — Т. 31. — С. 1106-1121.
- ↑ Juskowiak, B. Nucleic acid-based fluorescent probes and their analytical potential // Analytical and Bioanalytical Chemistry. — Т. 399, вип. 9. — С. 3157-3176. — DOI:.
- ↑ Tyagi S, Bratu DP, Kramer FR. Multicolor molecular beacons for allele discrimination // Nature Biotechnology. — 1998. — Т. 16. — С. 49 - 53. — DOI:.
- ↑ Ranasinghe, R. T.; Brown, T. Fluorescence based strategies for genetic analysis // Chemical Communications. — 2005. — С. 5487–5502. — DOI:.
- ↑ Silverman, A. P.; Kool, E. T. Quenched probes for highly specific detection of cellular RNAs // Trends in Biotechnology. — 2005. — Т. 23, вип. 5. — С. 225-230. — DOI:.
- ↑ Tyagi, S. Imaging intracellular RNA distribution and dynamics in living cells // Nature Methods. — 2009. — Т. 6, вип. 5. — С. 331-338. — DOI:.
- ↑ Wang, K.; Huang, J.; Yang, X.; He, X.; Liu, J. Recent advances in fluorescent nucleic acid probes for living cell studies // Analyst. — 2013. — Т. 138. — С. 62–71. — DOI:.
- ↑ а б Sassolas, A.; Leca-Bouvier, B. D.; Blum, L. J. DNA Biosensors and Microarrays // Chemical Reviews. — 2008. — Т. 108. — С. 109−139. — DOI:.
- ↑ Pirrung, M. C. Spatially Addressable Combinatorial Libraries // Chemical Reviews. — 1997. — Т. 97, вип. 2. — С. 473-488. — DOI:.
- ↑ Kapuscinski, J. DAPI: a DNA-Specific Fluorescent Probe // Biotechnic & Histochemistry. — 1995. — Т. 70, вип. 5. — С. 220-233. — DOI:.
- ↑ Yarmoluk, S. M.; Kovalska, V. B.; Losytskyy, M. Y. Symmetric cyanine dyes for detecting nucleic acids // Biotechnic & Histochemistry. — 2008. — Т. 83. — С. 131-145. — DOI:.
- ↑ Vummidi, B. R.; Alzeer, J.; Luedtke, N. W. Fluorescent Probes for G-Quadruplex Structures // ChemBioChem. — 2013. — Т. 14, вип. 5. — С. 540-558. — DOI:.
- ↑ Neto, B. A. D.; Correa, J. R.; Silva, R. G.,. Selective mitochondrial staining with small fluorescent probes: importance, design, synthesis, challenges and trends for new markers. // RSC Advances. — 2013. — Т. 3. — С. 5291-5301. — DOI:.
- ↑ Wahlfors, J.; Loimas, S.; Pasanen, T.; Hakkarainen, T. Green fluorescent protein (GFP) fusion constructs in gene therapy research // Histochemistry and Cell Biology. — 2001. — Т. 115. — С. 59-65. — DOI:.
- ↑ Zhang, J.; Campbell, R. E.; Ting, A. Y.; Tsien, R. Y. Creating new fluorescent probes for cell biology // Nature Reviews Molecular Cell Biology. — 2002. — Т. 3, вип. 12. — С. 906-918. — DOI:.
- ↑ а б Lichtman, J. W.; Conchello, J.-A. Fluorescence microscopy // Nature Methods. — 2005. — Т. 2, вип. 12. — С. 910-919. — DOI:.
- ↑ Bo Huang, Hazen Babcock, Xiaowei Zhuang. Breaking the Diffraction Barrier: Super-Resolution Imaging of Cells // Cell. — 2010. — Т. 143. — С. 1047-1058. — DOI:.
- ↑ Hell, S. W. Far-Field Optical Nanoscopy // Science. — 2007. — Т. 316. — С. 1153-1158. — DOI:.
Бібліографія
- Joseph R. Lakowicz. Principles of Fluorescence Spectroscopy. — Springer, 2006.
| Це незавершена стаття з біології. Ви можете допомогти проєкту, виправивши або дописавши її. |













![{\displaystyle {\frac {F_{0}}{F}}=1+k_{sv}\cdot [\mathrm {Q} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23bb1964499fd590115eb53320b354df79953d03)


![{\displaystyle ~[Q]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c92cc58f3939254a26e4d9ebd7731134ebe7046)

