Альфа-спіраль
| Ця стаття не містить посилань на джерела. (лютий 2014) |
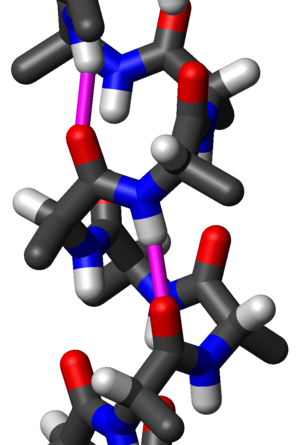
Альфа-спіраль (α-спіраль) — типовий елемент вторинної структури білків, що має форму правозакрученої гвинтової лінії, і якій кожна аміногрупа (-NH2) в каркасі утворює водневий зв'язок з карбонільною групою (-C=0) амінокислоти, що знаходиться на чотири амінокислоти раніше (водневий зв'язок ). Цей елемент вторинної структури інколи також називається класичною альфа-спіраллю Полінга-Корі-Бренсона.
Експериментальне визначення[ред. | ред. код]
Класичним методом є дихроїзм (CD). Також використовується ІЧ-спектроскопія та методи на основі визначення розмірів молекул. Часто застосовується й пряме встановлення структури методами ЯМР.
Амінокислотні залежності[ред. | ред. код]
Амінокислоти різняться за схильністю формувати α-спіральні фрагменти в білках. Метіонін(M), аланін(A), лейцин(L), глутамін (E) та лізин(K) («MALEK») зустрічаються в таких фрагментах частіше за інші, а пролін та гліцин - рідше. Залишок проліну, на відміну від інших амінокислотних залишків, не містить амідної NH-групи й не може утворювати водневі зв'язки, тому його введення «розбиває» α-спіральні фрагменти.
| Це незавершена стаття про білки. Ви можете допомогти проєкту, виправивши або дописавши її. |
