Циклолейцин
| Циклолейцин[1] | |
|---|---|
| |
| Ідентифікатори | |
| Номер CAS | 52-52-8 |
| PubChem | 2901 |
| Номер EINECS | 200-144-6 |
| DrugBank | DB04620 |
| KEGG | C03969 |
| Назва MeSH | D02.455.426.392.368.450.350 і D12.125.072.170 |
| ChEBI | 40547 |
| RTECS | GY2625000 |
| SMILES | C1CCC(C1)(C(=O)O)N |
| InChI | 1/C6H11NO2/c7-6(5(8)9)3-1-2-4-6/h1-4,7H2,(H,8,9) |
| Номер Бельштейна | 636626 |
| Властивості | |
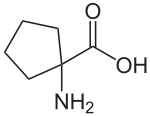
| Молекулярна формула | C6H11NO2 |
| Молярна маса | 129.16 г/моль |
| Зовнішній вигляд | кристалічні пластинки або порошок білого або бежевого кольору |
| Густина | 1.207 г/мл |
| Тпл | 320 |
| Розчинність (вода) | 50 мг/мл |
| Небезпеки | |
| Головні небезпеки | Irritant |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Циклолейцин — непротеїногенна α-амінокислота, яка може розглядатися як циклічна похідна норлейцину. Від цього він відрізняється на молярну масу, меншу на два атоми водню. Визначальним структурним елементом є циклопентанове кільце. Крім того, α-атом вуглецю не є стереоцентром, тому циклолейцин не є хіральним.

Подібно до інших амінокислот, циклолейцин в основному присутній у вигляді цвітер-іону, утворення якого формально можна пояснити тим фактом, що протон карбоксильної групи мігрує до неподіленої пари електронів атома азоту аміногрупи.
Основний гідроліз гетероциклу циклопентаспіро-5'- гідантоїну з подальшою нейтралізацією соляною кислотою дає циклолейцин. Циклізація NCCH2CO2C2H5 1,4-дибромбутаном у присутності гідриду натрію дає етил-1-ізонітрилоциклопентанкарбоксилат. Кислотний гідроліз спиртовою соляною кислотою та нейтралізація спиртовим гідроксидом натрію призводить до циклолейцину[2]. Альтернативні методи синтезу описані в іншій роботі[3].
Циклолейцин є неметаболізованою амінокислотою та специфічним і оборотним інгібітором ферментів, які метилюють нуклеїнові кислоти[4]. Тому його можна використовувати в різноманітних біохімічних експериментах.
- ↑ Cycloleucine at Sigma-Aldrich
- ↑ D. Kalvin, K. Ramalingam, R. Woodard: „A facile procedure for the preparation of alicyclic α-amino acids“, in: Synthetic Communications, 1985, 15 (4), S. 267–272; doi:10.1080/00397918508063798.
- ↑ S. S. Lin, J. Y. Liu, J. M. Wang: „The synthesis of cyclic amino acids“, in: Chinese Chemical Letters, 2003, 14 (9), S. 883–884.
- ↑ M. Caboche, J. P. Bachellerie: „RNA methylation and control of eukaryotic RNA biosynthesis. Effects of cycloleucine, a specific inhibitor of methylation, on ribosomal RNA maturation“, in: European Journal of Biochemistry, 1977, 74 (1), S. 19–29; PMID 856572.