Закон рівнорозподілу
Закон рівнорозподілу — твердження класичної фізики про те, що в стані термодинамічної рівноваги на кожен ступінь вільності молекули припадає в середньому однакова енергія , де — стала Больцмана, T — температура.
Одноатомний ідеальний газ складається з атомів, які мають три ступені вільності, пов'язані з поступальним рухом у трьох напрямках, тому за законом рівнорозподілу на кожен атом в середньому припадає енергія
- .
Теплоємність одноатомного газу дорівнює, відповідно:
- ,
де N — кількість атомів.
Для твердого тіла при високих температурах справедливий закон Дюлонга-Пті, за яким
- ,
де N — кількість атомів. Це означає, що на кожен атом, який здійснює коливання навколо положення рівноваги, припадає 6 ступенів вільності, зв'язаних із коливальним рухом — три компоненти зміщення і три компоненти швидкості.
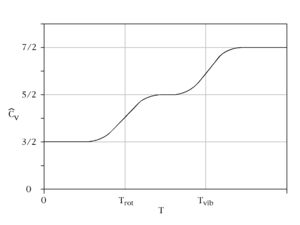
Закон рівнорозподілу справедливий при високих температурах. Третій закон термодинаміки стверджує, що при наближенні температури до абсолютного нуля, теплоємність тіл прямує до нуля. Таким чином, при нульовій температурі речовина не може залишатися ідеальним газом, для якого теплоємність стала величина. При низьких температурах необхідно враховувати квантовий, а не класичний рух частинок. Якщо енергія теплового руху менша від енергії, необхідної для переходу квантової системи в збуджений стан, то відповідні ступені вільності не дають вкладу в теплоємність.
Наприклад, для двоатомних молекул при низьких температурах заморожені всі ступені вільності, крім пов'язаних із поступальним рухом молекули як цілої. При певній температурі збуджується обертання, і теплоємність зростає, при ще вищій температурі енергія теплового руху достатня для збудження коливань, що призводить до нового зростання теплоємності.
Для твердого тіла при низьких температурах справедливий закон Дебая, за яким теплоємність зростає пропорційно кубу температури. Таке зростання зумовлене поступовим збудженням атомних коливань із дедалі більшою частотою. При високих температурах, коли всі коливання збуджені, виконується закон Дюлонга-Пті.
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
| Це незавершена стаття з фізики. Ви можете допомогти проєкту, виправивши або дописавши її. |




