Субталамічне ядро: відмінності між версіями
Kinedw (обговорення | внесок) Створено шляхом перекладу сторінки «Subthalamic nucleus» Мітки: суміш розкладок у тексті Переклад вмісту |
(Немає відмінностей)
|
Версія за 21:01, 20 грудня 2016
| Subthalamic nucleus | |
|---|---|
 Coronal slices of human brain showing the basal ganglia, subthalamic nucleus (STN) and substantia nigra (SN). | |
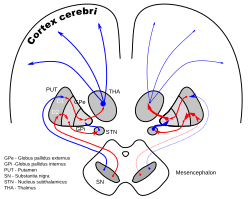 DA-loops in Parkinson's disease | |
| Details | |
| Part of | Basal ganglia |
| Identifiers | |
| Latin | nucleus subthalamicus |
| MeSH | A08.186.211.730.385.800.800 |
| NeuroNames | hier-418 |
| NeuroLex ID | Subthalamic nucleus |
| TA | A14.1.08.702 |
| FMA | 62035 |
| Анатомічні назви нейроанатомії[en] | |
Субталамічне ядро - невелике лінзоподібне за обрисами утворення в головному мозку. Частина системи базальних гангліїв. Як видно з назви, субталамічне ядро розташоване вентрально до таламусу. Відносно чорної субстанції воно розташовується дорсальніше, і медіальніше щодо внутрішньої капсули. Вперше описане Жюль Бернар Луіс (Jules Bernard Luys) в 1865 році[1] , а термін corpus Luysi або Луюісове тіло все ще іноді використовується.
Анатомія
Будова
Основні нейрони, що знаходяться в субталамічному ядрі мають довгі шипуваті дендрити.[2][3] Дендритні гілкоподібні розгалуження частіше еліпсоїдні за формою.[4] Розміри цих розгалужень (1200,600 і 300 мкм) схожі у багатьох видів, включаючи щурів, кішок, мавп і людини — як це не дивно. Однак, кількість нейронів збільшується з розміром мозку, разом зовнішніми розмірами ядра. Основні його нейрони - глутамінергічні, дякуючи цьому, вони обіймають конкретну функціональну позицію в системі базальних гангліїв. Існує також невелика кількість (близько 7,5%) з ГАМК-ергічних інтернейронів , які беруть участь у локальних зв'язках.[5]
Аферентні аксони
Субталамічне ядро отримує основні вхідні імпульси від блідої кулі[6], частково через сочевицеподібну петлю але в основному через радіальні волокна, які перетинають спочатку медіальну частину блідої кулі (як на малюнку) і внутрішньої капсули. Ці аферентні волокна ГАМК-ергічні, гальмівні для нейронів субталамічного ядра. Збудливі, глутамінергічні вхідні імпульси надходять з кори головного мозку (особливо моторної кори), і від pars parafascicularis з центрального комплексу. Cубталамічне ядро також отримує нейромодулюючі імпульси дофамінергічних аксонів від чорної субстанції, її компактної частини (pars compacta substantiae nigrae).[7]
Еферентні зв'язки
Латеропалідо-гіпоталамічна система
Аксони нейронів субталамічного ядра покидають ядро з дорзального боку. Ці еферентні аксони глутамінергічні (збуджуючі). Окрім зв'язків зі стріатумом, більшість субталамічних основних нейронів є багатоцільовими й мають множинні зв'язки з іншими елементами основних базальних гангліїв.[8] Деякі з них посилають аксони до чорної субстанції медіально та до медіального і латеральної ядер блідої кулі латерально ("трьохцільові", 21.3%). Деякі з них "двохцільові" пов'язані з бічними сегментами блідої кулі і чорної субстанції (2.7%) або латеральною й медіальною блідою кулею (48%). Меншість нейронов "одноцільові" й пов'язані з латеральною частиною блідої кулі..[8][9] В результаті, в 82.7% випадків, аферентація субталамічного ядра - з медіального сегмента блідої кулі
Фізіологія

Субталамічнне ядро
Перший внутрішньоклітинні електричні записи субталамічних нейронів проводили за допомогою гострих електродів у в препараті зрізу мозку щура. У ці записи були зроблені три ключових дослідження, всі три з яких домінували в наступних доповідях про властивості субталамічних розрядів.
Кілька недавніх досліджень були зосереджені на автономних пейсмейкерних властивостях субталамічних нейронів. Ці клітини дуже часто називають "швидкоспайковими пейсмейкерами" (водіями ритму),[10] , так як вони можуть генерувати спонтанні потенціали дії на швидкостях від 80 до 90 Гц у приматів.
Коливальна й синхронна активність[11][12], яка є, швидше за все типовим зразком розряду нейронів субталамічного ядра записана у пацієнтів і тваринних моделей, з меншою кількістю дофамінергічних клітин у pars compacta чорної речовини є основою патологічних змін, які лежать в основі хвороби Паркінсона.
Латеропалідарно-субталамічна система
Міцні взаємні зв'язки поєднують субталамічне ядро й зовнішній сегмент блідої кулі, які й є по суті "швидкоспайковими пейсмейкерами". Разом, вони, як вважають, утворюють "центральний ритмоводій" базальних гангліїв"[13], з синхронними серійними розрядами потенціалів дії.
Деякі аксони з латерального сегмента блідої кулі йдуть в стріатум.[14] Активність медіальної блідої кулі знаходиться під впливом аферентних волокон від латерального сегмента блідої кулі і субталамічного ядра.[15] Як і у випадку з ретикулярною часткою чорної речовини.[9] Субталамічне ядро посилає аксони до іншого регулятора - педункуло-понтінного комплексу.
Вважається що латеропалідарно-субталамічна система, відіграє ключову роль у генерації патернів активності, помічених при хворобі Паркінсона.[16]
Патофізіологія
Хронічна стимуляція субталамічних ядер, так звана глибока стимуляція мозку (deep brain stimulation (DBS)) , використовується для лікування пацієнтів з хворобою Паркінсона. Першими повинні стимулюватися термінальні розгалуження аферентних аксонів, які модерують активність гіпоталамічних нейронів. Однак, як було показано в таламічних зрізах мишей,[17] , стимул викликає також вивільнення Аденозину Трифосфат (АТФ), попередник аденозину (через катаболічний процес) сусідніми астроцитами. У свою чергу, активація аденозинових А1 рецепторів пригнічує активацію нервової передачі в таламусі, таким чином імітуючи зникнення або пошкодження субталамічного ядра.
Одностороннє знищення або порушення субталамічного ядра, що може звичайно відбуватися через невеликий судинний інсульт у пацієнтів з діабетом, гіпертонією, або тривалим палінням – викликає гемібалізм.
Одна з непідтверджених функцій СТЯ - контролю імпульсів, порушення якого веде до Обсесивно–компульсивний розлад.[18] Штучна стимулюючи СТЯ дає обнадійливі результати щодо корекції тяжких імпульсивних розладів поведінки й надалі може бути використана в якості альтернативного лікування для цього стану.[19]
Функція
Функція СТЯ невідома, але сучасні теорії бачать його як компонент базальних гангліїв . Його дисфункція веде до збільшення імпульсивної поведінки.[20]
Дослідження показали, що субталамічне ядро - екстрапірамідний центр. Він тримає на контролі м'язові рефлекси, і його пошкодження можуть призвести до гемібалізму (від грец. ballismos – підскакування) (насильницькоих розмашистих рухів руки і ноги на одній стороні тіла).[21]
Додаткові зображення
-
Coronal section of brain immediately in front of pons. Subthalamic nucleus labeled as "Nucleus of Luys".
Посилання
- ↑ Luys, Jules Bernard (1865). Recherches sur le système cérébro-spinal, sa structure, ses fonctions et ses maladies (French) . Paris: Baillière.
- ↑ Afsharpour, S. (1985). Light microscopic analysis of Golgi-impregnated rat subthalamic neurons. Journal of Comparative Neurology. 236 (1): 1—13. doi:10.1002/cne.902360102. PMID 4056088.
- ↑ Rafols, J. A.; Fox, C. A. (1976). The neurons in the primate subthalamic nucleus: a Golgi and electron microscopic study. Journal of Comparative Neurology. 168 (1): 75—111. doi:10.1002/cne.901680105. PMID 819471.
- ↑ Yelnik, J.; Percheron, G. (1979). Subthalamic neurons in primates : a quantitative and comparative anatomy. Neuroscience. 4 (11): 1717—1743. doi:10.1016/0306-4522(79)90030-7. PMID 117397.
- ↑ Levesque J.C.; Parent A. (2005). GABAergic interneurons in human subthalamic nucleus. Movement Disorders. 20 (5): 574—584. doi:10.1002/mds.20374. PMID 15645534.
- ↑ Canteras NS, Shammah-Lagnado SJ, Silva BA, Ricardo JA (April 1990). Afferent connections of the subthalamic nucleus: a combined retrograde and anterograde horseradish peroxidase study in the rat. Brain Res. 513 (1): 43—59. doi:10.1016/0006-8993(90)91087-W. PMID 2350684.
- ↑ Cragg S.J.; Baufreton J.; Xue Y.; Bolam J.P.; Bevan M.D. (2004). Synaptic release of dopamine in the subthalamic nucleus. European Journal of Neuroscience. 20 (7): 1788—1802. doi:10.1111/j.1460-9568.2004.03629.x. PMID 15380000.
{{cite journal}}: Проігноровано невідомий параметр|last-author-amp=(довідка) - ↑ а б Nauta HJ, Cole M (July 1978). Efferent projections of the subthalamic nucleus: an autoradiographic study in monkey and cat. J. Comp. Neurol. 180 (1): 1—16. doi:10.1002/cne.901800102. PMID 418083.
- ↑ а б Smith, Y.; Hazrati, L-N.; Parent, A. (1990). Efferent projections of the subthalamic nucleus in the squirrel monkey as studied by the PHA-L anterograde tracing method. Journal of Comparative Neurology. 294 (2): 306—323. doi:10.1002/cne.902940213. PMID 2332533.
- ↑ Surmeier D.J.; Mercer J.N.; Chan C.S. (2005). Autonomous pacemakers in the basal ganglia: who needs excitatory synapses anyway?. Current Opinion in Neurobiology. 15 (3): 312—318. doi:10.1016/j.conb.2005.05.007. PMID 15916893.
{{cite journal}}: Проігноровано невідомий параметр|last-author-amp=(довідка) - ↑ Levy R.; Hutchison W.D.; Lozano A.M.; Dostrovsky J.O. (2000). High-frequency Synchronization of Neuronal Activity in the Subthalamic Nucleus of Parkinsonian Patients with Limb Tremor. The Journal of Neuroscience. 20 (20): 7766—7775. PMID 11027240.
{{cite journal}}: Проігноровано невідомий параметр|last-author-amp=(довідка) - ↑ Lintas A.; Silkis I.G.; Albéri L.; Villa A.E.P. (2012). Dopamine deficiency increases synchronized activity in the rat subthalamic nucleus. Brain Research. 1434 (3): 142—151. doi:10.1016/j.brainres.2011.09.005. PMID 21959175.
- ↑ Plenz, D. & Kitai, S.T. (1999). A basal ganglia pacemaker formed by the subthalamic nucleus and external globus pallidus. Nature. 400 (6745): 677—682. doi:10.1038/23281. PMID 10458164.
- ↑ Sato, F.; Lavallée, P.; Levesque, M. & Parent, A. (2000). Single-axon tracing study of neurons of the external segment of the globus pallidus in primate. Journal of Comparative Neurology. 417 (1): 17—31. doi:10.1002/(SICI)1096-9861(20000131)417:1<17::AID-CNE2>3.0.CO;2-I. PMID 10660885.
- ↑ Smith, Y.; Wichmann, T. & DeLong, M.R. (1994). Synaptic innervation of neurones in the internal pallidal segment by the subthalamic nucleus and the external pallidum in monkeys. Journal of Comparative Neurology. 343 (2): 297—318. doi:10.1002/cne.903430209. PMID 8027445.
- ↑ Bevan M.D.; Magill P.J.; Terman D.; Bolam J.P.; Wilson CJ. (2002). Move to the rhythm: oscillations in the subthalamic nucleus-external globus pallidus network. Trends in Neurosciences. 25 (10): 525—531. doi:10.1016/S0166-2236(02)02235-X. PMID 12220881.
{{cite journal}}: Проігноровано невідомий параметр|last-author-amp=(довідка) - ↑ Bekar L.; Libionka W.; Tian G.; Xu Q.; Torres A.; Wang X.; Lovatt D.; Williams E.; Takano T.; Schnermann J.; Bakos R.; Nedergaard M. (2008). Adenosine is crucial for deep brain stimulation–mediated attenuation of tremor. Nature Medicine. 14 (1): 75—80. doi:10.1038/nm1693. PMID 18157140.
- ↑ Carter, Rita. The Human Brain Book. с. 58, 233.
- ↑ L, Mallet; Polosan M, Jaafari N, Baup N, Welter ML, Fontaine D та ін. (2008). Subthalamic nucleus stimulation in severe obsessive-compulsive disorder. New England Journal of Medicine. 359: 2121. doi:10.1056/NEJMoa0708514.
- ↑ Frank, M.; Samanta, J.; Moustafa, A.; Sherman, S. (2007). Hold Your Horses: Impulsivity, Deep Brain Stimulation, and Medication in Parkinsonism. Science. 318 (5854): 1309—12. doi:10.1126/science.1146157. PMID 17962524.
- ↑ Bruce H. Robinson (2007). Biomedicine - A textbook for Practitioners of Acupuncture & Oriental Medicine. Blue Poppy Press. с. 126. ISBN 1-891845-38-1. LCCN 2006940894.
