Мітохондріальний біогенез: відмінності між версіями
Створено шляхом перекладу сторінки «Mitochondrial biogenesis» |
(Немає відмінностей)
|
Версія за 13:37, 12 березня 2023
Мітохондріальний біогенез — це процес, за допомогою якого клітини збільшують кількість мітохондрій.[1][2]
Вперше це був описаний Джоном Холлозі в 1960-х роках, коли було виявлено, що тренування на фізичну витривалість спричиняють підвищення вмісту мітохондрій, що призводить до більшого поглинання глюкози м’язами.[3] Мітохондріальний біогенез активується численними різними сигналами під час клітинного стресу або у відповідь на подразники навколишнього середовища, такі як аеробні вправи.[1][2][4]
Передумови
Здатність мітохондрій до самовідтворення корениться в її еволюційній історії. Зазвичай вважають, що мітохондрії походять від клітин, які утворили ендосимбіотичні відносини з α-протобактеріями; вони мають власний геном для реплікації.[5] Однак останні дані свідчать про те, що мітохондрії могли еволюціонувати й без симбіозу.[6] Мітохондрія є ключовим регулятором метаболічної активності клітини, а також є важливою органелою як у виробництві, так і в розпаді вільних радикалів.[7] Вважається, що більша кількість мітохондріальних копій (або більша маса мітохондрій) є захисним та адаптаційним механізмом клітини.
Мітохондрії утворюються в результаті транскрипції та трансляції генів як у ядерному геномі, так і в мітохондріальному геномі. Більшість мітохондріального білка походить із ядерного геному, тоді як мітохондріальний геном кодує частини ланцюга транспортування електронів разом із мітохондріальною рРНК і тРНК. Мітохондріальний біогенез збільшує кількість метаболічних ферментів для гліколізу, окисного фосфорилювання та, зрештою, для більшої метаболічної здатність мітохондрій. Залежно від доступних енергетичних субстратів і окисно-відновного стану клітини, клітина може збільшувати або зменшувати кількість і розмір мітохондрій.[8] Важливо те, що кількість і морфологія мітохондрій змінюються залежно від типу клітини та специфічного контексту попиту, завдяки чому баланс між злиттям/поділом мітохондрій регулює розподіл, морфологію та функцію мітохондрій.[9][8]
Імпорт білку

Оскільки більшість мітохондріальних білків походить з ядерного геному, білки повинні бути належним чином спрямовані та транспортовані в мітохондрії для виконання своїх функцій.[8][10][11] Спочатку мРНК транслюється в цитозолі клітини.[10][11] У результаті отримані розгорнуті білки-попередники зможуть досягти відповідних мітохондріальних компартментів.[11][10] Білки-попередники транспортуються в одну з чотирьох областей мітохондрій, які включають зовнішню мембрану, внутрішню мембрану, міжмембранний простір і матрикс.[10][11] Усі білки надходять у мітохондрії через транслоказу на зовнішній мітохондріальній мембрані (TOM).[11][10][5] Деякі білки мають N-кінцевий сигнал націлювання, і ці білки виявляються і транспортуються в матрицю, де потім розщеплюються та згортаються.[12][11][10] Інші білки можуть мати інформацію про націлювання у своїх послідовностях і не включатимуть N-кінцевий сигнал.[11][10]
Протягом останніх двох десятиліть дослідники виявили понад тридцять білків, які беруть участь в імпорті мітохондріальних білків.[11] Коли дослідники дізнаються більше про ці білки та про те, як вони досягають відповідних мітохондріальних відділів, які їх використовують, стає очевидним, що існує безліч процесів, які працюють разом у клітині, щоб забезпечити мітохондріальний біогенез.[11][8]
Злиття і поділ
Мітохондрії дуже різноманітні і здатні змінювати свою форму в результаті подій поділу та злиття.[9][8] Поділ — це подія, коли одна сутність розпадається на частини, тоді як злиття — це подія, коли дві або більше сутності з’єднуються, щоб утворити ціле.[8] Процеси поділу та злиття протистоять один одному і дозволяють мітохондріальній мережі постійно перебудовуватися.[9][8] Якщо подразник викликає зміну балансу поділу та злиття в клітині, це може суттєво змінити мітохондріальну мережу.[9][13] Наприклад, посилення поділу мітохондрій призвело б до створення багатьох фрагментованих мітохондрій, що, як було показано, корисно для усунення пошкоджених мітохондрій і для створення менших мітохондрій для ефективного транспортування до енергоспоживаючих областей.[13][14] Таким чином, досягнення балансу між цими механізмами дозволяє клітині мати належну організацію своєї мітохондріальної мережі під час біогенезу та може відігравати важливу роль у адаптації м’язів та нейронів до фізіологічного стресу.[13]
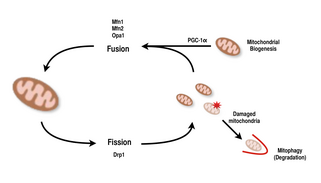
У ссавців як злиття, так і поділ мітохондрій контролюються ГТФазами родини динамінів.[8][13] Процесом поділу мітохондрій керує Drp1, член сімейства цитозольних динамінів.[8][9] Цей білок утворює спіраль навколо мітохондрій і звужується, щоб розбити зовнішню та внутрішню мембрани органели.[14] З іншого боку, процес злиття керується різними білками-динамінами, закріпленими на мембрані, на різних рівнях мітохондрій.[13] Злиття на рівні зовнішньої мітохондріальної мембрани опосередковується Mfn1 і Mfn2 (мітофузини 1 і 2)[15], а злиття на рівні внутрішньої мітохондріальної мембрани опосередковується Opa1.[8][12][13] Численні дослідження спостерігали корельоване збільшення дихальної здатності мітохондрій з експресією генів Mfn1, Mnf2 і Drp1 після вправ на витривалість.[14][15] Таким чином, підтверджується те, що реорганізація мітохондріальної мережі в м’язових клітинах відіграє важливу роль у відповідь на фізичні вправи.[4][13][15]
Регуляція
PGC-1α, член сімейства транскрипційних коактиваторів гамма-рецепторів, активованих проліфератором пероксисом (PGC), є головним регулятором мітохондріального біогенезу.[1][2] [16] Відомо, що він коактивує ядерний респіраторний фактор 2 (NRF2/GABPA) і разом з NRF-2 коактивує ядерний респіраторний фактор 1 (NRF1).[15][16] NRFs, у свою чергу, активують мітохондріальний транскрипційний фактор A (tfam), який безпосередньо відповідає за транскрипцію мітохондріальних білків, кодованих у ядрі.[15][16] Це включає як структурні мітохондріальні білки, так і ті, що беруть участь у транскрипції, трансляції та репарації мтДНК.[16] PGC-1β, білок, структурно подібний до PGC-1α, також бере участь у регуляції мітохондріального біогенезу, але відрізняється тим, що він не збільшується у відповідь на фізичні вправи.[5][17][16] Хоча спостерігалося значне збільшення кількості мітохондрій у тканинах, де PGC-1α надмірно експресується, оскільки кофактор взаємодіє з цими ключовими факторами транскрипції, нокаутовані миші з порушеним PGC-1α все ще життєздатні та демонструють нормальну кількість мітохондрій.[17][5][16] Таким чином, PGC-1α не потрібен для нормального розвитку мітохондрій у мишей, але під час фізіологічного стресу ці миші виявляють знижену толерантність порівняно з мишами з нормальним рівнем PGC-1α.[5][16][17] Подібним чином, у нокаутованих мишей із порушеною PGC-1β, миші демонстрували переважно нормальний рівень мітохондріальної функції зі зниженою здатністю адаптуватися до фізіологічного стресу.[18][5] Однак експеримент з подвійним нокаутом PGC-1α/β створив мишей, які загинули переважно протягом 24 годин через дефекти мітохондріального дозрівання серцевої тканини.[19] Ці знахідки свідчать про те, що, хоча поодинці PGC-1α і PGC-1β не є безумовно необхідними для здатності клітини здійснювати мітохондріальний біогенез, разом вони здатні доповнювати один одного для оптимального дозрівання мітохондрій і функціонування в періоди фізіологічного стресу.[19] [5][17]
AMP-активована кіназа (AMPK) також регулює мітохондріальний біогенез шляхом фосфорилювання та активації PGC-1α після відчуття дефіциту енергії в м’язах та нейронах.[5][16] Було показано, що у мишей зі зниженим співвідношенням АТФ/АМФ під час фізичних вправ виснаження енергії корелює з активацією AMPK. [5][18][16] Активація AMPK продовжувала активувати PGC-1α і NRF у цих мишей, що стимулювало мітохондріальний біогенез.[5][18][16]
Старіння
Було показано, що здатність до мітохондріального біогенезу може зменшуватись з віком, і таке зниження функції мітохондрій може бути пов’язане з розвитком діабету і серцево-судинних захворювань.[20][21][22] Старіння та захворювання можуть викликати зміни в рівнях експресії генів білків, які беруть участь у механізмах поділу та злиття мітохондрій, таким чином створюючи дисфункціональні мітохондрії.[23][24] Один з десяти механізмів старіння пов’язаний з вкороченням теломер, кінцевих сегментів хромосом, які захищають генетичну інформацію від деградації.[21][24] Вкорочення теломер також було пов’язану зі зниженням функції мітохондрій.[24][21] Дефіцит зворотної транскриптази теломерази (TERT), ферменту, який відіграє важливу роль у відновленні і збереженні теломерів, корелює з активованим p53, білком, який пригнічує PGC-1α.[24][23][21] Таким чином, вкорочення теломер і дефіцит TERT були пов’язані з порушенням мітохондріального біогенезу.[21][23][24] Було також показано, що експресія AMPK може зменшуватись з віком, що також може сприяти пригніченню мітохондріального біогенезу.[5][24]
Див. також — Омолодження, Збільшення тривалості життя.
Клінічні застосування націлювання на мітохондріальний біогенез
Мітохондріальний біогенез може бути спрямований на запобігання проліферації раку. Зокрема, два регулятори біогенезу — PGC1α і c-Myc — можуть бути спрямовані на запобігання проліферації раку.
PGC1α є ключовим компонентом мітохондріального біогенезу — як коактиватор транскрипції, він націлений на численні фактори транскрипції та естроген-пов’язаний рецептор альфа (ERRα).[25] Було виявлено, що сполуки, які спрямовані на шлях між PGC1α та ERRα, такі як зворотний агоніст ERRα, XCT-790, можуть значно знижувати мітохондріальний біогенез, таким чином значно зменшуючи проліферацію ракових клітин і підвищуючи їхню чутливість до хіміотерапевтичних засобів.[26]
c-Myc, фактор транскрипції, може бути інгібований під час його димеризації білком Max такими молекулами, як IIA6B17[27] і omomyc.[28] Інгібування комплексу c-Myc-Max може блокувати клітинний цикл і індукувати апоптоз ракових клітин.
Посилання
- ↑ а б в Valero T (2014). Editorial (Thematic Issue: Mitochondrial Biogenesis: Pharmacological Approaches). Current Pharmaceutical Design. 20 (35): 5507—5509. doi:10.2174/138161282035140911142118. PMID 24606795.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) Помилка цитування: Некоректний тег<ref>; назва «pmid24606795» визначена кілька разів з різним вмістом - ↑ а б в Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches. Current Pharmaceutical Design. 20 (35): 5619—33. doi:10.2174/1381612820666140306095106. PMID 24606801. Помилка цитування: Некоректний тег
<ref>; назва «pmid24606801» визначена кілька разів з різним вмістом - ↑ Holloszy JO (April 2011). RRegulation of Mitochondrial Biogenesis and GLUT4 Expression by Exercise. Comprehensive Physiology. 1 (2): 921—40. doi:10.1002/cphy.c100052. ISBN 9780470650714. PMID 23737207.
- ↑ а б Boushel R, Lundby C, Qvortrup K, Sahlin K (October 2014). Mitochondrial plasticity with exercise training and extreme environments. Exercise and Sport Sciences Reviews. 42 (4): 169—74. doi:10.1249/JES.0000000000000025. PMID 25062000. Помилка цитування: Некоректний тег
<ref>; назва «pmid25062000» визначена кілька разів з різним вмістом - ↑ а б в г д е ж и к л м Jornayvaz FR, Shulman GI (2010). Regulation of mitochondrial biogenesis. Essays in Biochemistry. 47: 69—84. doi:10.1042/bse0470069. PMC 3883043. PMID 20533901. Помилка цитування: Некоректний тег
<ref>; назва «:3» визначена кілька разів з різним вмістом - ↑ Harish A, Kurland CG (December 2017). Mitochondria are not captive bacteria. Journal of Theoretical Biology. 434: 88—98. doi:10.1016/j.jtbi.2017.07.011. PMID 28754286.
- ↑ Bevilacqua L, Ramsey JJ, Hagopian K, Weindruch R, Harper ME (May 2004). Effects of short- and medium-term calorie restriction on muscle mitochondrial proton leak and reactive oxygen species production. American Journal of Physiology. Endocrinology and Metabolism. 286 (5): E852-61. doi:10.1152/ajpendo.00367.2003. PMID 14736705.
- ↑ а б в г д е ж и к л Mishra P, Chan DC (February 2016). Metabolic regulation of mitochondrial dynamics. The Journal of Cell Biology. 212 (4): 379—87. doi:10.1083/jcb.201511036. PMC 4754720. PMID 26858267. Помилка цитування: Некоректний тег
<ref>; назва «pmid26858267» визначена кілька разів з різним вмістом - ↑ а б в г д Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M та ін. (June 2016). Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity. Neurobiology of Disease. 90: 3—19. doi:10.1016/j.nbd.2015.10.011. PMID 26494254. Помилка цитування: Некоректний тег
<ref>; назва «pmid26494254» визначена кілька разів з різним вмістом - ↑ а б в г д е ж Dudek J, Rehling P, van der Laan M (February 2013). Mitochondrial protein import: common principles and physiological networks. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1833 (2): 274—85. doi:10.1016/j.bbamcr.2012.05.028. PMID 22683763.
- ↑ а б в г д е ж и к Baker MJ, Frazier AE, Gulbis JM, Ryan MT (September 2007). Mitochondrial protein-import machinery: correlating structure with function. Trends in Cell Biology. 17 (9): 456—64. doi:10.1016/j.tcb.2007.07.010. PMID 17825565.
- ↑ а б Ventura-Clapier R, Garnier A, Veksler V (July 2008). Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha. Cardiovascular Research. 79 (2): 208—17. doi:10.1093/cvr/cvn098. PMID 18430751. Помилка цитування: Некоректний тег
<ref>; назва «:0» визначена кілька разів з різним вмістом - ↑ а б в г д е ж Youle RJ, van der Bliek AM (August 2012). Mitochondrial fission, fusion, and stress. Science. 337 (6098): 1062—5. doi:10.1126/science.1219855. PMC 4762028. PMID 22936770. Помилка цитування: Некоректний тег
<ref>; назва «:6» визначена кілька разів з різним вмістом - ↑ а б в Bo H, Zhang Y, Ji LL (July 2010). Redefining the role of mitochondria in exercise: a dynamic remodeling. Annals of the New York Academy of Sciences. 1201: 121—8. doi:10.1111/j.1749-6632.2010.05618.x. PMID 20649548. Помилка цитування: Некоректний тег
<ref>; назва «:2» визначена кілька разів з різним вмістом - ↑ а б в г д Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S та ін. (August 2005). Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise. The Journal of Physiology. 567 (Pt 1): 349—58. doi:10.1113/jphysiol.2005.092031. PMC 1474174. PMID 15961417. Помилка цитування: Некоректний тег
<ref>; назва «:7» визначена кілька разів з різним вмістом - ↑ а б в г д е ж и к л Johri A, Chandra A, Flint Beal M (September 2013). PGC-1α, mitochondrial dysfunction, and Huntington's disease. Free Radical Biology & Medicine. 62: 37—46. doi:10.1016/j.freeradbiomed.2013.04.016. PMC 3722269. PMID 23602910. Помилка цитування: Некоректний тег
<ref>; назва «pmid23602910» визначена кілька разів з різним вмістом - ↑ а б в г Lin J, Wu PH, Tarr PT, Lindenberg KS, St-Pierre J, Zhang CY та ін. (October 2004). Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice. Cell. 119 (1): 121—35. doi:10.1016/j.cell.2004.09.013. PMID 15454086.
- ↑ а б в Scarpulla RC (July 2011). Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1813 (7): 1269—78. doi:10.1016/j.bbamcr.2010.09.019. PMC 3035754. PMID 20933024. Помилка цитування: Некоректний тег
<ref>; назва «:4» визначена кілька разів з різним вмістом - ↑ а б Lai L, Leone TC, Zechner C, Schaeffer PJ, Kelly SM, Flanagan DP та ін. (July 2008). Transcriptional coactivators PGC-1alpha and PGC-lbeta control overlapping programs required for perinatal maturation of the heart. Genes & Development. 22 (14): 1948—61. doi:10.1101/gad.1661708. PMC 2492740. PMID 18628400.
- ↑ Handy DE, Loscalzo J (June 2012). Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11): 1323—67. doi:10.1089/ars.2011.4123. PMC 3324814. PMID 22146081.
- ↑ а б в г д David R (April 2011). Ageing: Mitochondria and telomeres come together. Nature Reviews. Molecular Cell Biology. 12 (4): 204. doi:10.1038/nrm3082. PMID 21407239.
- ↑ Hagen TM, Wehr CM, Ames BN (November 1998). Mitochondrial decay in aging. Reversal through supplementation of acetyl-L-carnitine and N-tert-butyl-alpha-phenyl-nitrone. Annals of the New York Academy of Sciences. 854: 214—23. doi:10.1111/j.1749-6632.1998.tb09904.x. PMID 9928432.
- ↑ а б в Sahin E, Colla S, Liesa M, Moslehi J, Müller FL, Guo M та ін. (February 2011). Telomere dysfunction induces metabolic and mitochondrial compromise. Nature. 470 (7334): 359—65. doi:10.1038/nature09787. PMC 3741661. PMID 21307849.
- ↑ а б в г д е Sahin E, DePinho RA (May 2012). Axis of ageing: telomeres, p53 and mitochondria. Nature Reviews. Molecular Cell Biology. 13 (6): 397—404. doi:10.1038/nrm3352. PMC 3718675. PMID 22588366.
- ↑ Scarpulla, Richard (2011). Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network. Biochim Biophys Acta. 1813 (7): 1269—1278. doi:10.1016/j.bbamcr.2010.09.019. PMC 3035754. PMID 20933024.
- ↑ Kokabu, Tetsuya; Mori, Taisuke; Matsushima, Hiroshi; Yoriki, Kaori; Kataoka, Hisashi; Tarumi, Yosuke; Kitawaki, Jo (2019). Antitumor effect of XCT790, an ERRα inverse agonist, on ERα-negative endometrial cancer cells. Cell Oncol (Dordr). 42 (2): 223—235. doi:10.1007/s13402-019-00423-5. PMID 30706380.
- ↑ Lu, Xiaohong; Vogt, Peter; Boger, Dale; Lunec, John (2008). Disruption of the MYC transcriptional function by a small-molecule antagonist of MYC/MAX dimerization. Oncol. Rep. Medical Radiology. 19 (3). doi:10.1007/978-3-540-77385-6. ISBN 978-3-540-77384-9. PMID 18288422.
- ↑ Demma, Mark; Mapelli, Claudio; Sun, Angie; Bodea, Smaranda; Ruprecht, Benjamin; Javaid, Sarah; Wiswell, Derek; Muise, Eric; Chen, Shiyang (2019). Omomyc Reveals New Mechanisms To Inhibit the MYC Oncogene. Mol Cell Biol. 39 (22): e00248-19. doi:10.1128/MCB.00248-19. PMC 6817756. PMID 31501275.