Диборан
Перейти до навігації
Перейти до пошуку
| Диборан | |
|---|---|
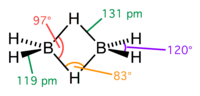
| |

| |
| Систематична назва | Диборан(6) |
| Інші назви | Бороетан |
| Ідентифікатори | |
| Номер CAS | 19287-45-7 |
| Номер EINECS | 242-940-6 |
| ChEBI | 33590 |
| RTECS | HQ9275000 |
| SMILES | [H][B]1([H])[H][B]([H])([H])[H]1 |
| InChI | InChI=1S/B2H6/c1-3-2-4-1/h1-2H2 |
| Номер Гмеліна | 1295 |
| Властивості | |
| Молекулярна формула | B2H6 |
| Молярна маса | 27,67 г/моль |
| Зовнішній вигляд | безбарвний газ |
| Густина | 1,131 г/л[1] |
| Тпл | -164,8 °C[1] |
| Ткип | -92,5 °C[1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Дибора́н — найпростіший бороводень складу B2H6, безбарвний газ із неприємним запахом.
Фізичні властивості[ред. | ред. код]
Диборан — безбарвний газ із неприємним запахом, надзвичайно отруйний. Зріджується за температури −164,8 °C.
Отримання[ред. | ред. код]
У промисловості диборан отримують відновленням галогенідів бору:
Для лабораторних цілей використовуються дешевші реагенти:
Хімічні властивості[ред. | ред. код]
При контакті з повітрям диборан може самозайматися з великим виділенням тепла:
Розчинення у воді дає продуктом борну кислоту:
Реакція з гідрогалогенідами даю заміщення атомів водню:
Галогенпохідні диборану легко диспропорціонують, а також виявляють подібність до реакцій галогеналканів (реакція Вюрца)
Галогени в невеликих кількостях діють на диборан подібно до галогеноводнів, а при їх надлишку відбувається повне заміщення:
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
Джерела[ред. | ред. код]
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Schubert D. M. Boron Hydrides, Heteroboranes, and their Metalla Derivatives // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 4. — P. 227—258. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
| Це незавершена стаття про неорганічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |









