Універсальна газова стала
| Універсальна газова стала | |
| Досліджується в | термодинаміка |
|---|---|
| Першовідкривач або винахідник | Q20871796? |
| Дата відкриття (винаходу) | 1865 |
| Розмірність | |
| Числове значення | 8,314462618153 Дж / (моль·К)[1] |
| Формула | [2] |
| Позначення у формулі | , і |
| Символ величини (LaTeX) | [2] |
| Підтримується Вікіпроєктом | Вікіпедія:Проєкт:Математика |
| Рекомендована одиниця вимірювання | Дж / (моль·К)d[2] і kilogram square metre per square second kelvin moled[2] |
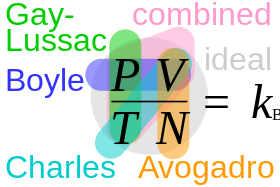 | |
Універсальна газова стала — константа, що дорівнює роботі розширення одного моля ідеального газу в ізобаричному процесі при збільшенні температури на 1 К. Позначається латинською буквою R.
У Міжнародній системі одиниць (SI) універсальна газова стала дорівнює точно
R = 8,31446261815 Дж⁄(моль∙К).
Її значення пов'язане зі сталою Больцмана співвідношенням:
де — число Авогадро.
Форми запису рівняння стану ідеального газу й визначення сталих[ред. | ред. код]
Експериментально визначені рівняння стану класичного ідеального газу мають вигляд
- ,
де P — тиск; V — об'єм, Т — температура; M — маса газу, а Ri — певна, характерна для кожного газу, стала, яка отримала назву індивідуальної газової сталої.
Це рівняння можна записати також у вигляді
- ,
де n —кількість речовини, — молярна маса, а R називається універсальною газовою сталою. Це рівняння відоме під назвою рівняння Менделєєва-Клапейрона.
У фізиці рівняння стану однокомпонентного ідеального газу записують як
- ,
де — стала Больцмана, а N — число молекул газу.
Індивідуальна газова стала[ред. | ред. код]
Індивідуальні газові сталі для різних ідеальних газів зв'язані з універсальною газовою сталою R співвідношенням
- ,
де μ — молярна маса.
Rповітря =287,2 Дж/(кг•К).
Література[ред. | ред. код]
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2013. — Т. 3 : С — Я. — 644 с.
Виноски[ред. | ред. код]
- ↑ Encyclopædia Britannica
- ↑ а б в г 9-37.1 // Quantities and units — Part 9: Physical chemistry and molecular physics — 2 — ISO, 2019. — 17 p.












