Закон Бойля — Маріотта
| Закон Бойля — Маріотта | |
 | |
| Названо на честь | Роберт Бойль і Едм Маріотт |
|---|---|
| Формула | , і |
| Позначення у формулі | , і |
| Підтримується Вікіпроєктом | Вікіпедія:Проєкт:Математика |
| | |
Зако́н Бо́йля—Маріо́тта — один з основних газових законів.
Загальна характеристика[ред. | ред. код]
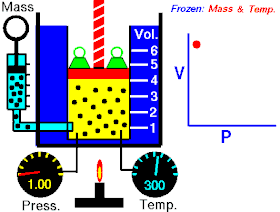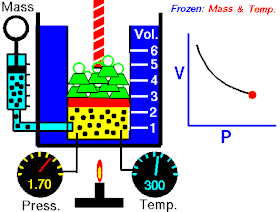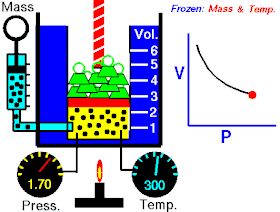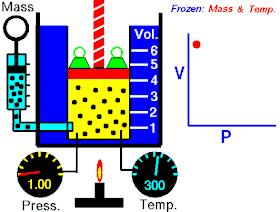
Роберт Бойль 1662 року в результаті численних експериментальних досліджень стисливості повітря, які були виконані ним за постійної температури повітря, дійшов до такого висновку:
Тиски і об'єми перебувають у зворотному відношенні:
або:
До того ж висновку, незалежно від Бойля, дійшов Едм Маріотт 1676 року. Згодом з'ясувалося, що реальні гази підпорядковуються законам газового стану не зовсім точно, однак, газові закони були збережені як закони гіпотетичних, реально не існуючих, ідеальних газів. Пізніше закон Бойля—Маріотта був теоретично виведений з позицій молекулярно-кінетичної теорії.
Найчастіше в підручниках із фізики прийнято таке формулювання закону Бойля—Маріотта:[1].
При постійній температурі й масі газу добуток тиску газу на його об’єм постійний.
У математичній формі це твердження записується у вигляді формули:
або
де
— тиск газу; — об'єм газу, а — постійна в обумовлених умовах величина. У загальному випадку значення обумовлюються хімічною природою, масою й температурою газу. Закон Бойля—Маріотта, як закон фізичного стану ідеальних газів, може бути також сформульовано таким чином: [2].
Добуток абсолютного тиску й об'єму постійної маси ідеального газу при незмінній температурі зберігає незмінну величину або, що те ж, добуток абсолютного тиску й об'єму постійної маси ідеального газу залежить тільки від температури й хімічної природи газу:
або
У цьому формулюванні, наведеному в книзі з термодинаміки, є важливе уточнення (необхідне, зокрема, для вирішення практичних задач) — під тиском мається на увазі абсолютний тиск.
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ Сивухин Д. В., Общий курс физики т. II, 2005, с. 21—22.
- ↑ Белоконь Н. И.,Термодинамика, 1954, с. 48.
Джерела[ред. | ред. код]
- Белоконь, Н. И. Термодинамика. — М. : Госэнергоиздат, 1954. — 417 с.
- Сивухин Д. В. Общий курс физики. — 5-е изд. — М. : Физматлит, 2005. — Т. II. — 544 с. — ISBN 5-9221-0601-5.
Інтернет-ресурси[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Газові закони |












