Пентан
| Пентан | |
|---|---|
![Пікоскопічне зображення молекули пентану та її анімація.[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/04/Picoscopiy_image_of_pentane_molecule_and_animated_model.gif/260px-Picoscopiy_image_of_pentane_molecule_and_animated_model.gif)
| |
| Ідентифікатори | |
| Номер CAS | 109-66-0 |
| PubChem | 8003 |
| Номер EINECS | 203-692-4 |
| DrugBank | DB03119 |
| Назва MeSH | pentane |
| ChEBI | 37830 |
| RTECS | RZ9450000 |
| SMILES | CCCCC |
| InChI | InChI=1S/C5H12/c1-3-5-4-2/h3-5H2,1-2H3 |
| Номер Бельштейна | 969132 |
| Номер Гмеліна | 1766 |
| Властивості | |
| Молекулярна формула | C5H12 |
| Молярна маса | 72,15 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Запах | як бензин [2] |
| Густина | 0.626 g mL−1 |
| Розчинність (вода) | 40 mg L−1 (at 20 °C) |
| Тиск насиченої пари | 57.90 kPa (at 20.0 °C) |
| Кислотність (pKa) | ~45 |
| Основність (pKb) | ~59 |
| Показник заломлення (nD) | 1.358 |
| В'язкість | 0.240 cP (at 20 °C) |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
−174.1–−172.9 kJ mol−1 |
| Ст. ентальпія згоряння ΔcH 298 |
−3.5095–−3.5085 MJ mol−1 |
| Ст. ентропія S 298 |
263.47 J K−1 mol−1 |
| Теплоємність, c p |
167.19 J K−1 mol−1 |
| Небезпеки | |
| ГДК (США) | TWA 1000 ppm (2950 mg/m3)[2] |
| ЛД50 |
|
| ГГС піктограми |    
|
| ГГС формулювання небезпек | 225, 304, 336, 411 |
| ГГС запобіжних заходів | 210, 261, 273, 301+310, 331 |
| Класифікація ЄС | |
| R-фрази | R12, R51/53, R65, Шаблон:R66, R67 |
| S-фрази | S2, S16, S33, S33 |
| NFPA 704 | |
| Вибухові границі | 1.5–7.8 %[2] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Пента́н — органічна сполука з формулою C5H12 — тобто алкан з п'ятьма атомами Карбону. Термін може вказувати на будь-який з трьох структурних ізомерів (пентани), або їх суміш, але згідно номенклатури ІЮПАК, пентан позначає тільки n-пентан; інші два називаються ізопентан[en] (метилбутан) і неопентан (диметилпропан). Циклопентан не є ізомером пентану, бо має лише 10 атомів Гідрогену.
Пікоскопічне зображення та анімація[ред. | ред. код]
Пікоскопічне зображення молекули пентану та її анімація [1]. Пікоскопічне зображення молекули н-пентану (роздільна здатність 10 пікометрів), отримане шляхом денситометрії електронної хмарки[3]. На зображенні видно всі п'ять атомів вуглецю з відповідною просторовою геометрією. Атомів водню на пікоскопічному зображенні [1] нема тому, що іонний зв'язок, це повна передача електрона від одного атома до іншого з утворенням іона. Іоном атома водню є протон. Тобто, іон водню повністю позбавлений електронної хмарки на що вказує список ступенів окислення хімічних елементів заснований на таблиці Грінвуда [4], що й передає пряме пікоскопічне зображення. В результаті у водню зникає електронна хмарка і залишається лише ядро атому. Пікоскопічне зображення пояснюється анімаційною моделлю пентану, праворуч, яка вірно передає форму електронной хмарки сігма-зв'язку між атомами карбону у вуглецевих нанотрубках, руденіті, то що.
Скелетна формула[ред. | ред. код]
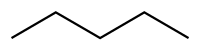
Скелетна формула, або скорочена формула органічної сполуки — це тип молекулярної структурної формули, яка слугує скороченим зображенням зв’язку молекули та деяких деталей її молекулярної геометрії. Скелетна формула показує скелетну структуру або скелет молекули, яка складається з скелетних атомів, які утворюють молекулу[5]. Як показує пікоскопія атомві та молекул[1], саме ця формула найбільш точно відображає органічні сподуки.
Див також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ а б в г Кучеров, О.П.; Лавровський, С.Є. (2022). Видимий атом (PDF). Інформаційні технології та спеціальна безпека. 8 (1): 29—62.
- ↑ а б в NIOSH Pocket Guide to Chemical Hazards #0486. Національний інститут охорони праці (NIOSH).
- ↑ Kucherov O. P. , A. D. Rud A. D. (2018). Direct visualization of individual molecules in molecular crystals by electron cloud densitometry. Molecular Crystals and Liquid Crystals. 1 (10): 40—47. doi:10.1080/15421406.2019.1578510. (англ.)
- ↑ Greenwood, Norman N.; Earnshaw, A. Chemistry of the. — 2-е изд. — Oxford : Butterworth-Heinemann, 1997. — С. 28. — ISBN 0080379419.
- ↑ Stoker, H. Stephen (2012). General, Organic, and Biological Chemistry (вид. 6th). Cengage. ISBN 978-1133103943.[сторінка?]
| |||||
