Бензалхлорид
| Структурна формула | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Загальна інформація | |||||||||||||
| Преференційна назва ІЮПАК | Дихлорометилбензен | ||||||||||||
| Систематична назва ІЮПАК | Дихлорометилбензен | ||||||||||||
| Інші назви |
Бензалхлорид, бензал хлорид, дихлоротолуен | ||||||||||||
| Хімічна формула | C7H6Cl2 | ||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||
| |||||||||||||
| Властивості | |||||||||||||
| Молярна маса | 161,03 г/моль [1][3][2] | ||||||||||||
| Агрегатний стан | |||||||||||||
| Густина |
1,25 г/см3 (20 °C) [3] | ||||||||||||
| Температура плавлення | |||||||||||||
| Температура кипіння |
205,2 °С[3] | ||||||||||||
| Температура самозаймання | |||||||||||||
| Тиск насиченої пари |
0,13 kPa (35,4 °C)[1] | ||||||||||||
| Розчинність |
0.2 г/л (H2O, 20 °C)[3] | ||||||||||||
| Безпека | |||||||||||||
| Маркування згідно системі УГС
Небезпека | |||||||||||||
| H-фрази | H: H302, H315, H318, H331, H335, H351 | ||||||||||||
| P-фрази | P: P261, P280, P305+P351+P338, P311 | ||||||||||||
| EUH-фрази | EUH: Заходи безпеки відсутні | ||||||||||||
| LD50 |
3250 мг/кг (орально, пацюк) [3] | ||||||||||||
| Вибухонебезпечність | |||||||||||||
| Ударна чутливість |
{{{Ударна чутливість}}} | ||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||
Бенза́лхлори́д ― хлороорганічна сполука з формулою . За стандартних умов є безбарвною рідиною з різким запахом.[1][3][2] Добре розчинний в органічних розчинниках, погано в воді.[3]
Вперше бензалхллорид було отримано 1848 року реакцією бензальдегіду з пентахлоридом фосфору:[3]
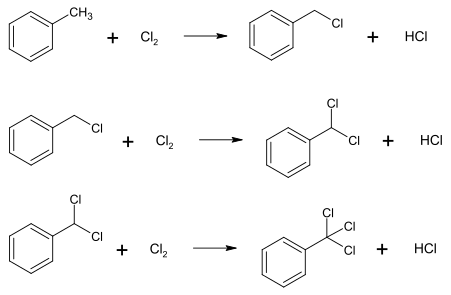
Але зараз сполука виготовляється виключно хлоруванням толуену:[3]
При хлоруванні зазвичай утворюється бензотрихлорид, а в присутності кислот Льюїса хлорується ароматичне кільце.[3]
У кислому чи лужному середовищі відбувається гідроліз з утворенням бензальдегіду. Аналогічно реакція (алкоголіз) відбувається з етанолом.[3]
При взаємодії з натрієм відбувається реакція Вюрца, в резутьтаті чого утворюється стильбен.
- ↑ а б в г д е ж ICSC 0101 - BENZAL CHLORIDE. inchem.org. Архів оригіналу за 10 вересня 2019. Процитовано 16 квітня 2022.
- ↑ а б в г д GESTIS-Stoffdatenbank. gestis.dguv.de. Архів оригіналу за 16 квітня 2022. Процитовано 16 квітня 2022.
- ↑ а б в г д е ж и к л м н п р Lipper, Karl-August; Löser, Eckhard; Brücher, Oliver (28 липня 2017). Wiley-VCH Verlag GmbH & Co. KGaA (ред.). Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. 1—22. doi:10.1002/14356007.o04_o01.pub2. ISBN 978-3-527-30673-2. Архів оригіналу за 16 січня 2022. Процитовано 16 квітня 2022.