Мітохондріальний біогенез: відмінності між версіями
| [неперевірена версія] | [неперевірена версія] |
Створено шляхом перекладу сторінки «Mitochondrial biogenesis» |
Немає опису редагування |
||
| Рядок 1: | Рядок 1: | ||
[[Файл:0315 Mitochondrion new.jpg|альт=Мітохондія|міні|Мітохондія]] |
|||
| ⚫ | '''Мітохондріальний біогенез''' — це [[процес]], за допомогою якого [[клітини]] збільшують кількість [[Мітохондрія|мітохондрій]].<ref name="pmid24606795">{{Cite journal|last=Valero|first=Teresa|year=2014|title=Editorial (Thematic Issue: Mitochondrial Biogenesis: Pharmacological Approaches)|journal=Current Pharmaceutical Design|volume=20|issue=35|pages=5507–5509|doi=10.2174/138161282035140911142118|pmid=24606795|hdl-access=|name-list-style=}}</ref><ref name="pmid24606801">{{Cite journal|last=Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV|vauthors=|year=2014|title=Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches|journal=Current Pharmaceutical Design|volume=20|issue=35|pages=5619–33|doi=10.2174/1381612820666140306095106|pmid=24606801}}</ref> |
||
| ⚫ | Вперше це був описаний Джоном Холлозі в 1960-х роках, коли було виявлено, що тренування на фізичну витривалість спричиняють підвищення вмісту мітохондрій, що призводить до більшого поглинання [[Глюкоза|глюкози]] [[М'язи|м’язами]].<ref>{{Cite journal|last=Holloszy JO|vauthors=|date=April 2011|title=RRegulation of Mitochondrial Biogenesis and GLUT4 Expression by Exercise|journal=Comprehensive Physiology|volume=1|issue=2|pages=921–40|doi=10.1002/cphy.c100052|isbn=9780470650714|pmid=23737207}}</ref> Мітохондріальний біогенез активується численними різними сигналами під час клітинного стресу або у відповідь на подразники навколишнього середовища, такі як [[Аеробне тренування|аеробні вправи]].<ref name="pmid24606795" /><ref name="pmid24606801" /><ref name="pmid25062000">{{Cite journal|last=Boushel R, Lundby C, Qvortrup K, Sahlin K|vauthors=|date=October 2014|title=Mitochondrial plasticity with exercise training and extreme environments|journal=Exercise and Sport Sciences Reviews|volume=42|issue=4|pages=169–74|doi=10.1249/JES.0000000000000025|pmid=25062000}}</ref> |
||
| ⚫ | '''Мітохондріальний біогенез''' — це [[процес]], за допомогою якого [[клітини]] збільшують кількість [[Мітохондрія|мітохондрій]].<ref name="pmid24606795">{{Cite journal|last=Valero|first=Teresa|year=2014|title=Editorial (Thematic Issue: Mitochondrial Biogenesis: Pharmacological Approaches)|journal=Current Pharmaceutical Design|volume=20|issue=35|pages=5507–5509|doi=10.2174/138161282035140911142118|pmid=24606795|hdl-access= |
||
| ⚫ | Вперше це був описаний Джоном Холлозі в 1960-х роках, коли було виявлено, що тренування на фізичну витривалість спричиняють підвищення вмісту мітохондрій, що призводить до більшого поглинання [[Глюкоза|глюкози]] [[М'язи|м’язами]].<ref>{{Cite journal| |
||
== Передумови == |
== Передумови == |
||
Здатність мітохондрій до самовідтворення корениться в її еволюційній історії. Зазвичай вважають, що мітохондрії походять від клітин, які утворили [[Ендосимбіонти|ендосимбіотичні]] відносини з [[Альфа-протеобактерії|α-протобактеріями]]; вони мають власний геном для реплікації.<ref name=":3">{{Cite journal| |
Здатність мітохондрій до самовідтворення корениться в її еволюційній історії. Зазвичай вважають, що мітохондрії походять від клітин, які утворили [[Ендосимбіонти|ендосимбіотичні]] відносини з [[Альфа-протеобактерії|α-протобактеріями]]; вони мають власний геном для реплікації.<ref name=":3">{{Cite journal|last=Jornayvaz FR, Shulman GI|vauthors=|year=2010|title=Regulation of mitochondrial biogenesis|journal=Essays in Biochemistry|volume=47|pages=69–84|doi=10.1042/bse0470069|pmc=3883043|pmid=20533901}}</ref> Однак останні дані свідчать про те, що мітохондрії могли еволюціонувати й без симбіозу.<ref>{{Cite journal|last=Harish A, Kurland CG|author-link2=|vauthors=|date=December 2017|title=Mitochondria are not captive bacteria|journal=Journal of Theoretical Biology|volume=434|pages=88–98|doi=10.1016/j.jtbi.2017.07.011|pmid=28754286}}</ref> Мітохондрія є ключовим регулятором метаболічної активності клітини, а також є важливою органелою як у виробництві, так і в розпаді [[Вільні радикали|вільних радикалів]].<ref>{{Cite journal|last=Bevilacqua L, Ramsey JJ, Hagopian K, Weindruch R, Harper ME|vauthors=|date=May 2004|title=Effects of short- and medium-term calorie restriction on muscle mitochondrial proton leak and reactive oxygen species production|journal=American Journal of Physiology. Endocrinology and Metabolism|volume=286|issue=5|pages=E852-61|doi=10.1152/ajpendo.00367.2003|pmid=14736705}}</ref> Вважається, що більша кількість мітохондріальних копій (або більша маса мітохондрій) є захисним та адаптаційним механізмом клітини. |
||
Мітохондрії утворюються в результаті [[Транскрипція (біологія)|транскрипції]] та [[Трансляція (біологія)|трансляції]] [[Ген|генів]] як у [[Клітинне ядро|ядерному]] [[Геном|геномі]], так і в [[Мітохондріальна ДНК|мітохондріальному геномі]]. Більшість мітохондріального білка походить із ядерного геному, тоді як мітохондріальний геном кодує частини [[Електронтранспортний ланцюг|ланцюга транспортування електронів]] разом із мітохондріальною [[Рибосомна РНК|рРНК]] і [[Транспортна РНК|тРНК]]. Мітохондріальний біогенез збільшує кількість метаболічних [[Ферменти|ферментів]] для [[Гліколіз|гліколізу]], [[Окисне фосфорилювання|окисного фосфорилювання]] та, зрештою, для більшої метаболічної здатність мітохондрій. Залежно від доступних енергетичних субстратів і окисно-відновного стану клітини, клітина може збільшувати або зменшувати кількість і розмір мітохондрій.<ref name="pmid26858267">{{Cite journal| |
Мітохондрії утворюються в результаті [[Транскрипція (біологія)|транскрипції]] та [[Трансляція (біологія)|трансляції]] [[Ген|генів]] як у [[Клітинне ядро|ядерному]] [[Геном|геномі]], так і в [[Мітохондріальна ДНК|мітохондріальному геномі]]. Більшість мітохондріального білка походить із ядерного геному, тоді як мітохондріальний геном кодує частини [[Електронтранспортний ланцюг|ланцюга транспортування електронів]] разом із мітохондріальною [[Рибосомна РНК|рРНК]] і [[Транспортна РНК|тРНК]]. Мітохондріальний біогенез збільшує кількість метаболічних [[Ферменти|ферментів]] для [[Гліколіз|гліколізу]], [[Окисне фосфорилювання|окисного фосфорилювання]] та, зрештою, для більшої метаболічної здатність мітохондрій. Залежно від доступних енергетичних субстратів і окисно-відновного стану клітини, клітина може збільшувати або зменшувати кількість і розмір мітохондрій.<ref name="pmid26858267">{{Cite journal|last=Mishra P, Chan DC|vauthors=|date=February 2016|title=Metabolic regulation of mitochondrial dynamics|journal=The Journal of Cell Biology|volume=212|issue=4|pages=379–87|doi=10.1083/jcb.201511036|pmc=4754720|pmid=26858267}}</ref> Важливо те, що кількість і морфологія мітохондрій змінюються залежно від типу клітини та специфічного контексту попиту, завдяки чому баланс між злиттям/поділом мітохондрій регулює розподіл, морфологію та функцію мітохондрій.<ref name="pmid26494254">{{Cite journal|last=Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, Arnauné-Pelloquin L, Davezac N, Mils V, Miquel MC, Rojo M, Belenguer P|displayauthors=6|vauthors=|date=June 2016|title=Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity|journal=Neurobiology of Disease|volume=90|pages=3–19|doi=10.1016/j.nbd.2015.10.011|pmid=26494254}}</ref><ref name="pmid26858267" /> |
||
== Імпорт білку == |
== Імпорт білку == |
||
[[Файл:Mitochondrial_protein_import.svg|міні| Мітохондріальні білки, закодовані в ядерному геномі, повинні бути націлені та належним чином транспортовані в мітохондрії.]] |
[[Файл:Mitochondrial_protein_import.svg|міні| Мітохондріальні білки, закодовані в ядерному геномі, повинні бути націлені та належним чином транспортовані в мітохондрії.]] |
||
Оскільки більшість мітохондріальних білків походить з ядерного геному, білки повинні бути належним чином спрямовані та транспортовані в мітохондрії для виконання своїх функцій.<ref name="pmid26858267">{{Cite journal|vauthors=Mishra P, Chan DC|date=February 2016|title=Metabolic regulation of mitochondrial dynamics|journal=The Journal of Cell Biology|volume=212|issue=4|pages=379–87|doi=10.1083/jcb.201511036|pmc=4754720|pmid=26858267}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMishraChan2016">Mishra P, Chan DC (February 2016). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 "Metabolic regulation of mitochondrial dynamics"]. ''The Journal of Cell Biology''. '''212''' (4): 379–87. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1083/jcb.201511036|10.1083/jcb.201511036]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 4754720]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26858267 26858267].</cite></ref><ref name=":5">{{Cite journal| |
Оскільки більшість мітохондріальних білків походить з ядерного геному, білки повинні бути належним чином спрямовані та транспортовані в мітохондрії для виконання своїх функцій.<ref name="pmid26858267">{{Cite journal|vauthors=Mishra P, Chan DC|date=February 2016|title=Metabolic regulation of mitochondrial dynamics|journal=The Journal of Cell Biology|volume=212|issue=4|pages=379–87|doi=10.1083/jcb.201511036|pmc=4754720|pmid=26858267}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMishraChan2016">Mishra P, Chan DC (February 2016). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 "Metabolic regulation of mitochondrial dynamics"]. ''The Journal of Cell Biology''. '''212''' (4): 379–87. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1083/jcb.201511036|10.1083/jcb.201511036]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 4754720]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26858267 26858267].</cite></ref><ref name=":5">{{Cite journal|last=Dudek J, Rehling P, van der Laan M|vauthors=|date=February 2013|title=Mitochondrial protein import: common principles and physiological networks|journal=Biochimica et Biophysica Acta (BBA) - Molecular Cell Research|volume=1833|issue=2|pages=274–85|doi=10.1016/j.bbamcr.2012.05.028|pmid=22683763|doi-access=free}}</ref><ref name=":1" /> Спочатку мРНК транслюється в [[Цитозоль|цитозолі]] клітини.<ref name=":5" /><ref name=":1" /> У результаті отримані розгорнуті білки-попередники зможуть досягти відповідних мітохондріальних [[Компартменти клітини|компартментів]].<ref name=":1" /><ref name=":5" /> Білки-попередники транспортуються в одну з чотирьох областей мітохондрій, які включають зовнішню мембрану, внутрішню мембрану, міжмембранний простір і матрикс.<ref name=":5" /><ref name=":1" /> Усі білки надходять у мітохондрії через [[Транслоказа|транслоказу]] на зовнішній мітохондріальній мембрані (TOM).<ref name=":1" /><ref name=":5" /><ref name=":3">{{Cite journal|vauthors=Jornayvaz FR, Shulman GI|year=2010|title=Regulation of mitochondrial biogenesis|journal=Essays in Biochemistry|volume=47|pages=69–84|doi=10.1042/bse0470069|pmc=3883043|pmid=20533901}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJornayvazShulman2010">Jornayvaz FR, Shulman GI (2010). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 "Regulation of mitochondrial biogenesis"]. ''Essays in Biochemistry''. '''47''': 69–84. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1042/bse0470069|10.1042/bse0470069]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 3883043]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20533901 20533901].</cite></ref> Деякі білки мають N-кінцевий сигнал націлювання, і ці білки виявляються і транспортуються в матрицю, де потім розщеплюються та згортаються.<ref name=":0">{{Cite journal|last=Ventura-Clapier R, Garnier A, Veksler V|vauthors=|date=July 2008|title=Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha|journal=Cardiovascular Research|volume=79|issue=2|pages=208–17|doi=10.1093/cvr/cvn098|pmid=18430751|doi-access=free}}</ref><ref name=":1">{{Cite journal|last=Baker MJ, Frazier AE, Gulbis JM, Ryan MT|vauthors=|date=September 2007|title=Mitochondrial protein-import machinery: correlating structure with function|journal=Trends in Cell Biology|volume=17|issue=9|pages=456–64|doi=10.1016/j.tcb.2007.07.010|pmid=17825565}}</ref><ref name=":5" /> Інші білки можуть мати інформацію про націлювання у своїх послідовностях і не включатимуть N-кінцевий сигнал.<ref name=":1" /><ref name=":5" /> |
||
Протягом останніх двох десятиліть дослідники виявили понад тридцять білків, які беруть участь в імпорті мітохондріальних білків.<ref name=":1" /> Коли дослідники дізнаються більше про ці білки та про те, як вони досягають відповідних мітохондріальних відділів, які їх використовують, стає очевидним, що існує безліч процесів, які працюють разом у клітині, щоб забезпечити мітохондріальний біогенез.<ref name=":1" /><ref name="pmid26858267" /> |
Протягом останніх двох десятиліть дослідники виявили понад тридцять білків, які беруть участь в імпорті мітохондріальних білків.<ref name=":1" /> Коли дослідники дізнаються більше про ці білки та про те, як вони досягають відповідних мітохондріальних відділів, які їх використовують, стає очевидним, що існує безліч процесів, які працюють разом у клітині, щоб забезпечити мітохондріальний біогенез.<ref name=":1" /><ref name="pmid26858267" /> |
||
== Злиття і поділ == |
== Злиття і поділ == |
||
Мітохондрії дуже різноманітні і здатні змінювати свою форму в результаті подій поділу та злиття.<ref name="pmid26494254">{{Cite journal|displayauthors=6|vauthors=Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, Arnauné-Pelloquin L, Davezac N, Mils V, Miquel MC, Rojo M, Belenguer P|date=June 2016|title=Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity|journal=Neurobiology of Disease|volume=90|pages=3–19|doi=10.1016/j.nbd.2015.10.011|pmid=26494254}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFBertholetDelerueMilletMoulis2016">Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, et al. (June 2016). "Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity". ''Neurobiology of Disease''. '''90''': 3–19. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.nbd.2015.10.011|10.1016/j.nbd.2015.10.011]]. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26494254 26494254]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:12627451 12627451].</cite></ref><ref name="pmid26858267">{{Cite journal|vauthors=Mishra P, Chan DC|date=February 2016|title=Metabolic regulation of mitochondrial dynamics|journal=The Journal of Cell Biology|volume=212|issue=4|pages=379–87|doi=10.1083/jcb.201511036|pmc=4754720|pmid=26858267}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMishraChan2016">Mishra P, Chan DC (February 2016). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 "Metabolic regulation of mitochondrial dynamics"]. ''The Journal of Cell Biology''. '''212''' (4): 379–87. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1083/jcb.201511036|10.1083/jcb.201511036]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 4754720]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26858267 26858267].</cite></ref> Поділ — це подія, коли одна сутність розпадається на частини, тоді як злиття — це подія, коли дві або більше сутності з’єднуються, щоб утворити ціле.<ref name="pmid26858267" /> Процеси поділу та злиття протистоять один одному і дозволяють мітохондріальній мережі постійно перебудовуватися.<ref name="pmid26494254" /><ref name="pmid26858267" /> Якщо подразник викликає зміну балансу поділу та злиття в клітині, це може суттєво змінити мітохондріальну мережу.<ref name="pmid26494254" /><ref name=":6" /> Наприклад, посилення поділу мітохондрій призвело б до створення багатьох фрагментованих мітохондрій, що, як було показано, корисно для усунення пошкоджених мітохондрій і для створення менших мітохондрій для ефективного транспортування до енергоспоживаючих областей.<ref name=":6">{{Cite journal| |
Мітохондрії дуже різноманітні і здатні змінювати свою форму в результаті подій поділу та злиття.<ref name="pmid26494254">{{Cite journal|displayauthors=6|vauthors=Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, Arnauné-Pelloquin L, Davezac N, Mils V, Miquel MC, Rojo M, Belenguer P|date=June 2016|title=Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity|journal=Neurobiology of Disease|volume=90|pages=3–19|doi=10.1016/j.nbd.2015.10.011|pmid=26494254}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFBertholetDelerueMilletMoulis2016">Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, et al. (June 2016). "Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity". ''Neurobiology of Disease''. '''90''': 3–19. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.nbd.2015.10.011|10.1016/j.nbd.2015.10.011]]. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26494254 26494254]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:12627451 12627451].</cite></ref><ref name="pmid26858267">{{Cite journal|vauthors=Mishra P, Chan DC|date=February 2016|title=Metabolic regulation of mitochondrial dynamics|journal=The Journal of Cell Biology|volume=212|issue=4|pages=379–87|doi=10.1083/jcb.201511036|pmc=4754720|pmid=26858267}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMishraChan2016">Mishra P, Chan DC (February 2016). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 "Metabolic regulation of mitochondrial dynamics"]. ''The Journal of Cell Biology''. '''212''' (4): 379–87. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1083/jcb.201511036|10.1083/jcb.201511036]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 4754720]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26858267 26858267].</cite></ref> Поділ — це подія, коли одна сутність розпадається на частини, тоді як злиття — це подія, коли дві або більше сутності з’єднуються, щоб утворити ціле.<ref name="pmid26858267" /> Процеси поділу та злиття протистоять один одному і дозволяють мітохондріальній мережі постійно перебудовуватися.<ref name="pmid26494254" /><ref name="pmid26858267" /> Якщо подразник викликає зміну балансу поділу та злиття в клітині, це може суттєво змінити мітохондріальну мережу.<ref name="pmid26494254" /><ref name=":6" /> Наприклад, посилення поділу мітохондрій призвело б до створення багатьох фрагментованих мітохондрій, що, як було показано, корисно для усунення пошкоджених мітохондрій і для створення менших мітохондрій для ефективного транспортування до енергоспоживаючих областей.<ref name=":6">{{Cite journal|last=Youle RJ, van der Bliek AM|vauthors=|date=August 2012|title=Mitochondrial fission, fusion, and stress|journal=Science|volume=337|issue=6098|pages=1062–5|doi=10.1126/science.1219855|pmc=4762028|pmid=22936770}}</ref><ref name=":2">{{Cite journal|last=Bo H, Zhang Y, Ji LL|vauthors=|date=July 2010|title=Redefining the role of mitochondria in exercise: a dynamic remodeling|journal=Annals of the New York Academy of Sciences|volume=1201|pages=121–8|doi=10.1111/j.1749-6632.2010.05618.x|pmid=20649548}}</ref> Таким чином, досягнення балансу між цими механізмами дозволяє клітині мати належну організацію своєї мітохондріальної мережі під час біогенезу та може відігравати важливу роль у адаптації м’язів та нейронів до фізіологічного стресу.<ref name=":6" /> |
||
[[Файл:Mitochondrial_Fission_and_Fusion_.png|ліворуч|міні|321x321пкс| Процеси злиття і поділу дозволяють реорганізувати мітохондрії.]] |
[[Файл:Mitochondrial_Fission_and_Fusion_.png|ліворуч|міні|321x321пкс| Процеси злиття і поділу дозволяють реорганізувати мітохондрії.]] |
||
У ссавців як злиття, так і поділ мітохондрій контролюються ГТФазами родини динамінів.<ref name="pmid26858267">{{Cite journal|vauthors=Mishra P, Chan DC|date=February 2016|title=Metabolic regulation of mitochondrial dynamics|journal=The Journal of Cell Biology|volume=212|issue=4|pages=379–87|doi=10.1083/jcb.201511036|pmc=4754720|pmid=26858267}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMishraChan2016">Mishra P, Chan DC (February 2016). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 "Metabolic regulation of mitochondrial dynamics"]. ''The Journal of Cell Biology''. '''212''' (4): 379–87. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1083/jcb.201511036|10.1083/jcb.201511036]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 4754720]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26858267 26858267].</cite></ref><ref name=":6">{{Cite journal|vauthors=Youle RJ, van der Bliek AM|date=August 2012|title=Mitochondrial fission, fusion, and stress|journal=Science|volume=337|issue=6098|pages=1062–5|doi=10.1126/science.1219855|pmc=4762028|pmid=22936770}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFYoulevan_der_Bliek2012">Youle RJ, van der Bliek AM (August 2012). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4762028 "Mitochondrial fission, fusion, and stress"]. ''Science''. '''337''' (6098): 1062–5. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1126/science.1219855|10.1126/science.1219855]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4762028 4762028]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/22936770 22936770].</cite></ref> Процесом поділу мітохондрій керує [[DNM1L|Drp1]], член сімейства цитозольних динамінів.<ref name="pmid26858267" /><ref name="pmid26494254">{{Cite journal|displayauthors=6|vauthors=Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, Arnauné-Pelloquin L, Davezac N, Mils V, Miquel MC, Rojo M, Belenguer P|date=June 2016|title=Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity|journal=Neurobiology of Disease|volume=90|pages=3–19|doi=10.1016/j.nbd.2015.10.011|pmid=26494254}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFBertholetDelerueMilletMoulis2016">Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, et al. (June 2016). "Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity". ''Neurobiology of Disease''. '''90''': 3–19. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.nbd.2015.10.011|10.1016/j.nbd.2015.10.011]]. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26494254 26494254]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:12627451 12627451].</cite></ref> Цей білок утворює спіраль навколо мітохондрій і звужується, щоб розбити зовнішню та внутрішню мембрани органели.<ref name=":2">{{Cite journal|vauthors=Bo H, Zhang Y, Ji LL|date=July 2010|title=Redefining the role of mitochondria in exercise: a dynamic remodeling|journal=Annals of the New York Academy of Sciences|volume=1201|pages=121–8|doi=10.1111/j.1749-6632.2010.05618.x|pmid=20649548}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFBoZhangJi2010">Bo H, Zhang Y, Ji LL (July 2010). "Redefining the role of mitochondria in exercise: a dynamic remodeling". ''Annals of the New York Academy of Sciences''. '''1201''': 121–8. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1111/j.1749-6632.2010.05618.x|10.1111/j.1749-6632.2010.05618.x]]. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20649548 20649548]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:33936266 33936266].</cite></ref> З іншого боку, процес злиття керується різними білками-динамінами, закріпленими на мембрані, на різних рівнях мітохондрій.<ref name=":6" /> Злиття на рівні зовнішньої мітохондріальної мембрани опосередковується [[MFN1|Mfn1]] і [[MFN2|Mfn2]] (мітофузини 1 і 2)<ref name=":7" />, а злиття на рівні внутрішньої мітохондріальної мембрани опосередковується [[OPA1|Opa1]].<ref name="pmid26858267" /><ref name=":0">{{Cite journal|vauthors=Ventura-Clapier R, Garnier A, Veksler V|date=July 2008|title=Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha|journal=Cardiovascular Research|volume=79|issue=2|pages=208–17|doi=10.1093/cvr/cvn098|pmid=18430751|doi-access=free}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFVentura-ClapierGarnierVeksler2008">Ventura-Clapier R, Garnier A, Veksler V (July 2008). [[doi:10.1093/cvr/cvn098|"Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha"]]. ''Cardiovascular Research''. '''79''' (2): 208–17. [[Цифровий ідентифікатор об'єкта|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1093/cvr/cvn098|10.1093/cvr/cvn098]]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/18430751 18430751].</cite></ref><ref name=":6" /> Численні дослідження спостерігали корельоване збільшення дихальної здатності мітохондрій з експресією генів Mfn1, Mnf2 і Drp1 після вправ на витривалість.<ref name=":2" /><ref name=":7">{{Cite journal| |
У ссавців як злиття, так і поділ мітохондрій контролюються ГТФазами родини динамінів.<ref name="pmid26858267">{{Cite journal|vauthors=Mishra P, Chan DC|date=February 2016|title=Metabolic regulation of mitochondrial dynamics|journal=The Journal of Cell Biology|volume=212|issue=4|pages=379–87|doi=10.1083/jcb.201511036|pmc=4754720|pmid=26858267}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMishraChan2016">Mishra P, Chan DC (February 2016). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 "Metabolic regulation of mitochondrial dynamics"]. ''The Journal of Cell Biology''. '''212''' (4): 379–87. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1083/jcb.201511036|10.1083/jcb.201511036]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4754720 4754720]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26858267 26858267].</cite></ref><ref name=":6">{{Cite journal|vauthors=Youle RJ, van der Bliek AM|date=August 2012|title=Mitochondrial fission, fusion, and stress|journal=Science|volume=337|issue=6098|pages=1062–5|doi=10.1126/science.1219855|pmc=4762028|pmid=22936770}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFYoulevan_der_Bliek2012">Youle RJ, van der Bliek AM (August 2012). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4762028 "Mitochondrial fission, fusion, and stress"]. ''Science''. '''337''' (6098): 1062–5. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1126/science.1219855|10.1126/science.1219855]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4762028 4762028]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/22936770 22936770].</cite></ref> Процесом поділу мітохондрій керує [[DNM1L|Drp1]], член сімейства цитозольних динамінів.<ref name="pmid26858267" /><ref name="pmid26494254">{{Cite journal|displayauthors=6|vauthors=Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, Arnauné-Pelloquin L, Davezac N, Mils V, Miquel MC, Rojo M, Belenguer P|date=June 2016|title=Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity|journal=Neurobiology of Disease|volume=90|pages=3–19|doi=10.1016/j.nbd.2015.10.011|pmid=26494254}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFBertholetDelerueMilletMoulis2016">Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, et al. (June 2016). "Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity". ''Neurobiology of Disease''. '''90''': 3–19. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.nbd.2015.10.011|10.1016/j.nbd.2015.10.011]]. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/26494254 26494254]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:12627451 12627451].</cite></ref> Цей білок утворює спіраль навколо мітохондрій і звужується, щоб розбити зовнішню та внутрішню мембрани органели.<ref name=":2">{{Cite journal|vauthors=Bo H, Zhang Y, Ji LL|date=July 2010|title=Redefining the role of mitochondria in exercise: a dynamic remodeling|journal=Annals of the New York Academy of Sciences|volume=1201|pages=121–8|doi=10.1111/j.1749-6632.2010.05618.x|pmid=20649548}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFBoZhangJi2010">Bo H, Zhang Y, Ji LL (July 2010). "Redefining the role of mitochondria in exercise: a dynamic remodeling". ''Annals of the New York Academy of Sciences''. '''1201''': 121–8. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1111/j.1749-6632.2010.05618.x|10.1111/j.1749-6632.2010.05618.x]]. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20649548 20649548]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:33936266 33936266].</cite></ref> З іншого боку, процес злиття керується різними білками-динамінами, закріпленими на мембрані, на різних рівнях мітохондрій.<ref name=":6" /> Злиття на рівні зовнішньої мітохондріальної мембрани опосередковується [[MFN1|Mfn1]] і [[MFN2|Mfn2]] (мітофузини 1 і 2)<ref name=":7" />, а злиття на рівні внутрішньої мітохондріальної мембрани опосередковується [[OPA1|Opa1]].<ref name="pmid26858267" /><ref name=":0">{{Cite journal|vauthors=Ventura-Clapier R, Garnier A, Veksler V|date=July 2008|title=Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha|journal=Cardiovascular Research|volume=79|issue=2|pages=208–17|doi=10.1093/cvr/cvn098|pmid=18430751|doi-access=free}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFVentura-ClapierGarnierVeksler2008">Ventura-Clapier R, Garnier A, Veksler V (July 2008). [[doi:10.1093/cvr/cvn098|"Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha"]]. ''Cardiovascular Research''. '''79''' (2): 208–17. [[Цифровий ідентифікатор об'єкта|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1093/cvr/cvn098|10.1093/cvr/cvn098]]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/18430751 18430751].</cite></ref><ref name=":6" /> Численні дослідження спостерігали корельоване збільшення дихальної здатності мітохондрій з експресією генів Mfn1, Mnf2 і Drp1 після вправ на витривалість.<ref name=":2" /><ref name=":7">{{Cite journal|last=Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S, Ziltener JL, Luthi F, Dériaz O, Zorzano A, Gobelet C, Kralli A, Russell AP|displayauthors=6|vauthors=|date=August 2005|title=Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise|journal=The Journal of Physiology|volume=567|issue=Pt 1|pages=349–58|doi=10.1113/jphysiol.2005.092031|pmc=1474174|pmid=15961417}}</ref> Таким чином, підтверджується те, що реорганізація мітохондріальної мережі в м’язових клітинах відіграє важливу роль у відповідь на фізичні вправи.<ref name="pmid25062000" /><ref name=":6" /><ref name=":7" /> |
||
== Регуляція == |
== Регуляція == |
||
PGC-1α, член сімейства транскрипційних коактиваторів гамма-рецепторів, активованих проліфератором пероксисом (PGC), є головним регулятором мітохондріального біогенезу.<ref name="pmid24606795" |
PGC-1α, член сімейства транскрипційних коактиваторів гамма-рецепторів, активованих проліфератором пероксисом (PGC), є головним регулятором мітохондріального біогенезу.<ref name="pmid24606795" /><ref name="pmid24606801" /><ref name="pmid23602910">{{Cite journal|last=Johri A, Chandra A, Flint Beal M|vauthors=|date=September 2013|title=PGC-1α, mitochondrial dysfunction, and Huntington's disease|journal=Free Radical Biology & Medicine|volume=62|pages=37–46|doi=10.1016/j.freeradbiomed.2013.04.016|pmc=3722269|pmid=23602910}}</ref> Відомо, що він коактивує ядерний респіраторний фактор 2 [[GABPA|(NRF2/GABPA)]] і разом з NRF-2 коактивує ядерний респіраторний фактор 1 ([[NRF1]]).<ref name=":7">{{Cite journal|displayauthors=6|vauthors=Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S, Ziltener JL, Luthi F, Dériaz O, Zorzano A, Gobelet C, Kralli A, Russell AP|date=August 2005|title=Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise|journal=The Journal of Physiology|volume=567|issue=Pt 1|pages=349–58|doi=10.1113/jphysiol.2005.092031|pmc=1474174|pmid=15961417}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFCartoniLégerHockPraz2005">Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S, et al. (August 2005). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1474174 "Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise"]. ''The Journal of Physiology''. '''567''' (Pt 1): 349–58. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1113/jphysiol.2005.092031|10.1113/jphysiol.2005.092031]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1474174 1474174]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/15961417 15961417].</cite></ref><ref name="pmid23602910" /> NRFs, у свою чергу, активують мітохондріальний транскрипційний фактор A ([[TFAM|tfam]]), який безпосередньо відповідає за транскрипцію мітохондріальних білків, кодованих у ядрі.<ref name=":7" /><ref name="pmid23602910" /> Це включає як структурні мітохондріальні білки, так і ті, що беруть участь у транскрипції, трансляції та репарації мтДНК.<ref name="pmid23602910" /> PGC-1β, білок, структурно подібний до PGC-1α, також бере участь у регуляції мітохондріального біогенезу, але відрізняється тим, що він не збільшується у відповідь на фізичні вправи.<ref name=":3">{{Cite journal|vauthors=Jornayvaz FR, Shulman GI|year=2010|title=Regulation of mitochondrial biogenesis|journal=Essays in Biochemistry|volume=47|pages=69–84|doi=10.1042/bse0470069|pmc=3883043|pmid=20533901}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJornayvazShulman2010">Jornayvaz FR, Shulman GI (2010). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 "Regulation of mitochondrial biogenesis"]. ''Essays in Biochemistry''. '''47''': 69–84. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1042/bse0470069|10.1042/bse0470069]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 3883043]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20533901 20533901].</cite></ref><ref name=":8" /><ref name="pmid23602910" /> Хоча спостерігалося значне збільшення кількості мітохондрій у тканинах, де PGC-1α надмірно експресується, оскільки кофактор взаємодіє з цими ключовими факторами транскрипції, нокаутовані миші з порушеним PGC-1α все ще життєздатні та демонструють нормальну кількість мітохондрій.<ref name=":8">{{Cite journal|last=Lin J, Wu PH, Tarr PT, Lindenberg KS, St-Pierre J, Zhang CY, Mootha VK, Jäger S, Vianna CR, Reznick RM, Cui L, Manieri M, Donovan MX, Wu Z, Cooper MP, Fan MC, Rohas LM, Zavacki AM, Cinti S, Shulman GI, Lowell BB, Krainc D, Spiegelman BM|displayauthors=6|vauthors=|date=October 2004|title=Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice|journal=Cell|volume=119|issue=1|pages=121–35|doi=10.1016/j.cell.2004.09.013|pmid=15454086|doi-access=free}}</ref><ref name=":3" /><ref name="pmid23602910" /> Таким чином, PGC-1α не потрібен для нормального розвитку мітохондрій у мишей, але під час фізіологічного стресу ці миші виявляють знижену толерантність порівняно з мишами з нормальним рівнем PGC-1α.<ref name=":3" /><ref name="pmid23602910" /><ref name=":8" /> Подібним чином, у нокаутованих мишей із порушеною PGC-1β, миші демонстрували переважно нормальний рівень мітохондріальної функції зі зниженою здатністю адаптуватися до фізіологічного стресу.<ref name=":4">{{Cite journal|last=Scarpulla RC|vauthors=|date=July 2011|title=Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network|journal=Biochimica et Biophysica Acta (BBA) - Molecular Cell Research|volume=1813|issue=7|pages=1269–78|doi=10.1016/j.bbamcr.2010.09.019|pmc=3035754|pmid=20933024}}</ref><ref name=":3" /> Однак експеримент з подвійним нокаутом PGC-1α/β створив мишей, які загинули переважно протягом 24 годин через дефекти мітохондріального дозрівання серцевої тканини.<ref name=":9">{{Cite journal|last=Lai L, Leone TC, Zechner C, Schaeffer PJ, Kelly SM, Flanagan DP, Medeiros DM, Kovacs A, Kelly DP|displayauthors=6|vauthors=|date=July 2008|title=Transcriptional coactivators PGC-1alpha and PGC-lbeta control overlapping programs required for perinatal maturation of the heart|journal=Genes & Development|volume=22|issue=14|pages=1948–61|doi=10.1101/gad.1661708|pmc=2492740|pmid=18628400}}</ref> Ці знахідки свідчать про те, що, хоча поодинці PGC-1α і PGC-1β не є безумовно необхідними для здатності клітини здійснювати мітохондріальний біогенез, разом вони здатні доповнювати один одного для оптимального дозрівання мітохондрій і функціонування в періоди фізіологічного стресу.<ref name=":9" /><ref name=":3" /><ref name=":8" /> |
||
AMP-активована кіназа (AMPK) також регулює мітохондріальний біогенез шляхом фосфорилювання та активації PGC-1α після відчуття дефіциту енергії в м’язах та нейронах.<ref name=":3">{{Cite journal|vauthors=Jornayvaz FR, Shulman GI|year=2010|title=Regulation of mitochondrial biogenesis|journal=Essays in Biochemistry|volume=47|pages=69–84|doi=10.1042/bse0470069|pmc=3883043|pmid=20533901}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJornayvazShulman2010">Jornayvaz FR, Shulman GI (2010). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 "Regulation of mitochondrial biogenesis"]. ''Essays in Biochemistry''. '''47''': 69–84. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1042/bse0470069|10.1042/bse0470069]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 3883043]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20533901 20533901].</cite></ref><ref name="pmid23602910">{{Cite journal|vauthors=Johri A, Chandra A, Flint Beal M|date=September 2013|title=PGC-1α, mitochondrial dysfunction, and Huntington's disease|journal=Free Radical Biology & Medicine|volume=62|pages=37–46|doi=10.1016/j.freeradbiomed.2013.04.016|pmc=3722269|pmid=23602910}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJohriChandraFlint_Beal2013">Johri A, Chandra A, Flint Beal M (September 2013). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3722269 "PGC-1α, mitochondrial dysfunction, and Huntington's disease"]. ''Free Radical Biology & Medicine''. '''62''': 37–46. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.freeradbiomed.2013.04.016|10.1016/j.freeradbiomed.2013.04.016]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3722269 3722269]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/23602910 23602910].</cite></ref> Було показано, що у мишей зі зниженим співвідношенням АТФ/АМФ під час фізичних вправ виснаження енергії корелює з активацією AMPK. <ref name=":3" /><ref name=":4">{{Cite journal|vauthors=Scarpulla RC|date=July 2011|title=Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network|journal=Biochimica et Biophysica Acta (BBA) - Molecular Cell Research|volume=1813|issue=7|pages=1269–78|doi=10.1016/j.bbamcr.2010.09.019|pmc=3035754|pmid=20933024}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFScarpulla2011">Scarpulla RC (July 2011). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3035754 "Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network"]. ''Biochimica et Biophysica Acta (BBA) - Molecular Cell Research''. '''1813''' (7): 1269–78. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.bbamcr.2010.09.019|10.1016/j.bbamcr.2010.09.019]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3035754 3035754]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20933024 20933024].</cite></ref><ref name="pmid23602910" /> Активація AMPK продовжувала активувати PGC-1α і NRF у цих мишей, що стимулювало мітохондріальний біогенез.<ref name=":3" /><ref name=":4" /><ref name="pmid23602910" /> |
AMP-активована кіназа (AMPK) також регулює мітохондріальний біогенез шляхом фосфорилювання та активації PGC-1α після відчуття дефіциту енергії в м’язах та нейронах.<ref name=":3">{{Cite journal|vauthors=Jornayvaz FR, Shulman GI|year=2010|title=Regulation of mitochondrial biogenesis|journal=Essays in Biochemistry|volume=47|pages=69–84|doi=10.1042/bse0470069|pmc=3883043|pmid=20533901}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJornayvazShulman2010">Jornayvaz FR, Shulman GI (2010). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 "Regulation of mitochondrial biogenesis"]. ''Essays in Biochemistry''. '''47''': 69–84. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1042/bse0470069|10.1042/bse0470069]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 3883043]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20533901 20533901].</cite></ref><ref name="pmid23602910">{{Cite journal|vauthors=Johri A, Chandra A, Flint Beal M|date=September 2013|title=PGC-1α, mitochondrial dysfunction, and Huntington's disease|journal=Free Radical Biology & Medicine|volume=62|pages=37–46|doi=10.1016/j.freeradbiomed.2013.04.016|pmc=3722269|pmid=23602910}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJohriChandraFlint_Beal2013">Johri A, Chandra A, Flint Beal M (September 2013). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3722269 "PGC-1α, mitochondrial dysfunction, and Huntington's disease"]. ''Free Radical Biology & Medicine''. '''62''': 37–46. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.freeradbiomed.2013.04.016|10.1016/j.freeradbiomed.2013.04.016]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3722269 3722269]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/23602910 23602910].</cite></ref> Було показано, що у мишей зі зниженим співвідношенням АТФ/АМФ під час фізичних вправ виснаження енергії корелює з активацією AMPK. <ref name=":3" /><ref name=":4">{{Cite journal|vauthors=Scarpulla RC|date=July 2011|title=Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network|journal=Biochimica et Biophysica Acta (BBA) - Molecular Cell Research|volume=1813|issue=7|pages=1269–78|doi=10.1016/j.bbamcr.2010.09.019|pmc=3035754|pmid=20933024}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFScarpulla2011">Scarpulla RC (July 2011). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3035754 "Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network"]. ''Biochimica et Biophysica Acta (BBA) - Molecular Cell Research''. '''1813''' (7): 1269–78. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1016/j.bbamcr.2010.09.019|10.1016/j.bbamcr.2010.09.019]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3035754 3035754]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20933024 20933024].</cite></ref><ref name="pmid23602910" /> Активація AMPK продовжувала активувати PGC-1α і NRF у цих мишей, що стимулювало мітохондріальний біогенез.<ref name=":3" /><ref name=":4" /><ref name="pmid23602910" /> |
||
== Нейропластичність і мітохондріальний біогенез == |
|||
== Старіння == |
|||
''Основна стаття —'' [[Нейропластичність]]. |
|||
| ⚫ | Було показано, що здатність до мітохондріального біогенезу може зменшуватись з віком, і таке зниження функції мітохондрій може бути пов’язане з розвитком діабету і серцево-судинних захворювань.<ref>{{Cite journal| |
||
Також, вважається, що регуляція [[Мітохондріальний біогенез|мітохондріального біогенезу]] та функцій [[Мітохондрія|мітохондрій]] відіграє ключову роль у забезпеченні енергією, необхідною для підтримки клітинних процесів, які лежать в основі довгострокової [[Синаптична пластичність|синаптичної пластичності]].<ref>{{Cite news|title=A novel integrated approach to estimate the mitochondrial content of neuronal cells and brain tissues|url=https://www.sciencedirect.com/science/article/pii/S0165027021002867|work=Journal of Neuroscience Methods|date=2021-11-01|accessdate=2023-03-09|issn=0165-0270|doi=10.1016/j.jneumeth.2021.109351|pages=109351|volume=363|language=en|first=Sara|last=Spadini|first2=Gabriella|last2=Racchetti|first3=Alice|last3=Adiletta|first4=Jacopo|last4=Lamanna|first5=Andrea Stefano|last5=Moro|first6=Mattia|last6=Ferro|first7=Vincenzo|last7=Zimarino|first8=Antonio|last8=Malgaroli}}</ref><ref name=":62">{{Cite news|title=Mitochondrial Biogenesis: A Therapeutic Target for Neurodevelopmental Disorders and Neurodegenerative Diseases|url=https://www.eurekaselect.com/article/59496|work=Current Pharmaceutical Design|accessdate=2023-03-09|pmc=PMC4823001|pmid=24606804|doi=10.2174/1381612820666140305224906|pages=5574–5593|volume=20|issue=35|language=en|first=Martine|last=Uittenbogaard|first2=Anne|last2=Chiaramello}}</ref> У нейронах мітохондрії виконують різноманітні функції, такі як виробництво енергії у формі [[Аденозинтрифосфат|АТФ]], буферизація кальцію та генерація [[Активні форми кисню|активних форм кисню]].<ref name=":62" /> Одним з важливих механізмів збільшення кількості мітохондрій в активних синапсах є активація коактиватора транскрипції PGC-1α (гамма-коактиватор 1-альфа рецептора, що активується проліфератором пероксисом), який, як відомо, регулює мітохондріальний біогенез і функціонує у відповідь на підвищену потребу в енергії. PGC-1α активується фактором транскрипції NRF-1 (ядерний респіраторний фактор 1), який зв’язується з промоторними ділянками мітохондріальних генів, що кодуються в ядрах, і посилює їх експресію. Це призводить до збільшення мітохондріального біогенезу, і щойно синтезовані мітохондрії спрямовуються до синапсів, які відчувають підвищену потребу в енергії.<ref>{{Cite news|title=PPARγ/PGC1α signaling as a potential therapeutic target for mitochondrial biogenesis in neurodegenerative disorders|url=https://linkinghub.elsevier.com/retrieve/pii/S0163725820302369|work=Pharmacology & Therapeutics|date=2021-03|accessdate=2023-03-09|pmc=PMC7887032|pmid=33039420|doi=10.1016/j.pharmthera.2020.107705|pages=107705|volume=219|language=en|first=Sumit|last=Jamwal|first2=Jennifer K.|last2=Blackburn|first3=John D.|last3=Elsworth}}</ref> Інший механізм включає активацію протеїнкінази AMPK (AMP-активована протеїнкіназа), яка є ключовим регулятором гомеостазу клітинної енергії. Активація AMPK призводить до фосфорилювання кількох наступних мішеней, включаючи PGC-1α, що посилює мітохондріальний біогенез.<ref>{{Cite news|title=AMPK: guardian of metabolism and mitochondrial homeostasis|url=https://www.nature.com/articles/nrm.2017.95|work=Nature Reviews Molecular Cell Biology|date=2018-02|accessdate=2023-03-09|issn=1471-0072|pmc=PMC5780224|pmid=28974774|doi=10.1038/nrm.2017.95|pages=121–135|volume=19|issue=2|language=en|first=Sébastien|last=Herzig|first2=Reuben J.|last2=Shaw}}</ref> Крім того, AMPK також може регулювати транспортування мітохондрій до синапсу шляхом фосфорилювання мітохондріального моторного білка Miro, який контролює рух мітохондрій уздовж мікротрубочок.<ref>{{Cite news|title=AMPK activity regulates trafficking of mitochondria to the leading edge during cell migration and matrix invasion|url=https://www.molbiolcell.org/doi/10.1091/mbc.e16-05-0286|work=Molecular Biology of the Cell|date=2016-09|accessdate=2023-03-09|issn=1059-1524|pmc=PMC5007087|pmid=27385336|doi=10.1091/mbc.e16-05-0286|pages=2662–2674|volume=27|issue=17|language=en|first=Brian|last=Cunniff|first2=Andrew J.|last2=McKenzie|first3=Nicholas H.|last3=Heintz|first4=Alan K.|last4=Howe|editor-first=Carl-Henrik|editor-last=Heldin}}</ref><ref>{{Cite news|title=AMPK Preferentially Depresses Retrograde Transport of Axonal Mitochondria during Localized Nutrient Deprivation|url=https://www.jneurosci.org/lookup/doi/10.1523/JNEUROSCI.2067-19.2020|work=The Journal of Neuroscience|date=2020-06-17|accessdate=2023-03-09|issn=0270-6474|pmc=PMC7326360|pmid=32393534|doi=10.1523/JNEUROSCI.2067-19.2020|pages=4798–4812|volume=40|issue=25|language=en|first=Orla|last=Watters|first2=Niamh M. C.|last2=Connolly|first3=Hans-Georg|last3=König|first4=Heiko|last4=Düssmann|first5=Jochen H. M.|last5=Prehn}}</ref><ref>{{Cite news|title=Microtubule-Based Mitochondrial Dynamics as a Valuable Therapeutic Target in Cancer|url=https://www.mdpi.com/2072-6694/13/22/5812|work=Cancers|date=2021-01|accessdate=2023-03-09|issn=2072-6694|pmc=PMC8616325|pmid=34830966|doi=10.3390/cancers13225812|pages=5812|volume=13|issue=22|language=en|first=Rosa|last=Vona|first2=Anna Maria|last2=Mileo|first3=Paola|last3=Matarrese}}</ref> Нарешті, дослідження також показали участь процесів поділу та злиття мітохондрій у регуляції розподілу мітохондрій у синапсах.<ref>{{Cite news|title=Mitochondrial dynamics-fusion, fission, movement, and mitophagy-in neurodegenerative diseases|url=https://academic.oup.com/hmg/article-lookup/doi/10.1093/hmg/ddp326|work=Human Molecular Genetics|date=2009-10-15|accessdate=2023-03-09|issn=0964-6906|pmc=PMC2758711|pmid=19808793|doi=10.1093/hmg/ddp326|pages=R169–R176|volume=18|issue=R2|language=en|first=H.|last=Chen|first2=D. C.|last2=Chan}}</ref><ref>{{Cite news|title=Mitochondrial Dynamics: A Key Role in Neurodegeneration and a Potential Target for Neurodegenerative Disease|url=https://www.frontiersin.org/articles/10.3389/fnins.2021.654785|work=Frontiers in Neuroscience|date=2021|accessdate=2023-03-09|issn=1662-453X|pmc=PMC8072049|pmid=33912006|doi=10.3389/fnins.2021.654785|volume=15|first=Danying|last=Yang|first2=Jun|last2=Ying|first3=Xifeng|last3=Wang|first4=Tiancheng|last4=Zhao|first5=Sungtae|last5=Yoon|first6=Yang|last6=Fang|first7=Qingcui|last7=Zheng|first8=Xing|last8=Liu|first9=Wen|last9=Yu}}</ref><ref>{{Cite news|title=Mitochondrial dynamics involves molecular and mechanical events in motility, fusion and fission|url=https://www.frontiersin.org/articles/10.3389/fcell.2022.1010232/full|work=Frontiers in Cell and Developmental Biology|date=2022-10-19|accessdate=2023-03-09|issn=2296-634X|pmc=PMC9626967|pmid=36340034|doi=10.3389/fcell.2022.1010232|pages=1010232|volume=10|first=Adam|last=Green|first2=Tanvir|last2=Hossain|first3=David M.|last3=Eckmann}}</ref> Ці процеси контролюються декількома білками, включаючи DRP1 (пов’язаний з динаміном білок 1) і MFN1/2 (мітофузин 1/2), і вважається, що вони відіграють певну роль у регулюванні кількості мітохондрій у синапсах.<ref>{{Cite news|title=Physiological and Pathological Significance of Dynamin-Related Protein 1 (Drp1)-Dependent Mitochondrial Fission in the Nervous System|url=http://www.en-journal.org/journal/view.html?doi=10.5607/en.2013.22.3.149|work=Experimental Neurobiology|date=2013-09-30|accessdate=2023-03-09|issn=1226-2560|pmc=PMC3807002|pmid=24167410|doi=10.5607/en.2013.22.3.149|pages=149–157|volume=22|issue=3|language=en|first=Bongki|last=Cho|first2=So Yoen|last2=Choi|first3=Hyo Min|last3=Cho|first4=Hyun Jung|last4=Kim|first5=Woong|last5=Sun}}</ref><ref>{{Cite news|title=Drp1‐mediated mitochondrial dynamics and survival of developing chick motoneurons during the period of normal programmed cell death|url=https://onlinelibrary.wiley.com/doi/abs/10.1096/fj.12-211920|work=The FASEB Journal|date=2013-01|accessdate=2023-03-09|issn=0892-6638|pmc=PMC3528306|pmid=22997225|doi=10.1096/fj.12-211920|pages=51–62|volume=27|issue=1|language=en|first=So Yoen|last=Choi|first2=Joo Yeon|last2=Kim|first3=Hyun‐Wook|last3=Kim|first4=Bongki|last4=Cho|first5=Hyo Min|last5=Cho|first6=Ronald W.|last6=Oppenheim|first7=Hyun|last7=Kim|first8=Im Joo|last8=Rhyu|first9=Woong|last9=Sun}}</ref><ref>{{Cite news|title=Causal roles of mitochondrial dynamics in longevity and healthy aging|url=https://onlinelibrary.wiley.com/doi/10.15252/embr.201948395|work=EMBO reports|date=2019-12-05|accessdate=2023-03-09|issn=1469-221X|pmc=PMC6893295|pmid=31667999|doi=10.15252/embr.201948395|volume=20|issue=12|language=en|first=Arpit|last=Sharma|first2=Hannah J|last2=Smith|first3=Pallas|last3=Yao|first4=William B|last4=Mair}}</ref><ref>{{Cite news|title=Oestrogenic Regulation of Mitochondrial Dynamics|url=https://www.mdpi.com/1422-0067/23/3/1118|work=International Journal of Molecular Sciences|date=2022-01-20|accessdate=2023-03-09|issn=1422-0067|pmc=PMC8834780|pmid=35163044|doi=10.3390/ijms23031118|pages=1118|volume=23|issue=3|language=en|first=Siavash|last=Beikoghli Kalkhoran|first2=Georgios|last2=Kararigas}}</ref> |
|||
З’являється все більше доказів того, що регулярні фізичні вправи можуть сприяти мітохондріальному біогенезу в мозку, що може сприяти покращенню когнітивних функцій і настрою. Це призвело до зацікавленості у використанні фізичних вправ як немедикаментозного втручання для нейродегенеративних розладів та інших неврологічних станів.<ref>{{Cite news|title=Exercise training increases mitochondrial biogenesis in the brain|url=https://www.physiology.org/doi/10.1152/japplphysiol.00343.2011|work=Journal of Applied Physiology|date=2011-10|accessdate=2023-03-09|issn=8750-7587|doi=10.1152/japplphysiol.00343.2011|pages=1066–1071|volume=111|issue=4|language=en|first=Jennifer L.|last=Steiner|first2=E. Angela|last2=Murphy|first3=Jamie L.|last3=McClellan|first4=Martin D.|last4=Carmichael|first5=J. Mark|last5=Davis}}</ref><ref>{{Cite news|title=Physical exercise and mitochondrial function: New therapeutic interventions for psychiatric and neurodegenerative disorders|url=https://www.frontiersin.org/articles/10.3389/fneur.2022.929781/full|work=Frontiers in Neurology|date=2022-09-07|accessdate=2023-03-09|issn=1664-2295|pmc=PMC9491238|pmid=36158946|doi=10.3389/fneur.2022.929781|pages=929781|volume=13|first=Lina|last=Sun|first2=Tianbiao|last2=Liu|first3=Jingqi|last3=Liu|first4=Chong|last4=Gao|first5=Xiaohui|last5=Zhang}}</ref> |
|||
== Старіння і мітохондріальний біогенез == |
|||
| ⚫ | Було показано, що здатність до мітохондріального біогенезу може зменшуватись з віком, і таке зниження функції мітохондрій може бути пов’язане з розвитком діабету і серцево-судинних захворювань.<ref>{{Cite journal|last=Handy DE, Loscalzo J|vauthors=|date=June 2012|title=Redox regulation of mitochondrial function|journal=Antioxidants & Redox Signaling|volume=16|issue=11|pages=1323–67|doi=10.1089/ars.2011.4123|pmc=3324814|pmid=22146081}}</ref><ref name=":10">{{Cite journal|last=David R|vauthors=|date=April 2011|title=Ageing: Mitochondria and telomeres come together|journal=Nature Reviews. Molecular Cell Biology|volume=12|issue=4|pages=204|doi=10.1038/nrm3082|pmid=21407239|doi-access=free}}</ref><ref name=":11">{{Cite journal|last=Hagen TM, Wehr CM, Ames BN|vauthors=|date=November 1998|title=Mitochondrial decay in aging. Reversal through supplementation of acetyl-L-carnitine and N-tert-butyl-alpha-phenyl-nitrone|journal=Annals of the New York Academy of Sciences|volume=854|pages=214–23|doi=10.1111/j.1749-6632.1998.tb09904.x|pmid=9928432}}</ref> [[Старіння]] та захворювання можуть викликати зміни в рівнях [[Експресія генів|експресії генів]] білків, які беруть участь у механізмах поділу та злиття мітохондрій, таким чином створюючи дисфункціональні мітохондрії.<ref name=":12" /><ref name=":13">{{Cite journal|last=Sahin E, DePinho RA|vauthors=|date=May 2012|title=Axis of ageing: telomeres, p53 and mitochondria|journal=Nature Reviews. Molecular Cell Biology|volume=13|issue=6|pages=397–404|doi=10.1038/nrm3352|pmc=3718675|pmid=22588366}}</ref> Один з десяти механізмів старіння пов’язаний з вкороченням [[Теломера|теломер]], кінцевих сегментів хромосом, які захищають генетичну інформацію від деградації.<ref name=":10" /><ref name=":13" /> Вкорочення теломер також було пов’язану зі зниженням функції мітохондрій.<ref name=":13" /><ref name=":10" /> Дефіцит [[TERT|зворотної транскриптази теломерази (TERT)]], ферменту, який відіграє важливу роль у відновленні і збереженні теломерів, корелює з активованим p53, білком, який пригнічує PGC-1α.<ref name=":13" /><ref name=":12">{{Cite journal|last=Sahin E, Colla S, Liesa M, Moslehi J, Müller FL, Guo M, Cooper M, Kotton D, Fabian AJ, Walkey C, Maser RS, Tonon G, Foerster F, Xiong R, Wang YA, Shukla SA, Jaskelioff M, Martin ES, Heffernan TP, Protopopov A, Ivanova E, Mahoney JE, Kost-Alimova M, Perry SR, Bronson R, Liao R, Mulligan R, Shirihai OS, Chin L, DePinho RA|displayauthors=6|vauthors=|date=February 2011|title=Telomere dysfunction induces metabolic and mitochondrial compromise|journal=Nature|volume=470|issue=7334|pages=359–65|doi=10.1038/nature09787|pmc=3741661|pmid=21307849}}</ref><ref name=":10" /> Таким чином, вкорочення теломер і дефіцит TERT були пов’язані з порушенням мітохондріального біогенезу.<ref name=":10" /><ref name=":12" /><ref name=":13" /> Було також показано, що експресія AMPK може зменшуватись з віком, що також може сприяти пригніченню мітохондріального біогенезу.<ref name=":3">{{Cite journal|vauthors=Jornayvaz FR, Shulman GI|year=2010|title=Regulation of mitochondrial biogenesis|journal=Essays in Biochemistry|volume=47|pages=69–84|doi=10.1042/bse0470069|pmc=3883043|pmid=20533901}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJornayvazShulman2010">Jornayvaz FR, Shulman GI (2010). [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 "Regulation of mitochondrial biogenesis"]. ''Essays in Biochemistry''. '''47''': 69–84. [[Цифровий ідентифікатор об'єкта|doi]]:[[doi:10.1042/bse0470069|10.1042/bse0470069]]. [[PubMed Central|PMC]] <span class="cs1-lock-free" title="Freely accessible">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883043 3883043]</span>. [[PubMed|PMID]] [https://pubmed.ncbi.nlm.nih.gov/20533901 20533901].</cite></ref><ref name=":13" /> |
||
''Див. також —'' [[Омолодження]], [[Збільшення тривалості життя]]. |
''Див. також —'' [[Омолодження]], [[Збільшення тривалості життя]]. |
||
| Рядок 37: | Рядок 44: | ||
c-Myc, фактор транскрипції, може бути інгібований під час його димеризації білком Max такими молекулами, як IIA6B17<ref>{{Cite journal|last=Lu|first=Xiaohong|last2=Vogt|first2=Peter|last3=Boger|first3=Dale|last4=Lunec|first4=John|date=2008|title=Disruption of the MYC transcriptional function by a small-molecule antagonist of MYC/MAX dimerization|journal=Oncol. Rep.|series=Medical Radiology|volume=19|issue=3|doi=10.1007/978-3-540-77385-6|isbn=978-3-540-77384-9|pmid=18288422}}</ref> і omomyc.<ref>{{Cite journal|last=Demma|first=Mark|last2=Mapelli|first2=Claudio|last3=Sun|first3=Angie|last4=Bodea|first4=Smaranda|last5=Ruprecht|first5=Benjamin|last6=Javaid|first6=Sarah|last7=Wiswell|first7=Derek|last8=Muise|first8=Eric|last9=Chen|first9=Shiyang|date=2019|title=Omomyc Reveals New Mechanisms To Inhibit the MYC Oncogene|journal=Mol Cell Biol|volume=39|issue=22|pages=e00248-19|doi=10.1128/MCB.00248-19|pmc=6817756|pmid=31501275}}</ref> Інгібування комплексу c-Myc-Max може блокувати клітинний цикл і індукувати [[апоптоз]] ракових клітин. |
c-Myc, фактор транскрипції, може бути інгібований під час його димеризації білком Max такими молекулами, як IIA6B17<ref>{{Cite journal|last=Lu|first=Xiaohong|last2=Vogt|first2=Peter|last3=Boger|first3=Dale|last4=Lunec|first4=John|date=2008|title=Disruption of the MYC transcriptional function by a small-molecule antagonist of MYC/MAX dimerization|journal=Oncol. Rep.|series=Medical Radiology|volume=19|issue=3|doi=10.1007/978-3-540-77385-6|isbn=978-3-540-77384-9|pmid=18288422}}</ref> і omomyc.<ref>{{Cite journal|last=Demma|first=Mark|last2=Mapelli|first2=Claudio|last3=Sun|first3=Angie|last4=Bodea|first4=Smaranda|last5=Ruprecht|first5=Benjamin|last6=Javaid|first6=Sarah|last7=Wiswell|first7=Derek|last8=Muise|first8=Eric|last9=Chen|first9=Shiyang|date=2019|title=Omomyc Reveals New Mechanisms To Inhibit the MYC Oncogene|journal=Mol Cell Biol|volume=39|issue=22|pages=e00248-19|doi=10.1128/MCB.00248-19|pmc=6817756|pmid=31501275}}</ref> Інгібування комплексу c-Myc-Max може блокувати клітинний цикл і індукувати [[апоптоз]] ракових клітин. |
||
== |
== Див. також == |
||
* [[Мітохондрія]] |
|||
== Література == |
|||
* Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). "Mitochondrial Biogenesis as a Pharmacological Target: A New Approach to Acute and Chronic Diseases". ''Annual Review of Pharmacology and Toxicology''. '''56''': 229–49. [[doi:10.1146/annurev-pharmtox-010715-103155]] |
|||
* Cameron RB, Beeson CC, Schnellmann RG (December 2016). "Development of Therapeutics That Induce Mitochondrial Biogenesis for the Treatment of Acute and Chronic Degenerative Diseases". ''Journal of Medicinal Chemistry''. '''59''' (23): 10411–10434. [[doi:10.1021/acs.jmedchem.6b00669]] |
|||
* Popov L. D. (2020). Mitochondrial biogenesis: An update. ''Journal of cellular and molecular medicine'', ''24''(9), 4892–4899. [[doi:10.1111/jcmm.15194]] |
|||
== Примітки == |
|||
[[Категорія:Клітинна біологія]] |
[[Категорія:Клітинна біологія]] |
||
[[Категорія:Мітохондрії]] |
[[Категорія:Мітохондрії]] |
||
Версія за 14:03, 12 березня 2023

Мітохондріальний біогенез — це процес, за допомогою якого клітини збільшують кількість мітохондрій.[1][2]
Вперше це був описаний Джоном Холлозі в 1960-х роках, коли було виявлено, що тренування на фізичну витривалість спричиняють підвищення вмісту мітохондрій, що призводить до більшого поглинання глюкози м’язами.[3] Мітохондріальний біогенез активується численними різними сигналами під час клітинного стресу або у відповідь на подразники навколишнього середовища, такі як аеробні вправи.[1][2][4]
Передумови
Здатність мітохондрій до самовідтворення корениться в її еволюційній історії. Зазвичай вважають, що мітохондрії походять від клітин, які утворили ендосимбіотичні відносини з α-протобактеріями; вони мають власний геном для реплікації.[5] Однак останні дані свідчать про те, що мітохондрії могли еволюціонувати й без симбіозу.[6] Мітохондрія є ключовим регулятором метаболічної активності клітини, а також є важливою органелою як у виробництві, так і в розпаді вільних радикалів.[7] Вважається, що більша кількість мітохондріальних копій (або більша маса мітохондрій) є захисним та адаптаційним механізмом клітини.
Мітохондрії утворюються в результаті транскрипції та трансляції генів як у ядерному геномі, так і в мітохондріальному геномі. Більшість мітохондріального білка походить із ядерного геному, тоді як мітохондріальний геном кодує частини ланцюга транспортування електронів разом із мітохондріальною рРНК і тРНК. Мітохондріальний біогенез збільшує кількість метаболічних ферментів для гліколізу, окисного фосфорилювання та, зрештою, для більшої метаболічної здатність мітохондрій. Залежно від доступних енергетичних субстратів і окисно-відновного стану клітини, клітина може збільшувати або зменшувати кількість і розмір мітохондрій.[8] Важливо те, що кількість і морфологія мітохондрій змінюються залежно від типу клітини та специфічного контексту попиту, завдяки чому баланс між злиттям/поділом мітохондрій регулює розподіл, морфологію та функцію мітохондрій.[9][8]
Імпорт білку

Оскільки більшість мітохондріальних білків походить з ядерного геному, білки повинні бути належним чином спрямовані та транспортовані в мітохондрії для виконання своїх функцій.[8][10][11] Спочатку мРНК транслюється в цитозолі клітини.[10][11] У результаті отримані розгорнуті білки-попередники зможуть досягти відповідних мітохондріальних компартментів.[11][10] Білки-попередники транспортуються в одну з чотирьох областей мітохондрій, які включають зовнішню мембрану, внутрішню мембрану, міжмембранний простір і матрикс.[10][11] Усі білки надходять у мітохондрії через транслоказу на зовнішній мітохондріальній мембрані (TOM).[11][10][5] Деякі білки мають N-кінцевий сигнал націлювання, і ці білки виявляються і транспортуються в матрицю, де потім розщеплюються та згортаються.[12][11][10] Інші білки можуть мати інформацію про націлювання у своїх послідовностях і не включатимуть N-кінцевий сигнал.[11][10]
Протягом останніх двох десятиліть дослідники виявили понад тридцять білків, які беруть участь в імпорті мітохондріальних білків.[11] Коли дослідники дізнаються більше про ці білки та про те, як вони досягають відповідних мітохондріальних відділів, які їх використовують, стає очевидним, що існує безліч процесів, які працюють разом у клітині, щоб забезпечити мітохондріальний біогенез.[11][8]
Злиття і поділ
Мітохондрії дуже різноманітні і здатні змінювати свою форму в результаті подій поділу та злиття.[9][8] Поділ — це подія, коли одна сутність розпадається на частини, тоді як злиття — це подія, коли дві або більше сутності з’єднуються, щоб утворити ціле.[8] Процеси поділу та злиття протистоять один одному і дозволяють мітохондріальній мережі постійно перебудовуватися.[9][8] Якщо подразник викликає зміну балансу поділу та злиття в клітині, це може суттєво змінити мітохондріальну мережу.[9][13] Наприклад, посилення поділу мітохондрій призвело б до створення багатьох фрагментованих мітохондрій, що, як було показано, корисно для усунення пошкоджених мітохондрій і для створення менших мітохондрій для ефективного транспортування до енергоспоживаючих областей.[13][14] Таким чином, досягнення балансу між цими механізмами дозволяє клітині мати належну організацію своєї мітохондріальної мережі під час біогенезу та може відігравати важливу роль у адаптації м’язів та нейронів до фізіологічного стресу.[13]
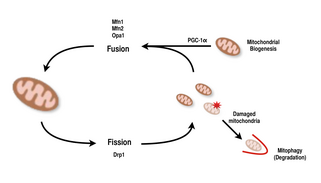
У ссавців як злиття, так і поділ мітохондрій контролюються ГТФазами родини динамінів.[8][13] Процесом поділу мітохондрій керує Drp1, член сімейства цитозольних динамінів.[8][9] Цей білок утворює спіраль навколо мітохондрій і звужується, щоб розбити зовнішню та внутрішню мембрани органели.[14] З іншого боку, процес злиття керується різними білками-динамінами, закріпленими на мембрані, на різних рівнях мітохондрій.[13] Злиття на рівні зовнішньої мітохондріальної мембрани опосередковується Mfn1 і Mfn2 (мітофузини 1 і 2)[15], а злиття на рівні внутрішньої мітохондріальної мембрани опосередковується Opa1.[8][12][13] Численні дослідження спостерігали корельоване збільшення дихальної здатності мітохондрій з експресією генів Mfn1, Mnf2 і Drp1 після вправ на витривалість.[14][15] Таким чином, підтверджується те, що реорганізація мітохондріальної мережі в м’язових клітинах відіграє важливу роль у відповідь на фізичні вправи.[4][13][15]
Регуляція
PGC-1α, член сімейства транскрипційних коактиваторів гамма-рецепторів, активованих проліфератором пероксисом (PGC), є головним регулятором мітохондріального біогенезу.[1][2][16] Відомо, що він коактивує ядерний респіраторний фактор 2 (NRF2/GABPA) і разом з NRF-2 коактивує ядерний респіраторний фактор 1 (NRF1).[15][16] NRFs, у свою чергу, активують мітохондріальний транскрипційний фактор A (tfam), який безпосередньо відповідає за транскрипцію мітохондріальних білків, кодованих у ядрі.[15][16] Це включає як структурні мітохондріальні білки, так і ті, що беруть участь у транскрипції, трансляції та репарації мтДНК.[16] PGC-1β, білок, структурно подібний до PGC-1α, також бере участь у регуляції мітохондріального біогенезу, але відрізняється тим, що він не збільшується у відповідь на фізичні вправи.[5][17][16] Хоча спостерігалося значне збільшення кількості мітохондрій у тканинах, де PGC-1α надмірно експресується, оскільки кофактор взаємодіє з цими ключовими факторами транскрипції, нокаутовані миші з порушеним PGC-1α все ще життєздатні та демонструють нормальну кількість мітохондрій.[17][5][16] Таким чином, PGC-1α не потрібен для нормального розвитку мітохондрій у мишей, але під час фізіологічного стресу ці миші виявляють знижену толерантність порівняно з мишами з нормальним рівнем PGC-1α.[5][16][17] Подібним чином, у нокаутованих мишей із порушеною PGC-1β, миші демонстрували переважно нормальний рівень мітохондріальної функції зі зниженою здатністю адаптуватися до фізіологічного стресу.[18][5] Однак експеримент з подвійним нокаутом PGC-1α/β створив мишей, які загинули переважно протягом 24 годин через дефекти мітохондріального дозрівання серцевої тканини.[19] Ці знахідки свідчать про те, що, хоча поодинці PGC-1α і PGC-1β не є безумовно необхідними для здатності клітини здійснювати мітохондріальний біогенез, разом вони здатні доповнювати один одного для оптимального дозрівання мітохондрій і функціонування в періоди фізіологічного стресу.[19][5][17]
AMP-активована кіназа (AMPK) також регулює мітохондріальний біогенез шляхом фосфорилювання та активації PGC-1α після відчуття дефіциту енергії в м’язах та нейронах.[5][16] Було показано, що у мишей зі зниженим співвідношенням АТФ/АМФ під час фізичних вправ виснаження енергії корелює з активацією AMPK. [5][18][16] Активація AMPK продовжувала активувати PGC-1α і NRF у цих мишей, що стимулювало мітохондріальний біогенез.[5][18][16]
Нейропластичність і мітохондріальний біогенез
Основна стаття — Нейропластичність.
Також, вважається, що регуляція мітохондріального біогенезу та функцій мітохондрій відіграє ключову роль у забезпеченні енергією, необхідною для підтримки клітинних процесів, які лежать в основі довгострокової синаптичної пластичності.[20][21] У нейронах мітохондрії виконують різноманітні функції, такі як виробництво енергії у формі АТФ, буферизація кальцію та генерація активних форм кисню.[21] Одним з важливих механізмів збільшення кількості мітохондрій в активних синапсах є активація коактиватора транскрипції PGC-1α (гамма-коактиватор 1-альфа рецептора, що активується проліфератором пероксисом), який, як відомо, регулює мітохондріальний біогенез і функціонує у відповідь на підвищену потребу в енергії. PGC-1α активується фактором транскрипції NRF-1 (ядерний респіраторний фактор 1), який зв’язується з промоторними ділянками мітохондріальних генів, що кодуються в ядрах, і посилює їх експресію. Це призводить до збільшення мітохондріального біогенезу, і щойно синтезовані мітохондрії спрямовуються до синапсів, які відчувають підвищену потребу в енергії.[22] Інший механізм включає активацію протеїнкінази AMPK (AMP-активована протеїнкіназа), яка є ключовим регулятором гомеостазу клітинної енергії. Активація AMPK призводить до фосфорилювання кількох наступних мішеней, включаючи PGC-1α, що посилює мітохондріальний біогенез.[23] Крім того, AMPK також може регулювати транспортування мітохондрій до синапсу шляхом фосфорилювання мітохондріального моторного білка Miro, який контролює рух мітохондрій уздовж мікротрубочок.[24][25][26] Нарешті, дослідження також показали участь процесів поділу та злиття мітохондрій у регуляції розподілу мітохондрій у синапсах.[27][28][29] Ці процеси контролюються декількома білками, включаючи DRP1 (пов’язаний з динаміном білок 1) і MFN1/2 (мітофузин 1/2), і вважається, що вони відіграють певну роль у регулюванні кількості мітохондрій у синапсах.[30][31][32][33]
З’являється все більше доказів того, що регулярні фізичні вправи можуть сприяти мітохондріальному біогенезу в мозку, що може сприяти покращенню когнітивних функцій і настрою. Це призвело до зацікавленості у використанні фізичних вправ як немедикаментозного втручання для нейродегенеративних розладів та інших неврологічних станів.[34][35]
Старіння і мітохондріальний біогенез
Було показано, що здатність до мітохондріального біогенезу може зменшуватись з віком, і таке зниження функції мітохондрій може бути пов’язане з розвитком діабету і серцево-судинних захворювань.[36][37][38] Старіння та захворювання можуть викликати зміни в рівнях експресії генів білків, які беруть участь у механізмах поділу та злиття мітохондрій, таким чином створюючи дисфункціональні мітохондрії.[39][40] Один з десяти механізмів старіння пов’язаний з вкороченням теломер, кінцевих сегментів хромосом, які захищають генетичну інформацію від деградації.[37][40] Вкорочення теломер також було пов’язану зі зниженням функції мітохондрій.[40][37] Дефіцит зворотної транскриптази теломерази (TERT), ферменту, який відіграє важливу роль у відновленні і збереженні теломерів, корелює з активованим p53, білком, який пригнічує PGC-1α.[40][39][37] Таким чином, вкорочення теломер і дефіцит TERT були пов’язані з порушенням мітохондріального біогенезу.[37][39][40] Було також показано, що експресія AMPK може зменшуватись з віком, що також може сприяти пригніченню мітохондріального біогенезу.[5][40]
Див. також — Омолодження, Збільшення тривалості життя.
Клінічні застосування націлювання на мітохондріальний біогенез
Мітохондріальний біогенез може бути спрямований на запобігання проліферації раку. Зокрема, два регулятори біогенезу — PGC1α і c-Myc — можуть бути спрямовані на запобігання проліферації раку.
PGC1α є ключовим компонентом мітохондріального біогенезу — як коактиватор транскрипції, він націлений на численні фактори транскрипції та естроген-пов’язаний рецептор альфа (ERRα).[41] Було виявлено, що сполуки, які спрямовані на шлях між PGC1α та ERRα, такі як зворотний агоніст ERRα, XCT-790, можуть значно знижувати мітохондріальний біогенез, таким чином значно зменшуючи проліферацію ракових клітин і підвищуючи їхню чутливість до хіміотерапевтичних засобів.[42]
c-Myc, фактор транскрипції, може бути інгібований під час його димеризації білком Max такими молекулами, як IIA6B17[43] і omomyc.[44] Інгібування комплексу c-Myc-Max може блокувати клітинний цикл і індукувати апоптоз ракових клітин.
Див. також
Література
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). "Mitochondrial Biogenesis as a Pharmacological Target: A New Approach to Acute and Chronic Diseases". Annual Review of Pharmacology and Toxicology. 56: 229–49. doi:10.1146/annurev-pharmtox-010715-103155
- Cameron RB, Beeson CC, Schnellmann RG (December 2016). "Development of Therapeutics That Induce Mitochondrial Biogenesis for the Treatment of Acute and Chronic Degenerative Diseases". Journal of Medicinal Chemistry. 59 (23): 10411–10434. doi:10.1021/acs.jmedchem.6b00669
- Popov L. D. (2020). Mitochondrial biogenesis: An update. Journal of cellular and molecular medicine, 24(9), 4892–4899. doi:10.1111/jcmm.15194
Примітки
- ↑ а б в Valero, Teresa (2014). Editorial (Thematic Issue: Mitochondrial Biogenesis: Pharmacological Approaches). Current Pharmaceutical Design. 20 (35): 5507—5509. doi:10.2174/138161282035140911142118. PMID 24606795.
- ↑ а б в Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches. Current Pharmaceutical Design. 20 (35): 5619—33. doi:10.2174/1381612820666140306095106. PMID 24606801.
- ↑ Holloszy JO (April 2011). RRegulation of Mitochondrial Biogenesis and GLUT4 Expression by Exercise. Comprehensive Physiology. 1 (2): 921—40. doi:10.1002/cphy.c100052. ISBN 9780470650714. PMID 23737207.
- ↑ а б Boushel R, Lundby C, Qvortrup K, Sahlin K (October 2014). Mitochondrial plasticity with exercise training and extreme environments. Exercise and Sport Sciences Reviews. 42 (4): 169—74. doi:10.1249/JES.0000000000000025. PMID 25062000.
- ↑ а б в г д е ж и к л м Jornayvaz FR, Shulman GI (2010). Regulation of mitochondrial biogenesis. Essays in Biochemistry. 47: 69—84. doi:10.1042/bse0470069. PMC 3883043. PMID 20533901. Помилка цитування: Некоректний тег
<ref>; назва «:3» визначена кілька разів з різним вмістом - ↑ Harish A, Kurland CG (December 2017). Mitochondria are not captive bacteria. Journal of Theoretical Biology. 434: 88—98. doi:10.1016/j.jtbi.2017.07.011. PMID 28754286.
- ↑ Bevilacqua L, Ramsey JJ, Hagopian K, Weindruch R, Harper ME (May 2004). Effects of short- and medium-term calorie restriction on muscle mitochondrial proton leak and reactive oxygen species production. American Journal of Physiology. Endocrinology and Metabolism. 286 (5): E852-61. doi:10.1152/ajpendo.00367.2003. PMID 14736705.
- ↑ а б в г д е ж и к л Mishra P, Chan DC (February 2016). Metabolic regulation of mitochondrial dynamics. The Journal of Cell Biology. 212 (4): 379—87. doi:10.1083/jcb.201511036. PMC 4754720. PMID 26858267. Помилка цитування: Некоректний тег
<ref>; назва «pmid26858267» визначена кілька разів з різним вмістом - ↑ а б в г д Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, Arnauné-Pelloquin L, Davezac N, Mils V, Miquel MC, Rojo M, Belenguer P (June 2016). Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity. Neurobiology of Disease. 90: 3—19. doi:10.1016/j.nbd.2015.10.011. PMID 26494254.
{{cite journal}}: Недійсний|displayauthors=6(довідка) Помилка цитування: Некоректний тег<ref>; назва «pmid26494254» визначена кілька разів з різним вмістом - ↑ а б в г д е ж Dudek J, Rehling P, van der Laan M (February 2013). Mitochondrial protein import: common principles and physiological networks. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1833 (2): 274—85. doi:10.1016/j.bbamcr.2012.05.028. PMID 22683763.
- ↑ а б в г д е ж и к Baker MJ, Frazier AE, Gulbis JM, Ryan MT (September 2007). Mitochondrial protein-import machinery: correlating structure with function. Trends in Cell Biology. 17 (9): 456—64. doi:10.1016/j.tcb.2007.07.010. PMID 17825565.
- ↑ а б Ventura-Clapier R, Garnier A, Veksler V (July 2008). Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha. Cardiovascular Research. 79 (2): 208—17. doi:10.1093/cvr/cvn098. PMID 18430751. Помилка цитування: Некоректний тег
<ref>; назва «:0» визначена кілька разів з різним вмістом - ↑ а б в г д е ж Youle RJ, van der Bliek AM (August 2012). Mitochondrial fission, fusion, and stress. Science. 337 (6098): 1062—5. doi:10.1126/science.1219855. PMC 4762028. PMID 22936770. Помилка цитування: Некоректний тег
<ref>; назва «:6» визначена кілька разів з різним вмістом - ↑ а б в Bo H, Zhang Y, Ji LL (July 2010). Redefining the role of mitochondria in exercise: a dynamic remodeling. Annals of the New York Academy of Sciences. 1201: 121—8. doi:10.1111/j.1749-6632.2010.05618.x. PMID 20649548. Помилка цитування: Некоректний тег
<ref>; назва «:2» визначена кілька разів з різним вмістом - ↑ а б в г д Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S, Ziltener JL, Luthi F, Dériaz O, Zorzano A, Gobelet C, Kralli A, Russell AP (August 2005). Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise. The Journal of Physiology. 567 (Pt 1): 349—58. doi:10.1113/jphysiol.2005.092031. PMC 1474174. PMID 15961417.
{{cite journal}}: Недійсний|displayauthors=6(довідка) Помилка цитування: Некоректний тег<ref>; назва «:7» визначена кілька разів з різним вмістом - ↑ а б в г д е ж и к л Johri A, Chandra A, Flint Beal M (September 2013). PGC-1α, mitochondrial dysfunction, and Huntington's disease. Free Radical Biology & Medicine. 62: 37—46. doi:10.1016/j.freeradbiomed.2013.04.016. PMC 3722269. PMID 23602910. Помилка цитування: Некоректний тег
<ref>; назва «pmid23602910» визначена кілька разів з різним вмістом - ↑ а б в г Lin J, Wu PH, Tarr PT, Lindenberg KS, St-Pierre J, Zhang CY, Mootha VK, Jäger S, Vianna CR, Reznick RM, Cui L, Manieri M, Donovan MX, Wu Z, Cooper MP, Fan MC, Rohas LM, Zavacki AM, Cinti S, Shulman GI, Lowell BB, Krainc D, Spiegelman BM (October 2004). Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice. Cell. 119 (1): 121—35. doi:10.1016/j.cell.2004.09.013. PMID 15454086.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ а б в Scarpulla RC (July 2011). Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1813 (7): 1269—78. doi:10.1016/j.bbamcr.2010.09.019. PMC 3035754. PMID 20933024. Помилка цитування: Некоректний тег
<ref>; назва «:4» визначена кілька разів з різним вмістом - ↑ а б Lai L, Leone TC, Zechner C, Schaeffer PJ, Kelly SM, Flanagan DP, Medeiros DM, Kovacs A, Kelly DP (July 2008). Transcriptional coactivators PGC-1alpha and PGC-lbeta control overlapping programs required for perinatal maturation of the heart. Genes & Development. 22 (14): 1948—61. doi:10.1101/gad.1661708. PMC 2492740. PMID 18628400.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Spadini, Sara; Racchetti, Gabriella; Adiletta, Alice; Lamanna, Jacopo; Moro, Andrea Stefano; Ferro, Mattia; Zimarino, Vincenzo; Malgaroli, Antonio (1 листопада 2021). A novel integrated approach to estimate the mitochondrial content of neuronal cells and brain tissues. Journal of Neuroscience Methods (англ.). Т. 363. с. 109351. doi:10.1016/j.jneumeth.2021.109351. ISSN 0165-0270. Процитовано 9 березня 2023.
- ↑ а б Uittenbogaard, Martine; Chiaramello, Anne. Mitochondrial Biogenesis: A Therapeutic Target for Neurodevelopmental Disorders and Neurodegenerative Diseases. Current Pharmaceutical Design (англ.). Т. 20, № 35. с. 5574—5593. doi:10.2174/1381612820666140305224906. PMC 4823001. PMID 24606804. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Jamwal, Sumit; Blackburn, Jennifer K.; Elsworth, John D. (2021-03). PPARγ/PGC1α signaling as a potential therapeutic target for mitochondrial biogenesis in neurodegenerative disorders. Pharmacology & Therapeutics (англ.). Т. 219. с. 107705. doi:10.1016/j.pharmthera.2020.107705. PMC 7887032. PMID 33039420. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Herzig, Sébastien; Shaw, Reuben J. (2018-02). AMPK: guardian of metabolism and mitochondrial homeostasis. Nature Reviews Molecular Cell Biology (англ.). Т. 19, № 2. с. 121—135. doi:10.1038/nrm.2017.95. ISSN 1471-0072. PMC 5780224. PMID 28974774. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Cunniff, Brian; McKenzie, Andrew J.; Heintz, Nicholas H.; Howe, Alan K. (2016-09). Heldin, Carl-Henrik (ред.). AMPK activity regulates trafficking of mitochondria to the leading edge during cell migration and matrix invasion. Molecular Biology of the Cell (англ.). Т. 27, № 17. с. 2662—2674. doi:10.1091/mbc.e16-05-0286. ISSN 1059-1524. PMC 5007087. PMID 27385336. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Watters, Orla; Connolly, Niamh M. C.; König, Hans-Georg; Düssmann, Heiko; Prehn, Jochen H. M. (17 червня 2020). AMPK Preferentially Depresses Retrograde Transport of Axonal Mitochondria during Localized Nutrient Deprivation. The Journal of Neuroscience (англ.). Т. 40, № 25. с. 4798—4812. doi:10.1523/JNEUROSCI.2067-19.2020. ISSN 0270-6474. PMC 7326360. PMID 32393534. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Vona, Rosa; Mileo, Anna Maria; Matarrese, Paola (2021-01). Microtubule-Based Mitochondrial Dynamics as a Valuable Therapeutic Target in Cancer. Cancers (англ.). Т. 13, № 22. с. 5812. doi:10.3390/cancers13225812. ISSN 2072-6694. PMC 8616325. PMID 34830966. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Chen, H.; Chan, D. C. (15 жовтня 2009). Mitochondrial dynamics-fusion, fission, movement, and mitophagy-in neurodegenerative diseases. Human Molecular Genetics (англ.). Т. 18, № R2. с. R169—R176. doi:10.1093/hmg/ddp326. ISSN 0964-6906. PMC 2758711. PMID 19808793. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Yang, Danying; Ying, Jun; Wang, Xifeng; Zhao, Tiancheng; Yoon, Sungtae; Fang, Yang; Zheng, Qingcui; Liu, Xing; Yu, Wen (2021). Mitochondrial Dynamics: A Key Role in Neurodegeneration and a Potential Target for Neurodegenerative Disease. Frontiers in Neuroscience. Т. 15. doi:10.3389/fnins.2021.654785. ISSN 1662-453X. PMC 8072049. PMID 33912006. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Green, Adam; Hossain, Tanvir; Eckmann, David M. (19 жовтня 2022). Mitochondrial dynamics involves molecular and mechanical events in motility, fusion and fission. Frontiers in Cell and Developmental Biology. Т. 10. с. 1010232. doi:10.3389/fcell.2022.1010232. ISSN 2296-634X. PMC 9626967. PMID 36340034. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Cho, Bongki; Choi, So Yoen; Cho, Hyo Min; Kim, Hyun Jung; Sun, Woong (30 вересня 2013). Physiological and Pathological Significance of Dynamin-Related Protein 1 (Drp1)-Dependent Mitochondrial Fission in the Nervous System. Experimental Neurobiology (англ.). Т. 22, № 3. с. 149—157. doi:10.5607/en.2013.22.3.149. ISSN 1226-2560. PMC 3807002. PMID 24167410. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Choi, So Yoen; Kim, Joo Yeon; Kim, Hyun‐Wook; Cho, Bongki; Cho, Hyo Min; Oppenheim, Ronald W.; Kim, Hyun; Rhyu, Im Joo; Sun, Woong (2013-01). Drp1‐mediated mitochondrial dynamics and survival of developing chick motoneurons during the period of normal programmed cell death. The FASEB Journal (англ.). Т. 27, № 1. с. 51—62. doi:10.1096/fj.12-211920. ISSN 0892-6638. PMC 3528306. PMID 22997225. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Sharma, Arpit; Smith, Hannah J; Yao, Pallas; Mair, William B (5 грудня 2019). Causal roles of mitochondrial dynamics in longevity and healthy aging. EMBO reports (англ.). Т. 20, № 12. doi:10.15252/embr.201948395. ISSN 1469-221X. PMC 6893295. PMID 31667999. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Beikoghli Kalkhoran, Siavash; Kararigas, Georgios (20 січня 2022). Oestrogenic Regulation of Mitochondrial Dynamics. International Journal of Molecular Sciences (англ.). Т. 23, № 3. с. 1118. doi:10.3390/ijms23031118. ISSN 1422-0067. PMC 8834780. PMID 35163044. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Steiner, Jennifer L.; Murphy, E. Angela; McClellan, Jamie L.; Carmichael, Martin D.; Davis, J. Mark (2011-10). Exercise training increases mitochondrial biogenesis in the brain. Journal of Applied Physiology (англ.). Т. 111, № 4. с. 1066—1071. doi:10.1152/japplphysiol.00343.2011. ISSN 8750-7587. Процитовано 9 березня 2023.
- ↑ Sun, Lina; Liu, Tianbiao; Liu, Jingqi; Gao, Chong; Zhang, Xiaohui (7 вересня 2022). Physical exercise and mitochondrial function: New therapeutic interventions for psychiatric and neurodegenerative disorders. Frontiers in Neurology. Т. 13. с. 929781. doi:10.3389/fneur.2022.929781. ISSN 1664-2295. PMC 9491238. PMID 36158946. Процитовано 9 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Handy DE, Loscalzo J (June 2012). Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11): 1323—67. doi:10.1089/ars.2011.4123. PMC 3324814. PMID 22146081.
- ↑ а б в г д David R (April 2011). Ageing: Mitochondria and telomeres come together. Nature Reviews. Molecular Cell Biology. 12 (4): 204. doi:10.1038/nrm3082. PMID 21407239.
- ↑ Hagen TM, Wehr CM, Ames BN (November 1998). Mitochondrial decay in aging. Reversal through supplementation of acetyl-L-carnitine and N-tert-butyl-alpha-phenyl-nitrone. Annals of the New York Academy of Sciences. 854: 214—23. doi:10.1111/j.1749-6632.1998.tb09904.x. PMID 9928432.
- ↑ а б в Sahin E, Colla S, Liesa M, Moslehi J, Müller FL, Guo M, Cooper M, Kotton D, Fabian AJ, Walkey C, Maser RS, Tonon G, Foerster F, Xiong R, Wang YA, Shukla SA, Jaskelioff M, Martin ES, Heffernan TP, Protopopov A, Ivanova E, Mahoney JE, Kost-Alimova M, Perry SR, Bronson R, Liao R, Mulligan R, Shirihai OS, Chin L, DePinho RA (February 2011). Telomere dysfunction induces metabolic and mitochondrial compromise. Nature. 470 (7334): 359—65. doi:10.1038/nature09787. PMC 3741661. PMID 21307849.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ а б в г д е Sahin E, DePinho RA (May 2012). Axis of ageing: telomeres, p53 and mitochondria. Nature Reviews. Molecular Cell Biology. 13 (6): 397—404. doi:10.1038/nrm3352. PMC 3718675. PMID 22588366.
- ↑ Scarpulla, Richard (2011). Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network. Biochim Biophys Acta. 1813 (7): 1269—1278. doi:10.1016/j.bbamcr.2010.09.019. PMC 3035754. PMID 20933024.
- ↑ Kokabu, Tetsuya; Mori, Taisuke; Matsushima, Hiroshi; Yoriki, Kaori; Kataoka, Hisashi; Tarumi, Yosuke; Kitawaki, Jo (2019). Antitumor effect of XCT790, an ERRα inverse agonist, on ERα-negative endometrial cancer cells. Cell Oncol (Dordr). 42 (2): 223—235. doi:10.1007/s13402-019-00423-5. PMID 30706380.
- ↑ Lu, Xiaohong; Vogt, Peter; Boger, Dale; Lunec, John (2008). Disruption of the MYC transcriptional function by a small-molecule antagonist of MYC/MAX dimerization. Oncol. Rep. Medical Radiology. 19 (3). doi:10.1007/978-3-540-77385-6. ISBN 978-3-540-77384-9. PMID 18288422.
- ↑ Demma, Mark; Mapelli, Claudio; Sun, Angie; Bodea, Smaranda; Ruprecht, Benjamin; Javaid, Sarah; Wiswell, Derek; Muise, Eric; Chen, Shiyang (2019). Omomyc Reveals New Mechanisms To Inhibit the MYC Oncogene. Mol Cell Biol. 39 (22): e00248-19. doi:10.1128/MCB.00248-19. PMC 6817756. PMID 31501275.