Хромофор
Ця стаття потребує уваги й турботи фахівця у своїй галузі. |
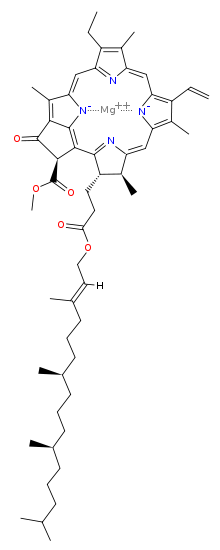
Хромофо́р (Від грецьк. “хрома” – забарвлення, колір.) — структурна одиниця молекули, яка відповідає за її оптичні властивості, поглинання й випромінювання світла. Хромофор відповідає за колір речовини, звідки й походить його назва (від дав.-гр. χρωμα — колір, фарба та дав.-гр. φορος — носій).
Так, зелене забарвлення хлорофілу зумовленне існуванням в ньому метало-органічного комплексу: порфірину з іоном магнію, червоне забарвлення гемоглобіну — порфірину з іоном заліза.
Майже всі хромофори відносяться до одного з двох класів:
- фрагменти органічних молекул з подвійними зв'язками (в тому числі системами спряжених подвійних зв'язків) та/або гетероатомами;
- комплекси з йонами перехідних металів.
Термін «хромофор» був запропонований в сімдесяті роки XIX століття німецьким хіміком О. Н. Віттом. Існують також певні групи, які самі по собі не є хромофорами, але посилюють здатність хромофорів поглинати світло та взагалі модифікують спектр поглинання (в першу чергу, зсувають його максимум). Такі групи в теорії Вітта називаються ауксохромами. Приклади ауксохромних груп: , , , , , , .
Пізніше ця теорія поступилася місцем квантовомеханічній, але не відійшла цілковито в область історії науки: її основні поняття досить корисні для розуміння теорії електронних спектрів і сьогодні. Щоб опукліше представити паралель між цією дещо застарілою, але наочною моделлю та строгішим квантовохімічним розглядом, звернемося до прикладів. Кожен хромофор має в електронному спектрі свою смугу поглинання. Їй відповідає певний перехід електрона з одного енергетичного рівня на інший (а кожному такому рівневі — певна молекулярна орбіталь).
| Хромофорна група | Перехід | λmax, нм |
εmax, л•моль−1•см−1 |
|
| C=C | 180 | 10000 | ||
| C=O | 270 | 15÷30 | ||
| 190 | 1000 | |||
| N=N | 340 | 5 | ||
| 150 | 5 | |||
| C=S | 520 | 5 | ||
| C=C-C=C | 220 | 20000 | ||
| C=C-C=O | 320 | 100 | ||
| N=O | 660 | 10 | ||
| Бензольне кільце |
260 | 200 |
Згідно з теорією молекулярних орбіталей (МО), при утворенні молекулярних орбіталей з атомних енергетичні рівні останніх розщеплюються: одна МО в результаті має нижчу енергію порівняно з енергією окремих, розділених атомів, натомість друга — вищу. Зрозуміло, що електрони займають енергетично вигіднішу позицію: на нижчій МО, яка тому й називається зв'язувальною, бо саме знаходженням електронів на ній створюється хімічний зв'язок. Вища за енергією орбіталь, навпаки, начебто розштовхує атоми; її зазвичай позначають зірочкою і називають розпушувальною (англ. repulsive, anti-bonding, рос. разрыхляющая). Так звані сигма-орбіталі утворюються об'єднанням електронних хмар вздовж лінії, що з'єднує два атоми. Пі-орбіталі мають складнішу структуру: об'єднання відбувається по обидва боки від цієї лінії. В органічних молекулах з гетероатомами (кажучи дещо спрощено, це будь-які атоми, відмінні від вуглецю та водню), крім зв'язувальних та розпушувальних сигма- та пі-орбіталей існують ще так звані незв'язувальні: неподілена електронна пара, що наявна в таких атомів, майже не бере участі в хімічному зв'язку, хоча значно впливає на спектр. Незв'язувальні орбіталі позначаються латинською літерою n. Поглинання кванта світла молекулою призводить до переходу одного з електронів з нижчого енергетичного рівня на вищий, незайнятий. Спрощену умовну схему енергетичних рівнів, що відповідають різним молекулярним орбіталям та переходам між ними, подано на малюнку.
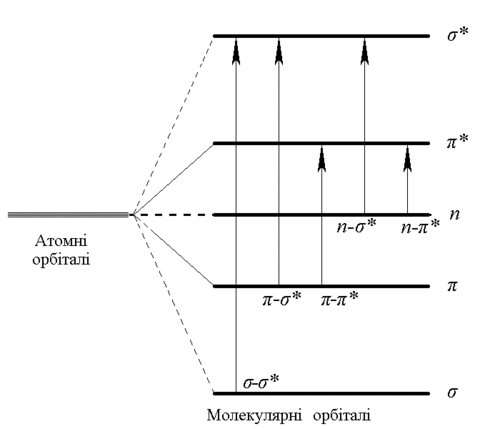
З цієї умовної схеми легко бачити, що переходам різних типів відповідає вельми різна енергія збудження. Найбільші за енергією -переходи. Спектральні смуги, що відповідають цим переходам, мають усі молекули, але ці смуги малоспецифічні (тобто приблизно однакові для всіх, а тому несуть надто мало інформації). До того ж, вони відповідають далекому (вакуумному) ультрафіолету (нм), що створює великі технічні складнощі (на цих довжинах хвиль поглинає й повітря, чому треба працювати у вакуумі; дослідження потребують спеціальної оптики, наприклад, із сапфіру тощо).
Наявність у молекулі гетероатому дає можливість спостерігати переходи зі стану n (це електрони, які не беруть участі в формуванні хімічних зв'язків, в першу чергу електрони електронних пар, які тісно зв'язані зі своїми атомами, і якими атоми не діляться зі своїми сусідами). Ці переходи потребують меншої енергії (спостерігаються на більших довжинах хвиль). Якщо ми порівняємо спектральні властивості вуглеводнів та їхніх заміщених похідних, як-от CH3CH2NH2, CH3NH2, CH3OH, CH3SH, CH3I тощо, то побачимо, що сполуки без гетероатомів поглинають світло зі значно меншою довжиною хвилі. Так, метан поглинає при нм, а CH3I — при нм. Це — прояв -переходу.
За наявності подвійних (взагалі кратних) зв'язків, особливо ж спряжених -систем, можливі переходи з участю -орбіталей. Групи, що відповідальні за - та -переходи, якраз і є хромофорами. Зазвичай енергія -переходу менша, ніж , але коли спряження в системі значне, енергетичний рівень найвищої зайнятої -орбіталі може стати вищим від рівня n-орбіталі, й -перехід потребуватиме меншої енергії (або більшої довжини хвилі), ніж . Взагалі -переходам властиве менше значення : < 100 порівняно з для . Підвищення полярності розчинника або введення електронно-донорних заміщувачів зсуває переходи в червоний бік (довші хвилі), а — в синій (коротші хвилі). При цьому збільшується коефіцієнт поглинання для -переходів. Ще більший червоний зсув спостерігається при іонізації молекул, бо значно збільшується рухомість електронної оболонки завдяки появі електрона, що не бере участі в ковалентному зв'язку. Ось чому типові фарбники — це іонізовані молекули з розвиненою системою спряження, багаті на ауксохромні групи. Як приклад можна навести фарбник родамін 3B:

Див. також
Література
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л.М.Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0
- К. Хигаси, Х. Баба, А Рембаум. Квантовая органическая химия. Москва: Мир, 1967, с. 191-196.
- Н. Дж. Турро. Молекулярная фотохимия. Москва: Мир, 1967, с. 55-58.
- Ю. И. Наберухин. Лекции по молекулярной спектроскопии. Новосибирск: НГУ, 1973, с. 206-209.
| Це незавершена стаття з фізики. Ви можете допомогти проєкту, виправивши або дописавши її. |
















