Хімічний зв'язок
| Хімічний зв'язок | |
 | |
| |
Хімі́чний зв'язо́к — це взаємодія між атомами, яка утримує їх у молекулі чи твердому тілі.
Хімічні зв'язки є результатом взаємодії електронів та ядер атомів і описуються квантовою механікою. В першій третині XX ст. зародилася окрема галузь хімії, предметом якої є вивчення структури молекул і кристалів за допомогою квантово-механічних розрахунків: квантова хімія. Ця галузь набула особливо інтенсивного розвитку протягом кількох останніх десятиріч.
Про розвиток поняття[ред. | ред. код]
Сучасного вигляду теорія хімічного зв'язку почала набувати після того, як Г. Льюїс та В. Коссель у 1916 р. відзначили, що атоми утворюють хімічний зв'язок для того, щоб доповнити свою електронну оболонку до певної «магічної» кількості електронів. Для гідрогену це число дорівнює 2, для атомів другого періоду — 8, третього — 18. Якщо розглядати лише зовнішню електронну оболонку, то для більшості елементів це число становитиме 8 (правило октету). Таке доповнення відбувається двома шляхами:
- повна передача одного чи більше електронів від одного атома до іншого. Утворюються різнойменно заряджені іони, які притягуються електростатичними силами (іонний зв'язок);
- усуспільнення атомами одної чи більше електронної пари. Згодом було з'ясовано, що ці усуспільнені електрони накопичуються здебільшого між ядрами, які й притягуються до накопиченого негативного заряду (ковалентний зв'язок).
З точки зору фізики, концепція утворення (спільної) електронної пари була на той час революційною. Саме вона, за Льюїсом, стала центральною концепцією хімічного зв'язку.
В подальшому (Л. Полінг, 1932) кожному з елементів зіставили певну числову величину, названу електронегативністю. Вона визначає здатність атома елементу притягувати електронну пару при утворенні хімічного зв'язку. Ковалентні зв'язки дістали класифікацію на неполярні (між атомами з однаковою електронегативністю, найчастіше одного елементу в ідентичному оточенні) та полярні. Також стало зрозумілим, що іонний зв'язок є граничним випадком ковалентного полярного.
Хімічний зв'язок і квантова хімія[ред. | ред. код]
Два основних наближених підходи до квантово-механічного обчислення енергії молекули — метод валентних зв'язків та метод молекулярних орбіталей — доповнюють один одного в описі хімічного зв'язку.
В методі валентних зв'язків утворення хімічного зв'язку асоціюється зі спаровуванням спінів електронів, що утворюють електронні пари. Електронні пари в початковому описі локалізовані між відповідними атомами, ступінь їх зміщення чи делокалізації визначається вже в ході обчислювального процесу. Хоча математичне формулювання методу виявилось дещо неефективним для комп'ютерної реалізації, його ілюстративний апарат під назвою теорії резонансу (Л. Полінг, 1931-33) і досі є суттєвим компонентом теоретичної органічної хімії.
В методі молекулярних орбіталей утворення хімічного зв'язку асоціюється з перекриттям хвильових функцій атомів — атомних орбіталей, що веде до суперпозиції цих функцій і утворення молекулярних орбіталей. Тут електронні пари делокалізовані по всій молекулі або кристалу, і для характеристики окремих хімічних зв'язків доводиться вдаватися до того чи іншого способу локалізації орбіталей чи то електронних пар. Просторову спрямованість зв'язку певною мірою пояснює концепція гібридизації орбіталей.
Способи утворення та розриву ковалентного зв'язку[ред. | ред. код]
Можливі два способи розриву ковалентного зв'язку, які різняться фінальним розподілом двох електронів, що складали спільну електронну пару, між атомами:
- гомолітичний. Електронна пара ділиться порівну, кожен із атомів отримує по одному електрону, утворюються дві незаряджені частинки, що несуть по неспарованому електрону — вільні радикали;
- гетеролітичний. Один із атомів отримує обидва електрони спільної електронної пари, інший — жодного. Утворюються різнойменно заряджені частинки — іони.
Коли ковалентний зв'язок утворюється між незарядженими частинками за другою схемою, атоми, які усуспільнили електронну пару, набувають (часткового) електричного заряду. Цей механізм називають донорно-акцепторним механізмом утворення ковалентного зв'язку. Найпростіший приклад дає катіон амонію NH+
4.
Теорія хімічної будови органічних сполук Бутлерова[ред. | ред. код]
Термін «хімічна будова» вперше ввів О. М. Бутлеров у 1861 році. Також він заклав основи теорії хімічної будови. Головні положення даної теорії наступні:
- Атоми в молекулах зв'язані один з одним у певній послідовності. Зміна цієї послідовності приводить до утворення нової речовини з новими властивостями.
- З'єднання атомів відбувається відповідно до їх валентності.
- Властивості речовин залежать не тільки від їх складу, а й від «хімічної будови», тобто від порядку з'єднання атомів у молекулах і характеру їх взаємного впливу. Найбільш сильно впливають один на одного атоми, які безпосередньо пов'язані між собою.
Типи хімічного зв'язку[ред. | ред. код]
Серед типів хімічного зв'язку розрізняють:
- Ковалентний зв'язок. Характеризується направленістю та насичуваністю.
- полярний
- неполярний
- Іонний зв'язок. Направленість і насичуваність непритаманні.
- Металічний зв'язок. Виникає внаслідок усуспільнення електронів великою кількістю атомів, утворюється електронний газ.
- Донорно-акцепторний зв'язок, а радше, механізм утворення ковалентного полярного зв'язку. Веде до перевищення формальної валентності елементу, знайденої за періодичною системою.
- Водневий зв'язок. Може бути класифікований як сильна невалентна взаємодія, направленість та насичуваність притаманні лише частково.
- Ван дер Ваальсів зв'язок. Невалентна взаємодія молекул. Насичуваність не притаманна, направленість — лише певною мірою.
- Розрізняють також ацетиленовий зв'язок, банановий зв'язок, поліцентровий зв'язок, семіполярний зв'язок, багатоцентровий хімічний зв’язок.
Найпростіший одноелектронний ковалентний хімічний зв'язок[ред. | ред. код]

Найпростіший одноелектронний хімічний зв'язок створюється єдиним валентним електроном. Виявляється, що один електрон здатний утримувати як одне ціле два позитивні іони. В одноелектронному зв'язку кулонівські сили відштовхування позитивно заряджених частинок компенсуються кулонівськими силами притягання цих частинок до негативно зарядженого електрона. Валентний електрон стає спільним для двох ядер молекули, що є типовою ознакою ковалентного зв'язку.
Приклад такого зв'язку надають молекулярні іони: H+
2, Li+
2, Na+
2, K+
2, Rb+
2, Cs+
2[1]:
| Елемент | H | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|---|
| Електронна конфігурація | 1S1 | [He]2s1 | [Ne]3s1 | [Ar]4s1 | [Kr]5s1 | [Xe]6s1 |
| Між’ядерна відстань
у молекулярному іоні X+ |
1,06 | 3,14 | 3,43 | 4,18 | 4,44 | 4,70 |
| Орбітальний радіус атома, Å | 0,53 | 1,57 | 1,715 | 2,09 | 2,22 | 2,35 |
Існування молекулярних йонів водню[ru] і лужних металів, у яких хімічний зв'язок створює єдиний валентний електрон, розширює і доповнює поняття хімічного зв'язку. Це найпростіший приклад дробового порядку зв'язку. Єдиний зв'язувальний електрон локалізується в просторі між ядрами атомів і утримує їх як єдине ціле, утворюючи стійку хімічну систему (рис.1).
Одинарний ковалентний зв'язок[ред. | ред. код]



Одинарний ковалентний хімічний зв'язок створюється зв'язувальною електронною парою. У всіх чинних теоріях (теорія валентних зв'язків, теорія молекулярних орбіталей, теорія відштовхування валентних електронних пар, борівська модель хімічного зв'язку) зв'язувальна електронна пара знаходиться в просторі між атомами молекули. Розрізняють полярний та неполярний ковалентний зв'язок.
Неполярний ковалентний зв'язок присутній в гомоядерних двоатомних молекулах, у яких зв'язувальна електронна пара рівновіддалена від обох ядер молекулярної системи (рис.2). Відстань d між атомними ядрами можна розглядати як суму ковалентних радіусів відповідних атомів.
Відстань між атомними ядрами в одинарному двохелектронному ковалентному зв'язку менша, ніж аналогічна відстань у найпростішому одноелектронному хімічному зв'язку.
| Молекула | H2 | Li2 | Na2 | K2 | Rb2 | Cs2 |
|---|---|---|---|---|---|---|
| Між’ядерна відстань, Å [2] | 0,74 | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
| Ковалентний радіус, Å | 0,37 | 1,335 | 1,54 | 1,96 | 2,05 | 2,15 |
| Орбітальний радіус, Å | 0,53 | 1,57 | 1,715 | 2,09 | 2,22 | 2,35 |
| Радіус зв'язувальної електронної пари, Å | 0,379 | 0,826 | 0,755 | 0,726 | 0,852 | 0,949 |
| Енергія розриву зв'язку, кДж/моль [2] | 436 | 102 | 73 | 57 | 49 | 42 |
Різниця між орбітальними і ковалентними радіусами характеризує ступінь перекриття атомних орбіталей атомів, що утворюють хімічний зв'язок, і відображає деформацію електронної оболонки атомів.
Полярний ковалентний зв'язок виникає в гетероядерних двоатомних молекулах (рис.3). Зв'язувальна електронна пара в полярному хімічному зв'язку наближена до атома з вищою електронегативністю.[3]
Відстань d між атомними ядрами, що характеризує просторову структуру полярних молекул, можна наближено розглядати як суму ковалентних радіусів відповідних атомів.[4]
| Молекула | LiH | NaH | KH | RbH | CsH |
|---|---|---|---|---|---|
| Між’ядерна відстань, Å | 1,60 | 1,89 | 2,24 | 2,37 | 2,49 |
| Енергія розриву зв'язку, кДж/моль | 236 | 200 | 182 | 165 | 176 |
Зсув зв'язувальної електронної пари до одного з ядер полярної молекули спричиняє появу електричного диполя (рис.4).
Відстань між центрами тяжіння позитивного і негативного зарядів називають довжиною диполя. Полярність молекули, як і полярність зв'язку, оцінюють величиною дипольного моменту μ, що являє собою добуток довжини диполя l на величину електронного заряду:
μ = lq
Кратні ковалентні зв'язки[ред. | ред. код]


Приклад кратних ковалентних зв'язків надають ненасичені органічні сполуки, зокрема, ненасичені вуглеводні: вони містять подвійний і потрійний хімічні зв'язки. Для опису природи зв'язків у ненасичених сполуках Л.Полінг ввів поняття сигма- і π-зв'язків, гібридизації атомних орбіталей.
Гібридизація Полінга для s - і p - електронів зняла протиріччя між просторовою спрямованістю p-орбіталей та просторовою будовою молекул. Вона дозволила певною мірою пояснити спрямованість хімічних зв'язків, зокрема тетраедричну конфігурацію молекули метану. Для пояснення структури етилену з чотирьох рівноцінних sp3-електронів атома вуглецю доводиться виокремлювати один p-електрон для утворення додаткового зв'язку, що отримав назву π-зв'язку. При цьому решта три sp2-гібридні орбіталі розташовуються в площині під кутом 120° і утворюють σ-зв'язки, наприклад, плоску молекулу етилену (рис.5).
У випадку молекули ацетилену в гібридизації беруть участь лише одна s - і одна p-орбіталь, при цьому утворюються дві sp-гібридні орбіталі, розташовані під кутом 180° і спрямовані в протилежні сторони. Дві «чисті» p-орбіталі атомів вуглецю попарно перекриваються у взаємноперпендикулярних площинах, утворюючи два π-зв'язки лінійної молекули ацетилену (рис.6).
Погляди Л. Полінга знайшли відображення в його книзі «Природа хімічного зв'язку»[5], яка на довгі роки стала настільною книгою хіміка. У 1954 році Л.Полінгу присуджено Нобелівську премію з хімії з формулюванням «За дослідження природи хімічного зв'язку і його застосування для визначення структури складних сполук».
Однак фізичний сенс вибіркової гібридизації атомних орбіталей залишався неясним, гібридизація являла собою алгебричні перетворення, яким не могла бути приписана фізична реальність.
Лайнус Полінг зробив спробу поліпшення опису хімічного зв'язку, виключивши вибірковість гібридизації орбіталей у молекулах ненасичених сполук і створивши теорію вигнутого ("бананового") хімічного зв'язку. У своїй доповіді на симпозіумі з теоретичної органічної хімії, присвяченій пам'яті Кекуле (Лондон, вересень 1958 року), Л.Полінг запропонував новий шлях опису подвійного зв'язку як комбінації двох однакових вигнутих хімічних зв'язків, а потрійного зв'язку — трьох вигнутих хімічних зв'язків[6]. На цьому симпозіумі Л.Полінг з усією категоричністю стверджував:
Можуть знайтися хіміки, які вважають, що надзвичайно важливим нововведенням… став опис σ,π- опису для подвійного або потрійного зв'язку та спряжених систем замість опису за допомогою вигнутих зв'язків. Я ж стверджую, що σ,π- опис менш задовільний, ніж опис за допомогою вигнутих зв'язків, що це нововведення є лише перехідним і незабаром відімре.[6]
Це одне з дуже небагатьох передбачень Л.Полінга, яке виявилося хибним. Класифікація зв'язків на σ-, π-, δ- спирається на симетрію, тобто має реальне фізичне підґрунтя і є сьогодні об'єктом стійкого наукового консенсусу. Ідея не знайшла ані розрахункового, ані експериментального підтвердження. Так, для молекули ацетилену модель "бананових зв'язків" передбачає наявність осі симетрії третього порядку, а модель двох π-зв'язків — осі четвертого порядку; жодна з цих картин не підтверджується високоточними квантово-хімічними розрахунками. Модель "бананових зв'язків" ґрунтується на, як згодом було з'ясовано, неприйнятному припущенні щодо локального характеру хімічного зв'язку. Найбільш змістовними є канонічні молекулярні орбіталі, отримувані в методі Гартрі — Фока, а вони симетричні й делокалізовані по всій системі (молекулі). Певні математичні процедури локалізації часто, але не завжди дозволяють перейти від канонічних до локалізованих орбіталей. Зокрема, локалізація неможлива у спряжених π-системах.
Чим більше зв'язувальних електронів, тим менша між'ядерна відстань і міцніший хімічний зв'язок між атомами вуглецю.
| Кратність зв'язку | Структура зв'язку | Між’ядерна відстань, Å | Енергія зв'язку, кДж/моль |
|---|---|---|---|
| Одинарний (C-C) | Двохелектронна двоцентрова | 1,54 | 348 |
| Подвійний (C=C) | Чотириелектронна двоцентрова | 1,34 | 614 |
| Потрійний (C≡C) | Шестиелектронна двоцентрова | 1,20 | 839 |
Трицентровий хімічний зв'язок[ред. | ред. код]
Подальший розвиток уявлень про хімічний зв'язок дав американський фізико-хімік В.Ліпском, який розробив теорію двохелектронних трицентрових зв'язків і топологічну теорію, що дозволяє передбачати будову ще деяких бороводнів (гідридів бору).
Електронна пара в трицентровому хімічному зв'язку усуспільнюється ядрами одразу трьох атомів. У найпростішого представника трицентрового хімічного зв'язку — молекулярного йона водню H+
3 одна електронна пара утримує в єдиному цілому три протони.
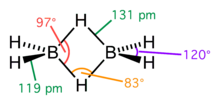
В молекулі диборану виділяють чотири одинарні ковалентні зв'язки B-H і два двохелектронні трицентрові зв'язки (рис.7). Між'ядерна відстань в одинарному ковалентному зв'язку B-H становить 1,19 Å, в той час як аналогічна відстань у трицентровому зв'язку B-H-B складає 1,31 Å. Кут трицентрового зв'язку B-H-B (φ) дорівнює 83°. Комбінація двох трицентрових зв'язків у молекулі диборану дозволяє утримувати ядра атомів бору на відстані dB-B = 2 · 1,31 · sin φ/2 = 1,736 Å. Ядра місткових атомів водню віддалені від площини, в якій розташовані чотири одинарні ковалентні зв'язки B-H, на відстань h = 1,31 · cos φ/2 = 0,981 Å.
Трицентрові зв'язки можуть реалізуватися не тільки в трикутнику з двох атомів бору та одного атома водню, але й між трьома атомами бору, наприклад у каркасних бороводнях (пентаборан — B
5H
9, декаборан — B
10H
14 тощо). В цих структурах є звичайні (кінцеві) і вхідні в трицентровий зв'язок (місткові) атоми водню і трикутники з атомів бору.[7]
Існування боранів з їхніми двоелектронними трицентровими зв'язками з «містковими» атомами водню порушувало канонічне вчення про валентність. Атом водню, який вважався раніше стандартним одновалентним елементом, виявився пов'язаним однаковими зв'язками з двома атомами бору і став формально двовалентним елементом. Роботи В. Ліпскома з розшифровки будови боранів розширювали уявлення про хімічний зв'язок. Нобелівський комітет нагородив Вільяма Нанна Ліпскома премією з хімії за 1976 рік з формулюванням "За дослідження структури боранів (боргідридів), що проясняють проблеми хімічних зв'язків".
Багатоцентровий хімічний зв'язок[ред. | ред. код]



У 1951 році Т. Кілі і П. Посон несподівано при синтезі дициклопентадієнілу отримали абсолютно нову залізоорганічну сполуку. Отримання невідомої раніше виключно стійкої жовто-оранжевої кристалічної сполуки заліза відразу привернуло до себе увагу.
Е. Фішер і Д. Вілкінсон незалежно один від одного встановили структуру нової сполуки — два кільця циклопентадієнілу розташовані паралельно, шарами, або у вигляді «сендвіча» з атомом заліза, розташованим між ними по центру (рис.8). Назву «фероцен» було запропоновано Р. Вудвордом (точніше, співробітником його групи Д. Вайтингом). У ній відображено наявність в молекулі сполуки атома заліза і десяти вуглецевих атомів (zehn — десять).[7]
Всі десять зв'язків (C-Fe) у молекулі фероцену рівноцінні, величина між'ядерної відстані Fe-C — 2,04 Å. Всі атоми вуглецю в молекулі фероцену структурно і хімічно еквівалентні, довжина кожного зв'язку C-C 1,40 — 1,41 Å (для порівняння, в бензолі довжина зв'язку C-C 1,39 Å). Навколо атома заліза виникає 36-електронна оболонка.[7]
У 1973 році Ернст Отто Фішер і Джефрі Вілкінсон отримали Нобелівську премію з хімії з формулюванням «За новаторську, проведену незалежно один від одного роботу, в галузі металоорганічних, так званих сандвічевих сполук». Інгвар Ліндквіст, член Шведської королівської академії наук, у своїй промові під час презентації лауреатів, заявив, що «відкриття і доведення нових принципів зв'язків і структур, наявних у сандвічевих сполуках[en], є значним досягненням, практичну значущість якого в даний час неможливо передбачити».
В наш час отримані дициклопентадієнильні похідні багатьох металів. Похідні перехідних металів мають таку саму структуру і природу, що й фероцен. Лантаноїди утворюють не сандвічеву структуру, а конструкцію, що нагадує трипроменеву зірку[7]. Отже, атоми La, Ce, Pr, Nd створюють п'ятнадцяти центровий хімічний зв'язок.
Незабаром слідом за фероценом був отриманий дибензолхром (рис.9). За тією ж схемою отримані дибензолмолібден і дибензолванадій[7]. У всіх сполуках цього класу атоми металу утримують в єдиному цілому два шестичленні ароматичні кільця. Всі 12 зв'язків метал-вуглець у цих сполуках ідентичні.
Синтезовано також ураноцен [біс(циклооктатетраен)уран], у якому атом урану утримує два восьмичленні кільця (рис.10). Всі 16 зв'язків уран-вуглець в ураноцені ідентичні. Ураноцен отримують взаємодією UCl4 з сумішшю циклооктатетраену і калію в тетрагідрофурані при мінус 30° C.[8]
Всі ці дані лише підкреслюють хибність припущення про локалізований характер хімічного зв'язку і обмеженість застосування моделей, які на це припущення спираються, — зокрема, моделі гібридизації.
Динаміка хімічного зв'язку[ред. | ред. код]
Хімічний зв'язок достатньо динамічний. Так, металевий зв'язок трансформується в ковалентний у процесі фазового переходу при випаровуванні металу. Перехід металу з твердого в пароподібний стан вимагає витрати великих кількостей енергії.[9]
| Метал | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Теплота сублімації (ккал/г-атом) | 36 | 26 | 22 | 21 | 19 |
У парах зазначені метали складаються практично з гомоядерних двоатомних молекул та вільних атомів. При конденсації пари металу ковалентний зв'язок перетворюється на металевий.
Випаровування солей з типово йонним зв'язком, наприклад фторидів лужних металів, призводить до руйнування йонного зв'язку та утворення гетероядерних двохатомних молекул з полярним ковалентним зв'язком. При цьому має місце утворення димеризованих молекул з містковими зв'язками.
Характеристика хімічного зв'язку в молекулах фторидів лужних металів та їх димерах.[2][10]
| EF | dEF, Å | μ D | Е2F2 | dEF, Å | <F-Е-F |
|---|---|---|---|---|---|
| LiF | 1,56 | 6,60 | Li2F2 | 1,75 | 105° |
| NaF | 1,93 | - | Na2F2 | 2,08 | 95° |
| KF | 2,17 | 7,37 | K2F2 | 2,35 | 88° |
| RbF | 2,27 | - | Rb2F2 | 2,45 | 84° |
| CsF | 2,35 | 7,88 | Cs2F2 | 2,56 | 79° |
При конденсації пари фторидів лужних металів полярний ковалентний зв'язок трансформується в йонний з утворенням відповідної кристалічної ґратки солі.
Механізм переходу ковалентного зв'язку в металічний[ред. | ред. код]



Дисперсійне притягання (сили Лондона) зумовлює міжатомну взаємодію і утворення гомоядерних двоатомних молекул з атомів лужних металів.
Утворення ковалентного зв'язку метал-метал пов'язане з деформацією електронних оболонок атомів, що взаємодіють, — валентні електрони утворюють зв'язувальну електронну пару, електронна густина якої концентрується в просторі між атомними ядрами молекули, що виникла. Характерною особливістю гомоядерних двохатомних молекул лужних металів є велика довжина зв'язку (в 3,6-5,8 рази більше від довжини зв'язку в молекулі водню) і низька енергія його розриву.
В теорії відштовхування електронних пар вважається важливим співвідношення між радіусом орбіталі електронної пари re і довжиною ковалентного хімічного зв'язку d (рис.11). Для елементів кожного періоду таблиці Д. В. Менделєєва існує певний радіус електронної пари (Е):
— 0,6 для елементів аж до неону;
— 0,75 для елементів аж до аргону;
— 0,75 для елементів аж до криптону;
— 0,8 для елементів аж до ксенону[11]
Зазначене співвідношення між re і d визначає нерівномірність розподілу електричних зарядів у молекулі — в середній частині молекули зосереджено негативний електричний заряд зв'язувальної електронної пари, а на кінцях молекули — позитивні електричні заряди двох атомних кістяків.
Нерівномірність розподілу електричних зарядів створює умови взаємодії молекул за рахунок сил Ван дер Ваальса, а саме квадрупольної та дисперсійної взаємодії. Молекули лужних металів прагнуть орієнтуватися таким чином, щоб по сусідству виявлялися різнойменні електричні заряди. В результаті між молекулами виникають сили притягання. Завдяки наявності останніх, молекули лужних металів зближуються і більш менш міцно стягуються між собою. Одночасно відбувається певка деформація кожної з них під дією ближче розташованих полюсів сусідніх молекул (рис.12).
Фактично, зв'язувальні електрони початкової двохатомної молекули, потрапляючи в електричне поле чотирьох позитивно заряджених атомних кістяків молекул лужних металів, відриваються з орбітального радіуса атома і стають вільними.
При цьому зв'язувальна електронна пара стає спільною вже для системи з шістьма катіонами. Починається побудова кристалічної ґратки металу на етапі кластера. У кристалічній ґратці лужних металів чітко виражена структура зв'язувальної ланки, що має форму спотвореного сплющеного октаедра — квадратної біпіраміди, висота якої і ребра основи рівні величині сталої трансляційної ґратки aw (рис.13).
Величина сталої трансляційної ґратки aw кристала лужного металу значно перевищує довжину ковалентного зв'язку молекули лужного металу, тому прийнято вважати, що електрони в металі знаходяться у вільному стані:
| Лужний метал | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Стала ґратки aw,Å [12] | 3,5021 | 4,2820 | 5,247 | 5,69 | 6,084 |
| Довжина ковалентного зв'язку, Me2, Å[13] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Наближений опис електронної будови кристалу метала надає модель вільних електронів. В теорії кристалів важливу роль відіграє поняття поверхні Фермі.[14].

При зіставленні процесу конденсації пари лужних металів з процесом конденсації газів, наприклад, водню, проявляється характерна особливість у властивостях металу. Так, якщо під час конденсації водню проявляються слабкі міжмолекулярні взаємодії, то при конденсації пари металу протікають процеси, характерні для хімічних реакцій. Сама конденсація пари металу йде у кілька стадій і може бути описана такою процесією: вільний атом → двохатомна молекула з ковалентним зв'язком → металічний кластер → компактний метал з металічним зв'язком.
У 1935 році Юджин Вігнер і Гіллард Гантінгтон[en] передбачили можливість існування і металічного водню. Дійсно, ковалентний зв'язок, властивий молекулярному водню, переходить у металевий зв'язок. Цей перехід спостерігається для твердого водню при надвисокому тиску (рис.14).
Механізм переходу ковалентного зв'язку в іонний[ред. | ред. код]

Перехід ковалентного зв'язку в іонний спостерігається для гетероядерних двохатомних молекул з полярним ковалентним зв'язком, наприклад, галогенідів лужних металів при переході з газоподібного у твердий стан.
Атоми лужних металів при утворенні відповідного галогеніду втрачають свій єдиний зовнішній електрон і набувають позитивного електричного заряду. Негативний електричний заряд фіксується на атомі галогену. Молекули галогенідів лужних металів фактично є електричними диполями.
| ЕХ | Довжина хімічного зв'язку, Å | |||
|---|---|---|---|---|
| EF | ECl | ЕВг | ЕІ | |
| LiX | 1,56 | 2,02 | 2,17 | 2,39 |
| NaX | 1,93 | 2,36 | 2,50 | 2,71 |
| KX | 2,17 | 2,67 | 2,82 | 3,05 |
| RbX | 2,27 | 2,79 | 2,95 | 3,18 |
| CsX | 2,35 | 2,91 | 3,07 | 3,32 |
Розподіл силових ліній електричного диполя полярного ковалентного зв'язку наведено на рис.4. При досить близьких відстанях силові лінії взаємно орієнтують полярні молекули — однойменно заряджені кінці (полюси) їхніх диполів взаємно відштовхуються, а різнойменно заряджені притягуються. Як наслідок між молекулами діють сили притягання, зумовлені взаємодією їхніх постійних диполів, які мають назву орієнтаційних сил.
Взаємодія молекул галогенідів лужних металів супроводжується їх димеризацією. Димерну молекулу можна розглядати як електричний квадруполь (рис.15). У цей час відомі основні характеристики димерів галогенідів лужних металів (довжини хімічного зв'язку і валентні кути між зв'язками).[10]
| Е2X2 | X=F | X=Cl | X=Br | X=I | ||||
|---|---|---|---|---|---|---|---|---|
| dEF, Å | <F-Е-F,° | dECl, Å | <Cl-Е-Cl,° | dЕВг, Å | <Br-Е-Br, ° | dЕІ, Å | <I-Е-I, ° | |
| Li2X2 | 1,75 | 105 | 2,23 | 108 | 2,35 | 110 | 2,54 | 116 |
| Na2X2 | 2,08 | 95 | 2,54 | 105 | 2,69 | 108 | 2,91 | 111 |
| K2X2 | 2,35 | 88 | 2,86 | 98 | 3,02 | 101 | 3,26 | 104 |
| Cs2X2 | 2,56 | 79 | 3,11 | 91 | 3,29 | 94 | 3,54 | 94 |
В процесі конденсації дія орієнтаційних сил посилюється, міжмолекулярна взаємодія супроводжується утворенням кластерів, а потім і твердої речовини. Галогеніди лужних металів утворюють кристали з простою кубічною та об'ємно-центрованою кубічною ґраткою.
Тип кристалічної ґратки і постійна трансляційної решітки для галогенідів лужних металів.[12]
| Сполука і тип кристалічної ґратки | Стала ґратки, Å | ||||
|---|---|---|---|---|---|
| Li | Na | K | Rb | Cs | |
| фториди (куб) | 4,0279 | 4,628 | 5,344 | 5,64 | 6,020 |
| хлориди (куб) | 5,1399 | 5,639 | 6,21 | - | - |
| хлориди (ОЦК) | - | - | - | 3,749 | 4,10 |
| броміди (куб) | 5,501 | 5,973 | 6,599 | 6,868 | 7,23 |
| броміди (ОЦК) | - | - | - | - | 4,296 |
| йодиди (куб) | 6,012 | 6,475 | 7,066 | 7,340 | 7,66 |
| йодиди (ОЦК) | - | - | - | - | 4,567 |
У процесі кристалізації відбувається подальше збільшення міжатомної відстані, що призводить до зриву електрона з орбітального радіуса атома лужного металу і передачі електрона атому галогену з утворенням відповідних іонів. Силові поля іонів рівномірно розподіляються по всіх напрямках у просторі. У зв'язку з цим у кристалах лужних металів силове поле кожного іона координує не один іон протилежного знаку, як прийнято якісно подавати йонний зв'язок (Na+Cl-), а більше (6 чи 8).
У кристалах іонних сполук поняття простих двохіонних молекул типу Na+Cl− та Cs+Cl− втрачає сенс, оскільки йон лужного металу пов'язаний (координований) з шістьма йонами хлору (в кристалі хлористого натрію) і з вісьмома йонами хлору (в кристалі хлористого цезію). При цьому всі міжіонні відстані в кристалах однакові. Весь іонний кристал являє собою гігантську молекулу.
Примітки[ред. | ред. код]
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М. : «Химия», 1987. — С. 124. — 320 с.
- ↑ а б в г д Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М. : «Химия», 1987. — С. 132-136. — 320 с.
- ↑ Ганкин В.Ю., Ганкин Ю.В. Как образуется химическая связь и протекают химические реакции. — М. : издат.группа "Граница", 2007. — 320 с. — ISBN 978-5-94691296-9.
- ↑ Некрасов Б. В. Курс общей химии. — М. : Госхимиздат, 1962. — С. 88. — 976 с.
- ↑ Паулинг Л. Природа химической связи / под редакцией Я.К.Сыркина. — пер. с англ. М.Е.Дяткиной. — М.-Л. : Госхимиздат, 1947. — 440 с.
- ↑ а б Теоретическая органическая химия / под ред. Р.Х.Фрейдлиной. — пер. с англ. Ю.Г.Бунделя. — М. : Изд. иностранной литературы, 1963. — 365 с.
- ↑ а б в г д Леменовский Д.А., Левицкий М.М. Российский химический журнал (журнал Российского химического общества им. Д.И.Менделеева). — 2000. — Т. XLIV, вып.6. — С. 63-86.
- ↑ Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — С. 607. — 792 с.
- ↑ Некрасов Б. В. Курс общей химии. — М. : Госхимиздат, 1962. — С. 679. — 976 с.
- ↑ а б в Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М. : «Химия», 1987. — С. 155-161. — 320 с.
- ↑ Гиллеспи Р. Геометрия молекул / пер. с англ. Е.З. Засорина и В.С. Мастрюкова, под ред. Ю.А Пентина. — М. : «Мир», 1975. — С. 49. — 278 с.
- ↑ а б Справочник химика. — 2-е изд., перераб. и доп. — Л.-М. : ГНТИ Химической литературы, 1962. — Т. 1. — С. 402-513. — 1072 с.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ.. — М. : «Химия», 1987. — С. 132—136. — 320 с.
- ↑ Зиман Дж. Электроны в металлах (введение в теорию поверхностей Ферми). Успехи физических наук.. — 1962. — Т. 78, вып.2. — 291 с.
Див. також[ред. | ред. код]
Література[ред. | ред. код]
- Химическая связь // Химическая энциклопедия : в 5 т. / гл. ред. Н. С. Зефиров. — М. : Большая Рос. энцикл., 1998. — Т. 5 : Триптофан — Ятрохимия. — Стб. 460. — Библиогр. в конце ст. — ISBN 5-85270-310-9.(рос.)
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Ч. Коулсон. Валентность / Пер. с англ. под ред. Соколова Н. Д. — М.: Мир, 1965. — 426 с. (рос.)
- Маррел Дж., Кеттл С., Теддер Дж. Химическая связь [Архівовано 24 квітня 2019 у Wayback Machine.]. М.: Мир, 1980. 384 с.
- Пиментел Г., Спратли Р. Как квантовая механика объясняет химическую связь. Пер. с англ. М.: Мир, 1973. 332 с.
- Рюденберг К. Физическая природа химической связи. М.: Мир, 1964. 164 c.
- Бердетт Дж. Химическая связь. М.: Бином. Лаборатория знаний, 2008. 248 с. ISBN 978-5-94774-760-7, ISBN 978-5-03-003847-6, ISBN 0-471-97129-4
- Яцимирский К. Б., Яцимирский В. К. Химическая связь. Киев: Вища школа, 1975. 304 c.
- Краснов К. С. Молекулы и химическая связь. 2-ое изд. М: Высшая школа, 1984. 295 с.
- Татевский В. М.[ru] Строение молекул. М.: Химия, 1977. 512 с (Глава VIII. «Проблема химической связи в квантовой механике»)
- Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. 162 с. (§§ 30-31)
- Бейдер Р.[ru] Атомы в молекулах. Квантовая теория. М.: Мир, 2001. 532 c. ISBN 5-03-003363-7 Глава 7. Модели химической связи.
Посилання[ред. | ред. код]
- Ю. В. Зефиров, П. М. Зоркий, Ван-дер-ваальсовы радиусы атомов в кристаллохимии и структурной химии [Архівовано 26 квітня 2019 у Wayback Machine.]
- Н. Ф. Степанов, Химическая связь в простых двухатомных молекулах [Архівовано 24 квітня 2019 у Wayback Machine.] СОЖ, 1998.
| |||||||||||||||||||||||||||||