Т-клітина пам'яті
Т-клітини пам'яті — це підгрупа Т-лімфоцитів, які можуть виконувати ті ж функції, що й В-клітини пам'яті. Їхнє походження незрозуміло.
Функція
Антиген-специфічні Т-клітини пам’яті, специфічні до вірусів або інших мікробних молекул, можна знайти як у TCM, так і в TEM cубпопуляціях. Хоча більшість інформації в даний час базується на спостереженнях за цитотоксичними Т-клітинами (CD8-позитивними), схожі популяції існують і для Т-хелперів (CD4-позитивних). Основною функцією клітин пам’яті є посилення імунної відповіді після реактивації цих клітин шляхом повторного введення відповідного патогена в організм. Важливо зазначити, що ця галузь інтенсивно вивчається, і деяка інформація може бути не представлена в цій статті.
- TCM: ТСМ-лімфоцити мають декілька спільних ознак зі стовбуровими клітинами, найважливішою з яких є здатність до самовідновлення, головним чином через високий рівень фосфорилювання на ключовому факторі транскрипції, STAT5 . У кілької мишачих моделях виявилося, що TCM надають більш потужний імунітет проти вірусів, бактерій[1] і ракових клітин[2] порівняно з TEM лімфоцитами.
- TEM: Лімфоцити TEM і TEMRA в основному активні як CD8 варіанти, тому в основному відповідальні за цитотоксичну дію проти патогенів.[3]
- ТRМ: Оскільки лімфоцити TRM присутні протягом тривалого часу в тканинах, або, що ще важливіше, в бар’єрних тканинах (наприклад, епітелії), вони мають вирішальне значення для швидкої реакції на порушення бар’єру та відповіді на будь-який наявний патоген. Одним з механізмів, використовуваних TRM для обмеження патогенів, є секреція гранзиму B.[4] [5]
- TSCM: Ці лімфоцити здатні до самовідновлення, як і лімфоцити TCM, а також здатні генерувати субпопуляції як TCM, так і TEM.[6] Наявність цієї популяції у людей наразі досліджується.
- ТVM: На даний момент єдиною функцією, очевидною для клітин TVM, є секреція різних цитокінів [7] [8], але є припущення щодо їх впливу на подолання небажаних імунологічних станів та їх використання для лікування аутоімунних захворювань.[9]
Підтримка гомеостазу
Клони Т-клітин пам’яті, які експресують специфічний Т-клітинний рецептор, можуть зберігатися в нашому організмі десятиліттями. Оскільки Т-клітини пам’яті мають менший період напіврозпаду, ніж наївні Т-клітини, безперервна реплікація та заміна старих клітин, ймовірно, беруть участь у процесі підтримки їх популяції.[3] Наразі механізм підтримки Т-клітин пам’яті до кінця не вивчений. Активація через Т-клітинний рецептор може відігравати певну роль.[3] Встановлено, що Т-клітини пам’яті іноді можуть реагувати на нові антигени, що, можливо, забезпечується внутрішньою різноманітністю та широтою мішеней, що зв’язуються з Т-клітинним рецептором.[3] Ці Т-клітини можуть перехресно реагувати на антигени навколишнього середовища та антигени в нашому тілі (наприклад, бактерії в нашому кишечнику) і розмножуватися. Це допомогає зберегти популяцію Т-клітин пам’яті.[3] Механізм перехресної реактивності може бути важливим для Т-клітин пам’яті в тканинах слизової оболонки, оскільки ці ділянки мають вищу щільність антигену.[3] Для тих Т-клітин пам'яті, які циркулюють в крові, кістковому мозку, лімфоїдних тканинах і селезінці, передача сигналів гомеостатичних цитокінів (включаючи IL-17 і IL-15 ) або головного комплексу гістосумісності II (MHCII) може бути більш важливою. [3]
Життєвий цикл
Т-клітини пам’яті зазнають різних змін і відіграють різну роль на різних етапах життя людини. При народженні людини та в ранньому дитинстві Т-клітини периферичної крові є переважно неактивними (наївними).[10] Через постійний вплив антигенів популяція Т-клітин пам’яті збільшується. Це етап генерації імунної пам’яті, який триває від народження до 20-25 років, коли наша імунна система стикається з найбільшою кількістю нових антигенів.[3] [10] Під час наступного етапу гомеостазу кількість Т-клітин пам’яті виходить на плато і стабілізується.[10] На цьому етапі імунна відповідь більше зміщується в бік підтримки гомеостазу, оскільки нових антигенів зустрічається небагато.[10] На цій стадії також стає важливим спостереження за появою пухлин.[10] На більш пізніх етапах життя, приблизно у 65-70 років, настає стадія імуностаріння, на якій спостерігається імунна дисрегуляція, зниження функціональності Т-клітин і підвищена уразливість до патогенів.[3] [10]
Походження
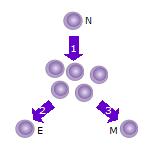
1. Після того, як наївна Т-клітина (N) зустрічається з антигеном, вона активується і починає проліферувати (ділитися) на багато клонів або дочірніх клітин.
2. Деякі з клонів Т-клітин диференціюються в ефекторні Т-клітини (Е), які виконуватимуть свою функцію (наприклад, вироблятимуть цитокіни як Т-хелпери або знищуватимуть клітини якцитотоксичні Т-клітини). 3. Деякі з клітин утворять Т-клітини пам’яті (М), які житимуть у неактивному стані в організмі протягом тривалого періоду часу, доки вони знову не зустрінуть той самий антиген і не активуються.
Станом на квітень 2020 року зв’язок між ефекторними і Т-клітинами пам’яті був неясний.[11] [12] [13] Існують дві конкуруючі моделі. Одна з них називається моделлю On-Off-On.[12] Коли наївні Т-клітини активуються Т-клітинним рецептором (TCR), що зв’язується з антигеном запускається його сигнальний шлях, вони активно проліферують і утворюють великий клон ефекторних клітин. Ефекторні клітини активно секретують цитокіни та виконують інші дії.[11] Після видалення антигену деякі з цих ефекторних клітин утворюють Т-клітини пам’яті або випадковим чином, або відбираються на основі їхньої високої специфічності.[11] Ці клітини повертаються з активного ефекторного до стану, більш схожого на наївні Т-клітини («вимикаються»), і знову «вмикаються» під час наступного контакту з антигеном.[13] Ця модель передбачає, що ефекторні Т-клітини можуть ставати Т-клітинами пам’яті і виживати, зберігаючи здатність до проліферації.[11] Вона також передбачає, що схемі On-Off-On під час наївної, ефекторної та пам’ятної стадій буде відповідати певний профіль експресії генів.[13] Докази, що підтверджують цю модель, включають виявлення генів, які відповідають схемі експресії On-Off-On, включаючи альфа-рецептор інтерлейкіну-7 (IL-7Rα), Bcl-2, CD26L та інші.[13]

У цій моделі Т-клітини пам’яті перетворюються на ефекторні Т-клітини, а не навпаки.
Інша модель — це модель розвиткової диференціації.[12] Ця модель стверджує, що ефекторні клітини, утворені з високоактивованих наївних Т-клітин, після видалення антигену піддаються апоптозу.[11] Натомість Т-клітини пам’яті походять від наївних Т-клітин, які активуються, але ніколи не входять повною мірою в ефекторну стадію.[11] Потомство Т-клітин пам’яті не повністю активовано, оскільки вони не настільки специфічні до антигену, як ефекторні Т-клітини. Дослідження, присвячені перебігу поділу клітин, показали, що довжина теломери та активність теломерази в ефекторних Т-клітинах були зменшені в порівнянні з Т-клітинами пам’яті, що свідчить про те, що Т-клітини пам’яті не зазнавали такого поділу клітин, як ефекторні Т-клітини, що не узгоджується з модель On-Off-On.[11] Повторна або хронічна антигенна стимуляція Т-клітин, як-от при ВІЛ-інфекції, спричиняє посилення ефекторних функцій, але зменшує силу імунної пам’яті.[12] Було також виявлено, що Т-клітини, що розмножуються, з більшою ймовірністю створюють короткоживучі ефекторні клітини, тоді як Т-клітини з мінімальною проліферацією утворюють більше довгоживучих клітин. [11]
Епігенетичні модифікації
Епігенетичні модифікації беруть участь у зміні наївних Т-клітин.[14] Наприклад, у CD4+ Т-клітинах пам’яті позитивні модифікації гістонів відзначаються у генах ключових цитокінів, які активуються під час вторинної імунної відповіді, включаючи IFNγ, IL4 та IL17A.[14] Деякі з цих модифікацій зберігалися після видалення антигену, створюючи епігенетичну пам’ять, що дозволяє швидше активуватися при повторній зустрічі з антигеном.[14] Для CD8+ Т-клітин пам’яті певні ефекторні гени, такі як IFNγ, не експресуються, але вони транскрипційно готові для швидкої експресії після активації.[14] Крім того, посилення експресії певних генів також залежить від сили початкової активації Т-клітинних рецепторів для перетворення на Т-клітини пам’яті, що корелює з активацією регуляторного елемента, який безпосередньо змінює рівень експресії гена.[14]
Субпопуляції
Історично вважалося, що Т-клітини пам’яті поділяються на ефекторну або центральну субпопуляції, кожна з яких має свій власний набір маркерів клітинної поверхні (див. нижче).[15] Згодом були виявлені численні додаткові популяції Т-клітин пам'яті, включаючи тканинні Т-клітини (ТRM), стовбурові Т-клітини пам'яті (ТSCM), і Т-клітини віртуальної пам'яті (TVM). Єдина об’єднуюча ознака для всіх субпопуляцій Т-клітин пам'яті полягає в тому, що вони довгоживучі і можуть швидко перетворюватись на велику кількість ефекторних Т-клітин при повторному контакті зі спорідненим з ними антигеном. Завдяки цьому механізму вони забезпечують імунну систему «пам’яттю» проти патогенів, зустрічалися раніше. Т-клітини пам'яті можуть бути або CD4+, або CD8+ і зазвичай експресують CD45RO і в той же час не мають CD45RA.[16]
Субпопуляції Т-клітин пам’яті
- Центральні Т-клітини пам'яті (ТСМ) експресують CD45RO, CC-хемокіновий рецептор типу 7 (CCR7) і L-селектин (CD62L). Центральні Т-клітини пам'яті також мають CD44від середнього до високого рівня експресії. Ця субпопуляція зазвичай зустрічається в лімфатичних вузлах і в периферійному кровообігу.
- Ефекторні Т-клітини пам'яті (ТЕМ) експресують CD45RO, але не мають експресії CCR7 та L-селектину . Вони також мають середню та високу експресію CD44 . Оскільки у цих Т-клітин пам’яті відсутні рецептори CCR7, які дозволяють оселятися у лімфатичних вузлах, вони знаходяться в периферійному кровообігу та тканинах.[17] TEMRA означає термінально диференційовані ефекторні клітини пам’яті, які повторно експресують CD45RA, що є маркером, який зазвичай зустрічається на наївних Т-клітинах. [18]
- Тканинні Т-клітини пам’яті (TRM) перебувають у тканинах (шкіра, легені, шлунково-кишковий тракт тощо) без рециркуляції в інші ділянки. Деякі маркери клітинної поверхні, пов’язані з TRM, — це CD69 та інтегрин αeβ7 (CD103).[19] Однак варто зазначити, що клітини TRM, знайдені в різних тканинах, експресують різні набори маркерів клітинної поверхні.[19] Якщо виявлено, що клітини CD103+ TRM обмежено локалізовані в епітеліальних і нейронних тканинах, клітини TRM, локалізовані в слинних залозах, підшлунковій залозі та жіночих репродуктивних шляхах, у мишей не експресують ні CD69, ні CD103.[19] [20] Вважається, що клітини TRM відіграють головну роль у захисному імунітеті проти патогенів.[5] [21] Дослідження також припускають подвійну роль клітин TRM у захисті та регуляції.[10] Порівняно з ТЕМ-клітинами, ТRМ- клітини секретують більше цитокінів, пов’язаних із захисним імунітетом, і експресують менше проліфераційного маркера Ki67.[10] Було припущено, що ці характеристики можуть допомогти у довгостроковій підтримці популяції клітин ТRM, а також у дотриманні балансу між швидкою реакцією на інвазію антигену та уникненням непотрібного пошкодження тканин.[10] Дисфункціональні клітини TRM можуть бути причетні до аутоімунних захворювань, таких як псоріаз, ревматоїдний артрит, хвороба запаленого кишечника.[21] Специфічними для лімфоцитів TRM є гени, які беруть участь у метаболізмі ліпідів, які є високоактивними, приблизно в 20-30 разів активнішими, ніж в інших типах Т-клітин.[21]
- Т-клітини віртуальної пам'яті (TVM) відрізняються від інших субпопуляцій клітин пам’яті тим, що вони не виникають внаслідок масованого клонування. Таким чином, хоча ця популяція в цілому є поширеною в периферійному кровообігу, окремі клони TVM зустрічаються з відносно малою частотою. Одна з теорій полягає в тому, що до появи цієї популяції Т-клітин призводить гомеостатична проліферація. Хоча першими були описані CD8 TVM [22], тепер відомо, що існують також CD4 TVM.[23]
Було запропоновано поділ на багато інших субпопуляцій Т-клітин пам’яті. Дослідники вивчили стовбурові Т-клітини пам'яті (TSCM). Як і наївні Т-клітини, TSCM є CD45RO-, CCR7+, CD45RA+, CD62L+ (L-селектин), CD27+, CD28+ і IL-7Rα+, але вони також експресують велику кількість CD95, IL-2Rβ, CXCR3 і LFA-1, і проявляють численні функціональні атрибути, відмінні від клітин пам'яті.[6]
Посилання
- ↑ Wherry EJ, Teichgräber V, Becker TC, Masopust D, Kaech SM, Antia R та ін. (March 2003). Lineage relationship and protective immunity of memory CD8 T cell subsets. Nature Immunology. 4 (3): 225—34. doi:10.1038/ni889. PMID 12563257.
- ↑ Klebanoff CA, Gattinoni L, Torabi-Parizi P, Kerstann K, Cardones AR, Finkelstein SE та ін. (July 2005). Central memory self/tumor-reactive CD8+ T cells confer superior antitumor immunity compared with effector memory T cells. Proceedings of the National Academy of Sciences of the United States of America. 102 (27): 9571—6. Bibcode:2005PNAS..102.9571K. doi:10.1073/pnas.0503726102. PMC 1172264. PMID 15980149.
- ↑ а б в г д е ж и к Farber DL, Yudanin NA, Restifo NP (January 2014). Human memory T cells: generation, compartmentalization and homeostasis. Nature Reviews. Immunology. 14 (1): 24—35. doi:10.1038/nri3567. PMC 4032067. PMID 24336101.
- ↑ Gebhardt T, Wakim LM, Eidsmo L, Reading PC, Heath WR, Carbone FR (May 2009). Memory T cells in nonlymphoid tissue that provide enhanced local immunity during infection with herpes simplex virus. Nature Immunology. 10 (5): 524—30. doi:10.1038/ni.1718. PMID 19305395.
- ↑ а б Shin H, Iwasaki A (September 2013). Tissue-resident memory T cells. Immunological Reviews. 255 (1): 165—81. doi:10.1111/imr.12087. PMC 3748618. PMID 23947354.
- ↑ а б Gattinoni L, Lugli E, Ji Y, Pos Z, Paulos CM, Quigley MF та ін. (September 2011). A human memory T cell subset with stem cell-like properties. Nature Medicine. 17 (10): 1290—7. doi:10.1038/nm.2446. PMC 3192229. PMID 21926977.
- ↑ White JT, Cross EW, Kedl RM (June 2017). + T cells: where they come from and why we need them. Nature Reviews. Immunology. 17 (6): 391—400. doi:10.1038/nri.2017.34. PMC 5569888. PMID 28480897.
- ↑ Lee JY, Hamilton SE, Akue AD, Hogquist KA, Jameson SC (August 2013). Virtual memory CD8 T cells display unique functional properties. Proceedings of the National Academy of Sciences of the United States of America. 110 (33): 13498—503. Bibcode:2013PNAS..11013498L. doi:10.1073/pnas.1307572110. PMC 3746847. PMID 23898211.
- ↑ Drobek A, Moudra A, Mueller D, Huranova M, Horkova V, Pribikova M та ін. (July 2018). Strong homeostatic TCR signals induce formation of self-tolerant virtual memory CD8 T cells. The EMBO Journal. 37 (14). doi:10.15252/embj.201798518. PMC 6043851. PMID 29752423.
- ↑ а б в г д е ж и к Kumar BV, Connors TJ, Farber DL (February 2018). Human T Cell Development, Localization, and Function throughout Life. Immunity. 48 (2): 202—213. doi:10.1016/j.immuni.2018.01.007. PMC 5826622. PMID 29466753.
- ↑ а б в г д е ж и Restifo NP, Gattinoni L (October 2013). Lineage relationship of effector and memory T cells. Current Opinion in Immunology. Special section: Systems biology and bioinformatics / Immunogenetics and transplantation. 25 (5): 556—63. doi:10.1016/j.coi.2013.09.003. PMC 3858177. PMID 24148236.
- ↑ а б в г Henning AN, Roychoudhuri R, Restifo NP (May 2018). + T cell differentiation. Nature Reviews. Immunology. 18 (5): 340—356. doi:10.1038/nri.2017.146. PMC 6327307. PMID 29379213.
- ↑ а б в г Youngblood B, Hale JS, Ahmed R (July 2013). T-cell memory differentiation: insights from transcriptional signatures and epigenetics. Immunology. 139 (3): 277—84. doi:10.1111/imm.12074. PMC 3701173. PMID 23347146.
- ↑ а б в г д Schmidl C, Delacher M, Huehn J, Feuerer M (September 2018). Epigenetic mechanisms regulating T-cell responses. The Journal of Allergy and Clinical Immunology. 142 (3): 728—743. doi:10.1016/j.jaci.2018.07.014. PMID 30195378.
- ↑ Sallusto F, Lenig D, Förster R, Lipp M, Lanzavecchia A (October 1999). Two subsets of memory T lymphocytes with distinct homing potentials and effector functions. Nature. 401 (6754): 708—12. Bibcode:1999Natur.401..708S. doi:10.1038/44385. PMID 10537110.
- ↑ Akbar AN, Terry L, Timms A, Beverley PC, Janossy G (April 1988). Loss of CD45R and gain of UCHL1 reactivity is a feature of primed T cells. Journal of Immunology. 140 (7): 2171—8. PMID 2965180.
- ↑ Willinger T, Freeman T, Hasegawa H, McMichael AJ, Callan MF (November 2005). Molecular signatures distinguish human central memory from effector memory CD8 T cell subsets. Journal of Immunology. 175 (9): 5895—903. doi:10.4049/jimmunol.175.9.5895. PMID 16237082.
- ↑ Koch S, Larbi A, Derhovanessian E, Ozcelik D, Naumova E, Pawelec G (July 2008). Multiparameter flow cytometric analysis of CD4 and CD8 T cell subsets in young and old people. Immunity & Ageing. 5 (6): 6. doi:10.1186/1742-4933-5-6. PMC 2515281. PMID 18657274.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в Mueller SN, Mackay LK (February 2016). Tissue-resident memory T cells: local specialists in immune defence. Nature Reviews. Immunology. 16 (2): 79—89. doi:10.1038/nri.2015.3. PMID 26688350.
- ↑ Steinert EM, Schenkel JM, Fraser KA, Beura LK, Manlove LS, Igyártó BZ та ін. (May 2015). Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4): 737—49. doi:10.1016/j.cell.2015.03.031. PMC 4426972. PMID 25957682.
- ↑ а б в Study highlights possible Achilles' heel in key immune memory cells.
- ↑ Lee YJ, Jameson SC, Hogquist KA (February 2011). Alternative memory in the CD8 T cell lineage. Trends in Immunology. 32 (2): 50—6. doi:10.1016/j.it.2010.12.004. PMC 3039080. PMID 21288770.
- ↑ Marusina AI, Ono Y, Merleev AA, Shimoda M, Ogawa H, Wang EA та ін. (February 2017). + virtual memory: Antigen-inexperienced T cells reside in the naïve, regulatory, and memory T cell compartments at similar frequencies, implications for autoimmunity. Journal of Autoimmunity. 77: 76—88. doi:10.1016/j.jaut.2016.11.001. PMC 6066671. PMID 27894837.