Подвійний електричний шар

Подві́йний електри́чний шар (ПЕШ), (рос. двойной электрический слой (ДЭС), англ. double electric layer; нім. elektrische Doppelschicht f) — тонкий шар на межі двох фаз із просторово розділених електричних зарядів протилежного знаку. Оскільки просторовий розподіл зарядів завжди супроводжується виникненням електричної різниці потенціалів, ПЕШ можна розглядати, як своєрідний мікроконденсатор, відстань між обкладками якого визначається молекулярними розмірами.
Утворення ПЕШ суттєво впливає на швидкість електродних процесів, стійкість дисперсних систем, змочуваність тіл, адсорбцію, коефіцієнт тертя на межі двох фаз та інші властивості міжфазної границі і відповідно, процеси, які пов'язані з міжфазними ефектами: флотацію, брикетування зі зв'язуючим, аґломерацію, зневоднення, седиментацію, фільтрацію тощо.
В біологічних системах процеси утворення і руйнування ПЕШ на клітинних мембранах супроводжують розповсюдження електричних імпульсів вздовж нервових і м'язових волокон.
В основі теорії ПЕШ лежить термодинамічний підхід, теорія Гуї-Чепмена (англ. Gouy-Chapman theory) і уявлення про адсорбцію на поверхні метал-електроліт.
У випадку ліозолів ПЕШ складається з йонів одного знаку, які міцно зв'язані з дисперсною фазою (потенціалвизначальні йони), і еквівалентної кількості протилежно заряджених йонів, які знаходяться у рідкому дисперсійному середовищі біля міжфазної поверхні (протийони). Заряд на поверхні твердої фази розглядається як поверхневий заряд. Структура шару протийонів згідно з теорією Гуї-Чепмена складається з двох шарів — щільного і дифузного. Наявність останнього пояснюється тепловим рухом молекул. Крива електричного потенціалу у приповерхневій зоні має крутішу ділянку — де більше компенсаційних протийонів і менш круту — де їх менше. Дифузна частина ПЕШ відривається при рухові рідини або твердої частинки. При цьому потенціал дифузної частини ПЕШ приймають рівним дзета-потенціалу (див. електрокінетичний потенціал).
ПЕШ виникає внаслідок:
- Обміну йонів між металом і розчином
- Специфічної адсорбції йонів на поверхні електрода
- Адсорбції поверхнево-активних речовин, тобто орієнтованої адсорбції полярних молекул біля межі поділу фаз.
При зануренні металевого електрода в розчин електроліту між металом і розчином виникає ПЕШ, а на межі розподілу фаз виникає стрибок потенціалу.
Якщо хімічний потенціал катіонів металу в розчині менше, ніж в електроді μр < μе, то ці катіони залишають електрод, і надлишок негативного заряду на поверхні електрода притягує до поверхні металу позитивні йони. Таким чином вздовж поверхні електрода утворюється ПЕШ.
Навпаки, якщо хімічний потенціал катіонів в розчині більше, ніж в електрода μр > μе, то катіони виділяються з розчину на поверхні електрода і притягують до поверхні металу аніони з розчину електроліту.
Одна обкладка ПЕШ — позитивні заряди зі сторони металу, інша — негативні заряди аніонів з боку розчину.
Шляхом вибору концентрації потенціалвизначаючих йонів в розчині можна досягти такої ситуації, коли умова μр = μе не потребує переходу йонів з метала в розчин чи навпаки. В цьому випадку заряд поверхні метала дорівнює нулю, а його потенціал відносно електрода порівняння називається потенціалом нульового заряду.
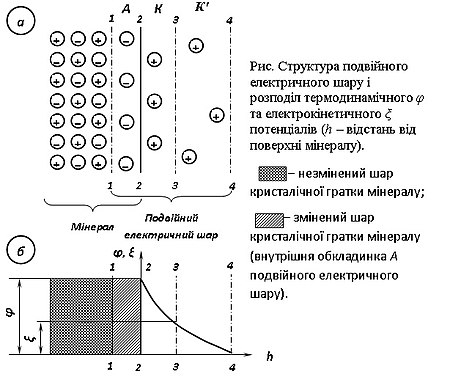
Якщо припустити, що у розчин із зовнішнього шару А кристалічної ґратки мінералу, розташованого між лініями 1–1 та 2–2, переходять переважно катіони, то у цьому випадку поверхня мінералу здобуває негативний заряд. Після того як між розчином і твердою фазою встановиться рівновага, вправо від лінії 1–1, яка є межею між зміненим і незміненим шарами ґратки мінералу, будуть знаходитися переважно аніони мінералу, і саме цей шар буде заряджений негативно (у крайньому разі, як показано на рис. а, у цьому шарі будуть тільки аніони). Указана частина подвійного електричного шару називається його внутрішньою обкладинкою і позначена буквою А, тому що цей шар складається в основному із аніонів мінералу. Йони внутрішньої обкладинки А подвійного електричного шару розташовані упорядковано і міцно зв'язані з кристалічною ґраткою мінералу. Фізичною межею мінералу і водного розчину є лінія 2–2. Безпосередньо за цією межею розташовано наступний упорядкований шар йонів, заряджених позитивно, тобто катіонів. Катіони, що безпосередньо прилягають до внутрішньої обкладинки подвійного електричного шару, міцно зв'язані з зарядженою поверхнею мінералу і при русі мінеральної частинки відносно довкілля рухаються разом із нею. Ці катіони, розташовані у шарі К, складають щільну частину зовнішньої обкладинки подвійного електричного шару (шар Штерна). Віддалені від внутрішньої обкладинки катіони зв'язані з нею слабше і при переміщенні мінеральної частинки у середовищі відстають від неї. Цей шар йонів протилежного знаку (шар К′) називають дифузним або шаром Гюї. Лінія 4–4 є межею між дифузним шаром і середовищем, що практично не містить катіонів.
Подвійний електричний шар може також утворюватись на поверхні бульбашки (поверхні розділу «повітря — вода») і краплини аполярного масла у воді (поверхні розділу «масло — вода») при адсорбції на міжфазній поверхні, напр., гетерополярних йонів або молекул.
Оскільки поверхня частинки має заряд, у просторі, що оточує частинку, виникає електричне поле, характер зміни потенціалу якого в міру віддалення від поверхні мінералу показано на рис. б. Потенціал φ поля на міжфазній поверхні називається повним або термодинамічним, а на межі шарів Штерна і Гюї — електрокінетичним або дзета-потенціалом ξ.
Значення φ-потенціалу мінералу залежить від концентрації потенціал-визначальних йонів (тобто йонів, з яких складається мінерал, і йонів, що їм ізоморфні). Величина φ-потенціалу характеризується як різниця потенціалів між йонами зовнішньої обкладинки, з одного боку, і йонами внутрішньої обкладинки (зліва від лінії 2–2) — з іншого. Величина ξ-потенціалу характеризується як різниця потенціалів сукупності йонів дифузного шару й усіх йонів зліва від лінії ковзання 3–3 з урахуванням їхніх знаків. Значення ξ-потенціалу змінюється при варіюванні концентрації будь-яких електролітів у розчині.
Термодинамічний потенціал виникає на межі розділу «поверхня мінералу — рідина», а електрокінетичний потенціал — на поверхні ковзання 3–3, тому він є частиною термодинамічного.
Для дослідження ПЕШ використовують в основному три групи методів: адсорбційні, електрокапілярні та методи основанні на зарядженні ПЕШ.
Методи основані на тому, що утворення ПЕШ пов'язано з адсорбцією різноманітних компонентів розчину і призводить до зміни їх концентрації.
Ці методи широко застосовують для вивчення ПЕШ, що утворюється на дисперсних частинках в колоїдних системах.
Сутність методів в тому, що утворення ПЕШ зменшує роботу, яка необхідна для створення нової поверхні поділу фаз, і тим самим призводить до залежності міжфазного натягу від потенціалу електрода.
Застосування електрокапілярних методів обмежено межею поділу між рідкими фазами, на яких можливий безпосередній вимір міжфазного натягу; для твердих електродів ці методи дають лише кількісну інформацію про будову ПЕШ.
До цих методів належать різноманітні гальваностатичні і потенціостатичні імпульсні методи, а також методи виміру електричної ємності ПЕШ (імпедансний метод, кулоностатичний метод, тощо).
Для успішного застосування цих методів необхідно, щоб вся підведена до електрода електрика була витрачена лише на зарядження ПЕШ і не витрачалась на електрохімічні реакції. Електроди, які задовольняють цим вимогам називають ідеально поляризованими.
ПЕШ також можна вивчати оптичними методами, наприклад еліпсометрією. Можна визначити заряд поверхні електрода, його залежність від потенціалу електрода, потенціалу нульового заряду, електричної ємкості ПЕШ, а також поверхневі надлишки різноманітних компонентів розчину в залежності від потенціалу, заряду поверхні електрода чи їх об'ємної концентрації.
- Адсорбція
- Електрокінетичний потенціал
- Теорія Гуї-Чапмана
- струм подвійного шару
- Поверхневий заряд
- ємність подвійного шару
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Химическая энциклопедия. М.: Советская энциклопедия, 1988. — Т. 2
- Дамаскин Б. Б., Петрий О. А., Введение вэлектрохимическую кинетику, 2 изд., М., 1983
- Делахай П. Двойной слой и кинетика элекродных процессов. — М.: Мир, 1967.