Фарбування за Грамом
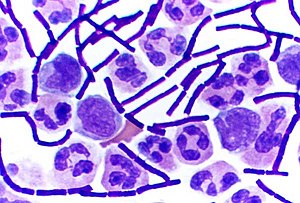
Фарбування за Грамом (або метод Грама) — емпірично виведений метод розрізнення бактерій за допомогою фарбування їх певним методом на дві великі групи: Грам-позитивні та Грам-негативні, які розрізняються за хімічними та фізичними властивостями їхньої клітинної стінки.
Метод називається на честь його винахідника, данського науковця Ганса Крістіана Грама (1853–1938), який розробив цей метод у 1884 році щоб розрізнити бактерії Pneumococcus і Klebsiella pneumoniae.
Фарбування за Грамом — одна з найкорисніших фарбувальних процедур у мікробіологічних лабораторних дослідженнях. Процедура широко використовується як інструмент для розрізнення Грам-негативних і Грам-позитивних бактерій, що звичайно є першим кроком у визначенні ідентичності специфічного бактерійного зразка.
У медицині фарбування за Грамом виконується при аналізі крові або біопсії, коли підозрюється бактеріальне ураження. Цей метод набагато швидший, ніж отримання чистої культури, і особливо важливий, коли визначення типу бактеріальної інфекції необхідно для прогнозу та швидкого вибору методу лікування. Наприклад, при дослідженні спінномозкової рідини на наявність лабораторних ознак менінгіту і рідини суглобів — на септичний артрит.
При аналізі, наприклад, коки і спороносні форми бактерій, а також дріжджі — грам-позитивні і забарвлюються в синяво-чорне (темно-синє) забарвлення, більшість інших бактерій — грам-негативні забарвлюються в червоний колір, ядра клітин еукаріот набувають яскраво-червоного відтінку, а цитоплазма — рожевого.
Фарбування за Грамом належить до складного способу фарбування, коли мазок обробляють двома фарбниками, з яких один є основним, а інший — додатковим. Окрім фарбувальних речовин при складних способах забарвлення застосовують знебарвлювальні речовини: спирт, кислоти та ін. Для фарбування за Грамом частіше використовують барвники трифенілметанової групи: генціановий, метиловий фіолетовий або кристал віолет. Грам-позитивні (Грам (+)) мікроорганізми дають міцне з'єднання з вказаними барвниками і йодом. При цьому вони не знебарвлюються при дії на них спиртом, унаслідок чого при додатковому забарвленні фуксином Грам (+) мікроорганізми не змінюють спочатку утворений фіолетовий колір.
Грам-негативні (Грам (-)) мікроорганізми утворюють з основними барвниками і йодом з'єднання, які легко руйнується під дією спирту. Внаслідок цього бактерії знебарвлюються і потім забарвлюються фуксином, набуваючи червоного кольору.
Матеріал, який досліджується, розподіляють тонким шаром по поверхні ретельно знежиреного скла. Приготований мазок висушують на повітрі й після повного висихання фіксують.
При фіксації мазок закріплюється на поверхні скла, і тому при подальшому фарбуванні препарату клітини не змиваються. Крім того, убиті бактеріальні клітини забарвлюються краще, ніж живі. Розрізняють фізичний спосіб фіксації, в основу якого покладена дія високої температури на клітину, і хімічні способи, які передбачають застосування хімічних засобів, які здійснюють коагуляцію білків цитоплазми.
Фізичний спосіб фіксації: Скло з препаратом беруть пінцетом і плавним рухом проводять 2-3 рази над верхньою частиною полум'я лабораторного пальника. Весь процес фіксації повинен займати не більше, ніж 2 секунди. Надійність фіксації перевіряють таким прийомом: вільну від мазка поверхню скла прикладають до тильної поверхні лівої кисті. При правильній фіксації скло повинне бути гарячим, але не спричиняти відчуття опіку (70—80 °С).
Хімічний спосіб фіксації: Для фіксації мазків застосовують метиловий спирт, ацетон, суміш Никіфорова (суміш етилового спирту 96% і наркозного ефіру в співвідношенні 1:1), рідину Карнуа (етилового спирту 96% — 60%, хлороформу 30%, крижаної оцтової кислоти 10%). Скло з висушеним мазком занурюють в склянку з фіксуючою речовиною на 10-15 хвилин і потім висушують на повітрі.
- На фіксований мазок наливають один з основних барвників на 2—3 хвилини. Щоб уникнути осаду фарбують через фільтрувальний папір.
- Зливають фарбу, акуратно видаляють фільтрувальний папір. Мазок заливають на 1—2 хв розчином Люголя або йодистим розчином, за Грамом (водний розчин йодиду калію і кристалічного йоду в співвідношенні 2:1) до почорніння препарату.
- Розчин зливають, мазок прополіскують 96° етиловим спиртом або ацетоном, наливаючи і зливаючи його, поки мазок не знебарвиться і рідина, яка стікає, не стане чистою (приблизно 20-40-60 секунд).
- Ретельно промивають скельця в проточній або дистильованій воді 1—2 хв.
- Для виявлення грам-негативних бактерій препарати додатково фарбують фуксином або сафраніном (2—5 хв).
- Промивають в проточній воді та висушують фільтрувальним папером.
- Gram, HC (1884). Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten. Fortschritte der Medizin. 2: 185—89.
- Bergey, David H.; John G. Holt; Noel R. Krieg; Peter H.A. Sneath (1994). Bergey's Manual of Determinative Bacteriology (вид. 9th ed.). Lippincott Williams & Wilkins.
- Madigan, MT; Martinko J; Parker J (2004). Brock Biology of Microorganisms (вид. 10th Edition). Lippincott Williams & Wilkins.
- Ryan, KJ; Ray, CG (2004). Sherris Medical Microbiology (вид. 4th ed.). McGraw Hill.
- Application of stains in clinical microbiology — резюме статьи в Biotechnic & Histochemistry, Volume 76, Number 3, May 01, 2001, pp. 119–125(7)
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.