Чотирикратний зв'язок
| Чотирикратний зв'язок | |
| Попередник | потрійний зв'язок |
|---|---|
| Наступник | п'ятикратний зв'язок |
Чотирикратний зв'язок — кратна форма хімічного зв'язку між двома атомами у молекулі, що утворена чотирма електронними парами[1]. Стабільні чотирикратні зв'язки найчастіше зустрічаються серед перехідних металів d-блоку, таких як реній, вольфрам, технецій, молібден та хром. Зазвичай ліганди, які утворюють чотирикратні зв'язки, є π-донорами, але не π-акцепторами.
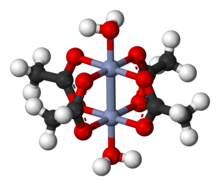
Ацетат хрому (ІІ) Cr2(μ-O2CCH3)4(H2O)2 — перша хімічна синтезована сполука, що містить чотирикратний зв'язок. Вона була вперше охарактеризована у 1844 році французьким хіміком Еженом Пеліго[en], хоча сам кратний характер зв'язку був розпізнаний більше ніж через століття[2].Перше кристалографічне дослідження сполук з чотирикратним зв'язком було проведено на прикладі солей ренію — (pyH)HReCl4[3]. Була виявлена дуже коротка відстань Re–Re, що вказувала на значну взаємодію між атомами ренію. Незабаром після цього Ф. Альберт Коттон та Б. Б. Гарріс повідомили про кристалічну структуру октахлородиренату (III) калію або K2[Re2Cl8] · 2H2O[4]. Структурний аналіз показав, що попередня характеристика була помилковою. Коттон і Гарріс сформулювали обґрунтування зв'язку за методом молекулярних орбіталей, яке прямо вказувало на чотирикратний зв'язок. Довжина зв'язку реній-реній в цій сполуці становить лише 2.24 Å. У теорії молекулярних орбіталей зв'язок описується як σ2π4δ2 з одним сигма-зв'язком, двома пі-зв'язками та одним дельта-зв'язком.
Ф. Коттон та співробітники описали декілька сполук з чотирикратним зв'язком. Так сіль октахлородимолібдат (II) калію, K4 [Mo2Cl8], є ізоелектронною зі сполукою диренію[5]. Прикладом з'єднання двох атомів вольфраму у молекулі з чотирикратним зв'язком є [W2(hpp)4Cl2] (hpp = гексагідропіримідопіримідин)[6].
- ↑ Radius, U.; Breher, F. (2006). 'To Boldly Pass the Metal–Metal Quadruple Bond. Angew. Chem. Int. Ed. 45 (19): 3006—3010. doi:10.1002/anie.200504322.
- ↑ Cotton, F. A.; Walton, R. A. (1993). Multiple Bonds Between Metal Atoms. Oxford: Oxford University Press. ISBN 0-19-855649-7.
- ↑ Kuznetsov, V. G.; Koz'min, P. A. «The structure of (pyH)HReCl4» Zhurnal Strukturnoi Khimii 1963, 4, 55-62. (рос.)
- ↑ Cotton, F. A.; Harris, C. B. (1965). The Crystal and Molecular Structure of Dipotassium Octachlorodirhenate(III) Dihydrate, K2[Re2Cl8]·2H2O. Inorg. Chem. 4 (3): 330—333. doi:10.1021/ic50025a015.
- ↑ G. S. Girolami, T. B. Rauchfuss, R. J. Angelici, Synthesis and technique in inorganic chemistry, Mill Valley, CA, University Science Books, 1999, ISBN 0-935702-48-2.
- ↑ F. A. Cotton, J. P. Donahue, D. L. Lichtenberger, C. A. Murillo, D. Villagrá, Expeditious access to the most easily ionized closed-shell molecule, W2(hpp)4, in J. Am. Chem. Soc., vol. 127, No 31, 2005, pp. 10808–10809, DOI:10.1021/ja0535458
- F. A. Cotton, R. A. Walton: Multiple Bonds Between Metal Atoms, Oxford University Press 1993. ISBN 0-19-855649-7