Діоксид селену
| Діоксид селену | |
|---|---|
 Структурна формула діоксиду селену
| |
 Просторова модель ланцюга в кристалічному діоксиді селену
| |
 Кристали діоксиду селену
| |
| Інші назви | Селен(IV) оксид Селенистий ангідрид |
| Ідентифікатори | |
| Номер CAS | 7446-08-4 |
| PubChem | 24007 |
| Номер EINECS | 231-194-7 |
| Назва MeSH | D01.810.950 |
| RTECS | VS8575000 |
| SMILES | O=[Se]=O |
| InChI | 1/O2Se/c1-3-2 |
| Властивості | |
| Молекулярна формула | SeO2 |
| Молярна маса | 110.96 г/моль |
| Зовнішній вигляд | Білі кристали, стають злегка рожевими зі слідами розкладання[1] |
| Запах | Гнилої редиски |
| Густина | 3.954 г/см3, твердий |
| Тпл | 340 °C |
| Розчинність (вода) | 38.4 г/100 мл (20 °C) 39.5 г/100 мл (25 °C) 82.5 г/100 мл (65 °C) |
| Розчинність | розчинний у бензені |
| Розчинність (Етанол) | 6.7 г/100 мл (15 °C) |
| Розчинність (Ацетон) | 4.4 г/100 мл (15 °C) |
| Розчинність (Оцтова кислота) | 1.11 г/100 мл (14 °C) |
| Розчинність (Метанол) | 10.16 г/100 мл (12 °C) |
| Тиск насиченої пари | 1.65 kPa (70 °C) |
| Кислотність (pKa) | 2.62; 8.32 |
| Показник заломлення (nD) | > 1.76 |
| Структура | |
| Кристалічна структура | дивитись текст |
| Координаційна геометрія |
Тригональна (Se) |
| Небезпеки | |
| ГГС піктограми |   
|
| ГГС формулювання небезпек | 301, 331, 373, 410 |
| ГГС запобіжних заходів | 260, 261, 264, 270, 271, 273, 301+310, 304+340, 311, 314, 321, 330, 391, 403+233, 405, 501 |
| Головні небезпеки | Токсичний при ковтанні та вдиханні[2] |
| NFPA 704 | |
| Температура спалаху | Негорючий |
| Пов'язані речовини | |
| Інші аніони | Дисульфід селену |
| Інші катіони | Діоксид сірки Діоксид телуру |
| Пов'язані речовини | Селениста кислота |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Діоксид селену — хімічна сполука з формулою SeO2. Ця безбарвна тверда речовина є однією з найбільш частих сполук селену.
Будова[ред. | ред. код]
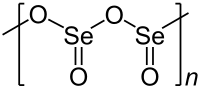
Твердий діоксид селену є одновимірним полімером, ланцюг якого складається з атомів селену та кисню, що чергуються. Кожен атом селену є пірамідальним і має кінцеву оксидну групу. Довжина мостового зв’язку Селен-Оксиген становить 179 пм, а кінцева відстань — 162 пм.[3] Відносна стереохімія селену чергується вздовж полімерного ланцюга (синдіотактичність).
У газовому стані діоксид селену присутній у вигляді димерів та інших олігомерних форм, при більш високих температурах він є мономерним. Мономерна форма має зігнуту структуру, дуже схожу на структуру діоксиду сірки з довжиною зв’язку 161 пм.[4] Димерна форма була виділена в низькотемпературній аргоновій матриці, і вібраційні спектри вказують на те, що вона має центросиметричну форму крісла.[3] Мономерний діоксид селену є полярною молекулою з дипольним моментом 2,62 D[5], направленим від середини двох атомів кисню до атома селену.
Розчинення SeO2 в оксидихлориді селену SeOCL2 дає тример [Se(O)O]3.[4]
У той час як діоксид сірки (SO2) має тенденцію бути молекулярним, SeO2 є одновимірним ланцюгом, TeO2 є зшитим полімером.[3]
Фізичні властивості[ред. | ред. код]
Тверда речовина легко сублімується. При дуже низьких концентраціях пари мають огидний запах, що нагадує гнилий хрін. При більш високих концентраціях пари мають запах, що нагадує соус з хрону, і можуть обпалити ніс і горло при вдиханні.
Хімічні властивості[ред. | ред. код]
Діоксид селену вважається кислотним оксидом: він розчиняється у воді з утворенням селенистої кислоти. Часто терміни селениста кислота та діоксид селену використовуються як синоніми.
Він реагує з основами із утворенням солей селенітів, що містять аніон SeO2−
3. Наприклад, реакція з NaOH (гідроксид натрію) дає селеніт натрію:
- SeO2 + 2 NaOH → Na2SeO3 + H2O
Отримання[ред. | ред. код]
Діоксид селену отримують за допомогою окиснення селену шляхом спалювання на повітрі або реакції з азотною кислотою чи перекисом водню, але, мабуть, найзручнішим способом є отримання шляхом дегідратації селенистої кислоти.
- 2 H2O2 + Se → SeO2 + 2 H2O
- 3 Se + 4 HNO3 + H2O → 3 H2SeO3 + 4 NO
- H2SeO3 ⇌ SeO2 + H2O
Поширеність[ред. | ред. код]
Природна форма діоксиду селену, давніїт, є дуже рідкісним мінералом. Він зустрічається лише в невеликій кількості вугільних резервуарів, де він формується навколо вентиляційних отворів, утворених газами, що виходять.[6]
Використання[ред. | ред. код]
Органічний синтез[ред. | ред. код]
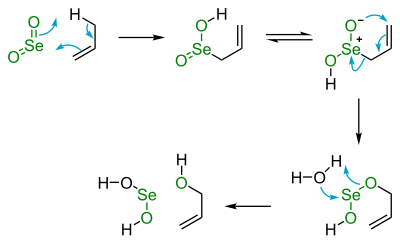
SeO2 є важливим реагентом в органічному синтезі. Окиснення паральдегіду (тример ацетальдегіду) за допомогою SeO2 дає гліоксаль, а окиснення циклогексанону дає 1,2-циклогександіон. Вихідний матеріал відновлюється до селену та випадає у вигляді осаду червоної аморфної твердої речовини, яку можна легко відфільтрувати.[7] Цей тип реакції називається окисненням Райлі. Він також відомий як реагент для «алілового» окиснення, реакції, яка виглядає наступним чином:
Інакше можна описати більш звично як:
- R2C=CR'-CHR"2 + [O] → R2C=CR'-C(OH)R"2
- де R, R', R" можуть бути алкільними або арильними замісниками.
Діоксид селену також можна використовувати для синтезу 1,2,3-селендіазолів з ацильованих похідних гідразону.[8]
Як барвник[ред. | ред. код]
Діоксид селену надає склу червоний колір. Він використовується в невеликих кількостях для протидії кольору через домішки заліза і таким чином для створення (очевидно) безбарвного скла. У великих кількостях він дає насичений рубіново-червоний колір.
Діоксид селену є активним інгредієнтом деяких розчинів холодного воронування.
Він також використовувався як тонер у фотопроявці.
Безпека[ред. | ред. код]
Селен є незамінним елементом, але при прийомі всередину більше 5 мг/день призводить до неспецифічних симптомів.[9]
Примітки[ред. | ред. код]
- ↑ Safety data sheet: Selenium dioxide (PDF). integrachem.com. 27 березня 2015. Процитовано 2 грудня 2022.
- ↑ Selenium dioxide safety and hazards. pubchem.ncbi.nlm.nih.gov. Процитовано 2 грудня 2022.
- ↑ а б в Handbook of Chalcogen Chemistry: New Perspectives in Sulfur, Selenium and Tellurium, Franceso A. Devillanova, Royal Society of Chemistry, 2007, ISBN 9780854043668
- ↑ а б Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ред.), Inorganic Chemistry, переклад: Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ↑ Takeo, Harutoshi; Hirota, Eizi; Morino, Yonezo (1972). Third-order potential constants and dipole moment of SeO2 by microwave spectroscopy. Journal of Molecular Spectroscopy. 41 (2): 420—422. Bibcode:1972JMoSp..41..420T. doi:10.1016/0022-2852(72)90216-0. ISSN 0022-2852.
- ↑ Finkelman, Robert B.; Mrose, Mary E. (1977). Downeyite, the first verified natural occurrence of SeO2 (PDF). American Mineralogist. 62: 316—320.
- ↑ Hach, C. C. Banks, C. V.; Diehl, H. (1963), 1,2-Cyclohexanedione Dioxime, Org. Synth.; Coll. Vol., 4: 229
{{citation}}: Пропущений або порожній|title=(довідка) - ↑ Lalezari, Iraj; Shafiee, Abbas; Yalpani, Mohamed (1969). A novel synthesis of selenium heterocycles: substituted 1,2,3-selenadiazoles. Tetrahedron Letters. 10 (58): 5105—5106. doi:10.1016/S0040-4039(01)88895-X.
- ↑ Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a23_525
Посилання[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Діоксид селену |