Тритіоацетон
| Тритіоацетон | |
|---|---|

| |
| Інші назви | Тритіопропанон[джерело?] |
| Ідентифікатори | |
| Номер CAS | 828-26-2 |
| PubChem | 13233 |
| Номер EINECS | 212-582-5 |
| ChEBI | 174132 |
| SMILES | C1(SC(SC(S1)(C)C)(C)C)(C)C |
| InChI | InChI=1S/C9H18S3/c1-7(2)10-8(3,4)12-9(5,6)11-7/h1-6H3 |
| Номер Бельштейна | 5-19-09-00119 |
| Властивості | |
| Молекулярна формула | C9H18S3 |
| Молярна маса | 222,43 г/моль |
| Густина | 1.0660 до 1.0700 г/мл[1] |
| Тпл | 21.8°C[2] |
| Ткип | 107°C/10 мм.рт.ст.[1] |
| Показник заломлення (nD) | 1.5390 до 1.5430[1] |
| Небезпеки | |
| ГГС піктограми | 
|
| ГГС формулювання небезпек | 315, 319, 335 |
| ГГС запобіжних заходів | 261, 264, 271, 280, 302+352, 304+340, 305+351+338, 312, 321, 332+313, 337+313, 362, 403+233, 405, 501 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Тритіоацетон (2,2,4,4,6,6-гексаметил-1,3,5-тритіан) — органічна сполука з хімічною формулою C
9H
18S
3. Його ковалентна структура [–C(CH
3)
2–S–]
3. тобто шестисегментне кільце з чергуванням атомів вуглецю та сірки з двома метильними групами, приєднаними до кожного вуглецю.[1] Його можна розглядати як похідну 1,3,5-тритіану із замісниками метильної групи для всіх атомів водню в вихідній структурі.
Сполука тритіоацетон є стабільним циклічним тримером тіоацетону (пропан-2-тіону), який сам по собі є нестабільною сполукою.[3][4] Навпаки, аналогічна триоксанова сполука, 2,2,4,4,6,6-гексаметил-1,3,5-тріоксан (триацетон), з атомами кисню замість атомів сірки, здається, нестабільна, тоді як її відповідний мономер, ацетон (2-пропанон) стабільний.
Синтез[ред. | ред. код]
Тритіоацетон вперше був отриманий у 1889 році Бауманом і Фроммом шляхом реакції сірководню з ацетоном.[4] У присутності підкисленого каталізатора ZnCl
2 при 25 °C, отримують речовину, яка складається з 60–70% тритіоацетону, 30–40% 2,2-пропандитіолу та невеликої кількості двох ізомерних домішок 3,3,5,5,6,6-гексаметил-1, 2,4-тритіан і 4-меркапто-2,2,4,6,6-пентаметил-1,3-дитіан.[4] Речовину також можна отримати шляхом піролізу аллілізопропілсульфіду.[5][6]
Реакції[ред. | ред. код]
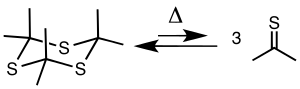
Піроліз тритіоацетону при 500–650 °C і 5–20 мм. рт. ст. дає тіоацетон, який можна зібрати за допомогою холодної пастки[en] при –78 °C.
Використання[ред. | ред. код]
Тритіоацетон міститься в деяких ароматизаторах. Номер FEMA[en] — 3475.[7][8][9][10]
Токсичність[ред. | ред. код]
LD50 становить 2,4 г/кг (миша, перорально).[11][2]
Дивись також[ред. | ред. код]
Список літератури[ред. | ред. код]
- ↑ а б в г TCI America (2020): "Product H1278: 2,2,4,4,6,6-Hexamethyl-1,3,5-trithiane". Online catalog page, accessed on 2020-01-01.
- ↑ а б NCBI PubChem (2010): "2,2,4,4,6,6-Hexamethyl-1,3,5-trithiane". Online chemical data sheet, accessed on 2020-01-01.
- ↑ R. D. Lipscomb and W. H. Sharkey (1970): "Characterization and polymerization of thioacetone". Journal of Polymer Science – Part A: Polymer Chemistry, volume 8, issue 8, pages 2187–2196. DOI:10.1002/pol.1970.150080826
- ↑ а б в William H. Sharkey (1979): "Polymerization through the carbon-sulfur double bond". Polymerization, series Advances in Polymer Science, volume 17, pages 73–103. DOI:10.1007/3-540-07111-3_2
- ↑ William J. Bailey and Hilda Chu (1965): "Synthesis of polythioacetone". ACS Polymer Preprints, volume 6, pages=145–155
- ↑ Horst Bohme, Hans Pfeifer, and Erich Schneider (1942): "Dimeric thioketones". Berichte der Deutschen Chemischen Gesellschaft, volume 75B, issue 7, pages 900–909. DOI:10.1002/cber.19420750722 Note: This early report mistakes the trimer for the monomer.
- ↑ E. J. Moran, O. D. Easterday, and B. L. Oser (1980): "Acute oral toxicity of selected flavor chemicals". Drug and Chemical Toxicology, volume 3, issue 3, pages 249–258.PMID 7449655 DOI:10.3109/01480548009002221
- ↑ World Health Organization (1999): "Trithioacetone[недоступне посилання з 01.12.2021]". Online data sheet in the Evaluation of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). Accessedd on 2020-01-02.
- ↑ G. Ohloff and I. Flament (1979): "The Role of Heteroatomic Substances in the Aroma Compounds of Foodstuffs". In Fortschritte der Chemie Organischer Naturstoffe (Progress in the Chemistry of Organic Natural Products), volume 36, pages 231–283. DOI:10.1007/978-3-7091-3265-4_2
- ↑ EUR-Lex (2012): "Table entry 15.009: Trithioacetone". In EU Regulation No. 872/2012, Document 32012R0872, Official Journal of the EU – Series L, volume 267, pages 1–161.
- ↑ E. J. Moran, O. D. Easterday, and B. L. Oser (1980): "Acute oral toxicity of selected flavor chemicals". Drug and Chemical Toxicology, volume 3, issue 3, pages 249–258.PMID 7449655 DOI:10.3109/01480548009002221