Закон Шарля
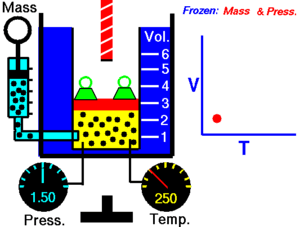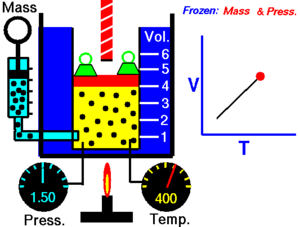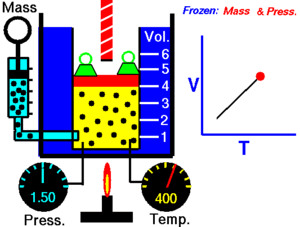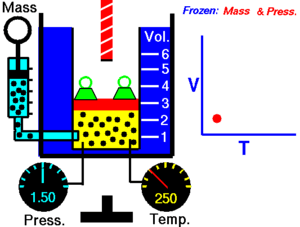
Зако́н Ша́рля — назва закону, що описує властивості газів. Описує ізохорний процес в ідеальному газі. Експериментально залежність тиску газу від температури за постійного об'єму встановив 1787 року Шарль і уточнив Гей-Люссаком 1802 року.
Закон теплового розширення газів: при сталому об'ємі залежність тиску Р даної маси газу від температури описується формулою:
- ,
де Т — термодинамічна температура; Р — тиск газу.
, чи ,
- де — тиск газу за температури ,
- — термічний коефіцієнт тиску, що характуризує відносне збільшення тиску газу при нагріванні його на один градус.
Формулювання закону
Формулювання закону Шарля таке:
Тиск газу фіксованої маси і фіксованого об'єму прямо пропорційний абсолютній температурі газу.
Простіше, якщо температура газу збільшується, то його тиск теж збільшується, якщо при цьому маса і об'єм газу залишаються незмінними. Закон має дуже простий математичний вигляд, якщо температура вимірюється за абсолютною шкалою, наприклад, у кельвінах. Математично закон записують так:
або
де:
- P — тиск газу,
- T — температура газу (в кельвінах),
- k — константа.
Цей закон справедливий остільки, оскільки температура є мірою середньої кінетичної енергії частинок речовини. Якщо кінетична енергія частинок збільшується, вони стикаються зі стінками посудини з більшою швидкістю, тим самим передаючи стінці більший імпульс і створюючи вищий тиск.
Для зіставлення параметрів тієї ж кількості речовини в різних станах закон записують у вигляді пропорції:
- або
Закон Гей-Люссака, закон Шарля і закон Бойля — Маріотта разом утворюють об'єднаний газовий закон. У поєднанні з законом Авогадро ці три газові закони узагальнюються до рівняння стану ідеального газу.
Неоднозначність термінології
Закон Амонтона про тиск і температуру: закон тиску, описаний вище, можна приписати Гійому Амонтону, який на початку XVIII століття (точніше між 1700 і 1702 роками[1]) виявив, що тиск фіксованої маси газу, підтримуваного за постійного об'єму, пропорційний його температурі. Амонтон виявив це під час побудови «повітряного термометра». Називати цей закон законом Гей-Люссака просто некоректно, оскільки Гей-Люссак досліджував взаємозв'язок між об'ємом і температурою, а не тиском і температурою[джерело?].
Закон Шарля був відомим як закон Шарля і Гей-Люссака, оскільки Гей-Люссак опублікував його 1802 року, використавши здебільшого неопубліковані від 1787 року дані Шарля.
Тому в українсько- і англомовній науковій літературі існують деякі відмінності в найменуванні законів, пов'язаних з ім'ям Гей-Люссака. Ці відмінності наведено в таблиці:
| Українськомовна назва | Англомовна назва | Формула |
|---|---|---|
| Закон Гей-Люссака | Закон Шарля (Charles's law) Закон Гей-Люссака Закон об'ємів (Volumes Law) |
|
| Закон Шарля | Закон Гей-Люссака (Gay-Lussac's law) Другий закон Гей-Люссака |
|
| Закон об'ємних відношень | Закон Гей-Люссака (Gay-Lussac's law) |
Див. також
Примітки
Література
- Яворский Б. М., Селезнев Ю. А. Справочное руководство по физике для поступающих в вузы и для самообразования. — 4-е изд., испр. — М.: Наука. — Гл. ред. физ-мат. лит., 1989—576 с. — ISBN 5-02-014031-7
- Castka, Joseph F.; Metcalfe, H. Clark; Davis, Raymond E.; Williams, John E. Modern Chemistry. — Holt, Rinehart and Winston[en], 2002. — ISBN 0-03-056537-5.
- Guch, Ian. The Complete Idiot's Guide to Chemistry. — Alpha, Penguin Group Inc, 2003. — ISBN 1-59257-101-8.
- Mascetta, Joseph A. How to Prepare for the SAT II Chemistry. — Barron's, 1998. — ISBN 0-7641-0331-8.
Посилання
- Закон Шарля. Ізохора. (рос.)
- Amonton's Law (англ.)











