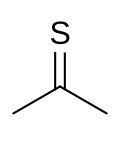
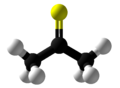
Тіоацетон
| Тіоацетон | |
|---|---|
| |
 |
 |
| Систематична назва | Тіопропан-2-он |
| Інші назви |
|
| Ідентифікатори | |
| Номер CAS | 4756-05-2 |
| PubChem | 641811 |
| ChEBI | 36580 |
| SMILES | CC(=S)C |
| InChI | 1/C3H6S/c1-3(2)4/h1-2H3 |
| Номер Бельштейна | 1560129 |
| Властивості | |
| Молекулярна формула | C3H6S |
| Молярна маса | 74,14 г/моль |
| Зовнішній вигляд | Рідина від оранжевого до коричневого кольору |
| Запах | Гнильний і сильно смердючий |
| Тпл | −55°C(218.15k/-67°F)[1] |
| Ткип | 70°C(343.15k/158°F)[1] |
| Небезпеки | |
| Головні небезпеки | Запах, подразнює шкіру |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Тіоацетон ― сульфуроорганічна сполука з хімічною формулою (CH3)2CS, що належить до групи тіонів що називаються тіокетонами. Це нестійка оранжева або коричнева речовина, яку можна отримати лише при низьких температурах.[2] Вище −20 °C, тіоацетон легко перетворюється на полімер і тример, тритіоацетон.[3] Він має надзвичайно сильний неприємний запах і вважається однією із найнеприємніших хімічних речовин, відомих людству.[4]
Тіоацетон вперше був отриманий у 1889 році Бауманом[en] і Фроммом як домішка у синтезі тритіоацетону.[1]
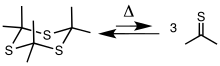
Отримання[ред. | ред. код]
Тіоацетон зазвичай отримують шляхом крекінгу циклічного тримеру тритіоацетону [(CH3)2CS]3. Тример отримуютьи шляхом піролізу аллілізопропілсульфіду або обробкою ацетону сірководнем у присутності кислоти Льюїса.[5][6] Тример зазнає крекінгу при 500–600 °C, щоб отримати тіон.[2][7][1]
Полімеризація[ред. | ред. код]
На відміну від свого кисневого аналога ацетону, який важко полімеризується, тіоацетон спонтанно полімеризується навіть за дуже низьких температур, чистий або розчинений в ефірі чи етиленоксиді, утворюючи білу тверду речовину, яка є різного складу лінійного полімеру ···–[C(CH
3)
2–S–]
n–··· і циклічного тримеру тритіоацетону. Інфрачервоне поглинання цієї речовини відбувається переважно при 2950, 2900, 1440, 1150, 1360 і 1375 см −1 через гемінальні метильні пари, а при 1085 і 643 см −1 за рахунок зв'язку C–S (Карбон-Сульфур). Спектри ЯМР 1H демонструють один пік при x = 8,1.[1]
Середня молекулярна маса полімеру коливається від 2000 до 14000 залежно від способу отримання, температури та наявності тіоенольного таутомера. Полімер плавиться в діапазоні близько 70 °C до 125 °C. Полімеризації сприяють вільні радикали і світло.[1]
Циклічний тример тіоацетону, тритіоацетон — біла або безбарвна сполука з температурою плавлення близько кімнатної (24 °C). Він також має неприємний запах.[3]
Запах[ред. | ред. код]
Тіоацетон має сильний надзвичайно неприємний запах. Як і багато сульфуроорганічних сполук з низькою молекулярною вагою, запах є сильним і його можна виявити навіть у сильно розбавленому середовищі.[4] У 1889 році спроба дистиляції тіоацетону в німецькому місті Фрайбург супроводжувалася випадками блювоти, нудоти та втрати свідомості у людей в районі радіусом 0,75 км навколо лабораторії через запах речовини.[8] У звіті 1890 року британські хіміки з миловарного заводу Whitehall Soap Works у місті Лідс відзначили, що розведення, схоже, погіршує запах, і описали його як «моторошний».[9] У 1967 році дослідники Esso повторили експеримент із крекінгу тритіоацетону в лабораторії на південь від Оксфорда, Великобританія. Вони повідомили про свій досвід таким чином:
Нещодавно ми зіткнулися з проблемою сморіду, яка перевершила всі наші найгірші очікування. Під час перших експериментів пробка вискочила з пляшки із залишками речовини, і, хоча її відразу ж замінили, це призвело до негайної скарги на нудоту та нездужання колег, які працювали в будівлі за двісті ярдів (180 метра). Двоє наших хіміків, які досліджували крекінг невеликих кількостей тритіоацетону, виявились об’єктом ворожих поглядів у ресторані та зазнали приниження від того, що офіціантка бризкала навколо них дезодорантом. Запахи суперечили очікуваним ефектам розведення, оскільки працівники лабораторії не вважали запахи нестерпними ... вони щиро заперечували відповідальність, оскільки працювали в закритих системах. Щоб переконати їх у протилежному, їх розставили разом з іншими спостерігачами по лабораторії на відстані до чверті милі (400 метрів), одну краплю будь-якого гем-дитіолу ацетону чи маточних розчинів кристалізації неочищеного тритіоацетону поміщали на годинникове скло у витяжній шафі. Запах було виявлено по вітру за лічені секунди.Оригінальний текст (англ.)Recently we found ourselves with an odour problem beyond our worst expectations. During early experiments, a stopper jumped from a bottle of residues, and, although replaced at once, resulted in an immediate complaint of nausea and sickness from colleagues working in a building two hundred yards [180 m] away. Two of our chemists who had done no more than investigate the cracking of minute amounts of trithioacetone found themselves the object of hostile stares in a restaurant and suffered the humiliation of having a waitress spray the area around them with a deodorant. The odours defied the expected effects of dilution since workers in the laboratory did not find the odours intolerable ... and genuinely denied responsibility since they were working in closed systems. To convince them otherwise, they were dispersed with other observers around the laboratory, at distances up to a quarter of a mile [0,40 km], and one drop of either acetone gem-dithiol or the mother liquors from crude trithioacetone crystallisations were placed on a watch glass in a fume cupboard. The odour was detected downwind in seconds.[4]
Тіоацетон іноді вважають небезпечним хімікатом через його надзвичайно неприємний запах і передбачувану здатність викликати у людей втрату свідомості та блювоту. Його особливістю є те що його можна відчути навіть на великих відстанях. Станом на 2023 рік принаймні двоє вчених YouTube (Найджел з «NileRed»[10] і Зак з «LabCoatz»[11]) опублікували відео, на яких вони відчувають запах свіжовиготовленого тіоацетону, як зблизька, так і на відстані. В обох випадках вони не відчували описаних раніше побічних ефектів (нудота, блювота або втрата свідомості). Проте оператор, який знімав відео у NileRed, не міг винести запах.
Дивись також[ред. | ред. код]
- Тіобензофенон, тіокетон, який можна виділити у вигляді твердої речовини.
- Бромоацетон
- Хлороацетон
- Фторацетон
- Йодоацетон
Список літератури[ред. | ред. код]
- ↑ а б в г д е William H. Sharkey (1979): "Polymerization through the carbon-sulfur double bond".
- ↑ а б V.C.E. Burnop; K.G. Latham (1967). Polythioacetone Polymer. Polymer. 8: 589—607. doi:10.1016/0032-3861(67)90069-9.
- ↑ а б R.D. Lipscomb; W.H. Sharkey (1970). Characterization and polymerization of thioacetone. Journal of Polymer Science Part A: Polymer Chemistry. 8 (8): 2187—2196. Bibcode:1970JPoSA...8.2187L. doi:10.1002/pol.1970.150080826.
- ↑ а б в Derek Lowe (11 червня 2009). Things I Won't Work With: Thioacetone. In The Pipeline.
- ↑ Bailey, William J.; Chu, Hilda (1965). Synthesis of polythioacetone. ACS Polymer Preprints. 6: 145—155.
- ↑ Bohme, Horst; Pfeifer, Hans; Schneider, Erich (1942). Dimeric thioketones. Berichte der Deutschen Chemischen Gesellschaft. 75B (7): 900—909. doi:10.1002/cber.19420750722.
- ↑ Kroto, H.W.; Landsberg, B.M.; Suffolk, R.J.; Vodden, A. (1974). The photoelectron and microwave spectra of the unstable species thioacetaldehyde, CH3CHS, and thioacetone, (CH3)2CS. Chemical Physics Letters. 29 (2): 265—269. Bibcode:1974CPL....29..265K. doi:10.1016/0009-2614(74)85029-3. ISSN 0009-2614.
- ↑ E. Baumann & E. Fromm (1889). Ueber Thioderivate der Ketone. Berichte der Deutschen Chemischen Gesellschaft. 22 (2): 2592—2599. doi:10.1002/cber.188902202151.
- ↑ Chemical News and Journal of Industrial Science. Chemical news office. 1890. с. 219.
- ↑ Making the stinkiest chemical known to man. YouTube.
- ↑ Making Thioacetone: The Worst Smelling Substance on Earth…and SMELLING IT | First-Ever Complete Demo. YouTube.
Зовнішні посилання[ред. | ред. код]
- Тіоацетон, NIST
- Тритіоацетон, Aldrich
| ||||||||||||||||||||||||||||||||||||||||||||