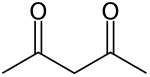
Ацетилацетон
| Ацетилцетон | |
|---|---|
| |
| Назва за IUPAC | пентан-2,4-діон |
| Інші назви | Hacac |
| Ідентифікатори | |
| Номер CAS | 123-54-6 |
| Номер EINECS | 204-634-0 |
| KEGG | C15499 |
| ChEBI | CHEBI:14750 |
| SMILES | O=C(C)CC(=O)C |
| InChI | InChI=1S/C5H8O2/c1-4(6)3-5(2)7/h3H2,1-2H3 |
| Номер Бельштейна | 741937 |
| Номер Гмеліна | 2537 |
| Властивості | |
| Молекулярна формула | С5Н8O2 |
| Молярна маса | 100.12 г/моль |
| Густина | 0,975 г/см³ (15 °C) |
| Тпл | −23 °C |
| Ткип | 140 °C |
| Розчинність (вода) | 16 г/100г води |
| Кислотність (pKa) | 8.99±0.04 |
| Небезпеки | |
| Індекс ЄС | 606-029-00-0 |
| R/S фрази | R10, R22, (S2), S21, S23, S24/25 |
| NFPA 704 | |
| Температура спалаху | 34 °C |
| Вибухові границі | 2,4%-11,6% |
| Пов'язані речовини | |
| Пов'язані речовини | Ацетон, Ацетооцтовий естер |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Ацетилацетон ( СН3-СО-СН2-СО-СН3) — органічна сполука, класу кетонів, найпростіший β-дикетон, що широко застосовується в синтезі гетероциклічних сполук. Завдяки кето-єнольній таутомерії ацетилацетон може виступати як бідентатний ліганд (H-acac).
Хімічну формулу ацетилацетону можна записати багатьма різними і водночас правильними способами залежно від сфери використання:
- Hacac — в координаційній хімії, коли потрібно підкреслити кислотність одного з атомів гідрогену.
- MeCO-CH2-COMe — в органічній хімії, підкреслюючи що ця сполука — β-дикетон.
- CH2Ac2 — коли фокусують увагу на кислотній метиленовій групі.
Властивості[ред. | ред. код]
Безбарвна рідина з оцтово-ацетонним запахом. Ацетилацетон обмежено змішується з водою.[1]
Розчинність у системі Ацетиацетон-Вода[1] Температура °C 0 9,6 19,8 29,8 39,7 50,1 60,6 70,5 80,3 90,5 Ацетилацетон у воді % по масі 14,1 14,9 16,1 17,6 18,9 21,02 24,4 27,0 32,2 40,3 Вода в ацетилацетоні % по масі 1,7 2,1 2,8 3,5 4,4 5,8 7,8 10,0 13,5 19,9
Таутомерія[ред. | ред. код]
Кетонна та енольна форми ацетилацетону швидко переходять одна в одну та співіснують в розчині (кето-енольна таутомерія). В енольній формі два атоми кисню (оксигену) рівноцінні, протон знаходиться від них на однаковій відстані. C2v симетрія для енолу була підтверджена різними методами. [2] В рідкому стані ацетилацетон знаходиться на 80% в енольній формі. Константа рівноваги зсувається в сторону кетонної форми в полярних та протонодонорних розчинниках.[3]
Розчинник Газова фаза Циклогексан Толуен THF ДМСО Вода Kketo→enol 11,7 42 10 7,2 2 0,23
Отримання[ред. | ред. код]
Поомислово ацетилацетон отримують термічним перегрупуванням ізопренілацетату [4]
- CH2C(CH3)OC(O)Me → MeC(O)CH2C(O)Me
Одним з перших лабораторних шляхів отримання ацетилацетону була конденсація ацетону та етилацетату під дією основ.
- NaOEt + EtO2CCH3 + CH3C(O)CH3 → NaCH3C(O)CHC(O)CH3 + 2 EtOH
- NaCH3C(O)CHC(O)CH3 + HCl → CH3C(O)CH2C(O)CH3 + NaCl
Примітки[ред. | ред. код]
- ↑ а б R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95, DOI:10.1021/je00005a024.
- ↑ W. Caminati, J.-U. Grabow (2006). The C2v Structure of Enolic Acetylacetone. Journal of the American Chemical Society. 128 (3): 854—857. doi:10.1021/ja055333g.
- ↑ Reichardt, Christian (2003). Solvents and Solvent Effects in Organic Chemistry (вид. 3rd). Wiley-VCH. ISBN 3-527-30618-8.
- ↑ Hardo Siegel, Manfred Eggersdorfer “Ketones” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, Wienheim. DOI:10.1002/14356007.a15_077
| |||||||||||

