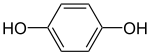
Гідрохінон
| Гідрохінон | |
|---|---|
 Гідрохінон
| |

| |
| Назва за IUPAC | Бензен-1,4-діол[1] |
| Інші назви | Гідрохінон Хінол 1,4-дигідроксибензен |
| Ідентифікатори | |
| Номер CAS | 123-31-9 |
| Номер EINECS | 204-617-8 |
| DrugBank | 09526 |
| KEGG | D00073, C15603 і C00530 |
| ChEBI | 17594 |
| RTECS | MX3500000 |
| Код ATC | D11AX11 |
| SMILES | c1cc(ccc1O)O[1] |
| InChI | 1S/C6H6O2/c7-5-1-2-6(8)4-3-5/h1-4,7-8H[1] |
| Номер Бельштейна | 605970 |
| Номер Гмеліна | 2742 |
| Властивості | |
| Молекулярна формула | C6H4(OH)2[1] |
| Молярна маса | 110,1 г/моль[1] |
| Зовнішній вигляд | тверде безбарвне тіло[1] |
| Густина | 1,33 г/см3, тв.[1] |
| Тпл | 172 °C[1] |
| Ткип | 287 °C[1] |
| Розчинність (вода) | 5,4 г/100 мл (15 °C)[1], 8,3 г/100 мл (30 °C)[2] |
| Кислотність (pKa) | 10,85 (25 °C)[1] |
| Структура | |
| Дипольний момент | нуль |
| Небезпеки | |
| ГГС піктограми | 
|
| ГГС формулювання небезпек | H302, H317, H318, H341, H351, H400 |
| ГГС запобіжних заходів | P201, P202, P261, P264, P270, P272, P273, P280, P281, P301+P312, P302+P352, P305+P351+P338, P308+P313, P310, P321, P330, P333+P313, P363, P391, P405, P501 |
| Класифікація ЄС | Carc. Cat. 3 Muta. Cat. 3 |
| R-фрази | R22, R40, R41, R43, R50, R68 |
| S-фрази | S2 S26 S36/37/39 S61 |
| NFPA 704 | |
| Температура спалаху | 165 °C (закрита чаша)[1] |
| Температура самозаймання | 516 °C (закрита чаша)[1] |
| Пов'язані речовини | |
| Інші (Бензендиоли) | Пірокатехол Резорцин |
| Пов'язані речовини | 1,4-бензохінон |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Гідрохіно́н, або бензен-1,4-діо́л, або хіно́л — ароматична органічна сполука, яка належить до двоатомних фенолів, та має хімічну формулу C6H4(OH)2[3]. Ізомер пірокатехолу та резорцину. Вперше гідрохінон описисав Фрідріх Велер у 1844 році[2].
Фізичні властивості[ред. | ред. код]
Є безбарвною твердою речовиною без запаху[1]. Розчинний в етанолі, ацетоні, воді, погано розчинний в бензені та третрахлорметані[2][1].
Має три кристалічні модифікації: α, β і γ. Перша з них є стабільною і утворюється при кристалізації гідрохінону з води. Має виглядів голок. Β-модифікація утворюється при кристалізації з метанолу чи ізопропанолу. Γ-модифікація утворюється при сублімації і має вигляд призм. Інші властивості показані в таблиці[2]:
| Модифікація | Температура плавлення | Сингонія |
|---|---|---|
| Α | 173.8 – 174.8 °C | Гексагональна |
| Β | - | - |
| Γ | 169 °С | Моноклінна |
Отримання[ред. | ред. код]
Окисненням п-диізопропілбензену[ред. | ред. код]
При алкілювання бензену пропіленом можна отримти п-диізопропілбензен. Його окиснюють повітрям в слаболужному середовищі до гідропероксиду при температурі 80–90 °С. Далі до гідрпероксиду додається 0,2–1% сульфатної кислоти, яка каталізуює його розщеплення з утворенням гідрохінону та ацетону. Вихід реакції складає 80 % (починаючи з диізопропілбензену)[2]:
Гідроксилюванням фенолу[ред. | ред. код]
Гідрохінон також отримують гідроксилюванням фенолу 70 % водним розчином пероксиду водню. Реакцію проводять при температурі 80 °С в присутності каталізаторів — сильних кислот, солей заліза(II) чи кобальту(II). При цьому утворюється суміш пірокатехолу та гідрохінону[2]:
Відновлення 1,4-бензохінону[ред. | ред. код]
Гідрохінон утворюється також при відновленні 1,4-бензохінону, який отримують окисненням аніліну діоксидом марганцю в сульфатній кислоті при температурі 0-5 °С. Це найстаріший метод отримання гідрохінону[2]:
Інші методи[ред. | ред. код]
- Циклізація ацетилену з монооксидом вуглецю у присутності води[4]:
- Лужний гідроліз п-хлорофенолу[3]:
- Лужне сплавлення п-бензендисульфонової кислоти[3]:
Хімічні властивості[ред. | ред. код]
Проявляє слабкі кислотні властивості[3][5]. У лужному середовищі легко алкілюється, утворюючи етери[5]:
Окиснення[ред. | ред. код]
Гідрохінон дуже легко окиснюється, утворюючи 1,4-бензохінон[3][5]:
При взаємодії бензохінону з ще не прореагувавшим гідрохіноном утворюється хінгідрон — чорно-фіолетові кристали[3][5]:
Примітки[ред. | ред. код]
- ↑ а б в г д е ж и к л м н п р с PubChem. Hydroquinone. pubchem.ncbi.nlm.nih.gov (англ.). Архів оригіналу за 27 січня 2021. Процитовано 23 вересня 2020.
- ↑ а б в г д е ж и Hudnall, Phillip M. (15 червня 2000). Wiley-VCH Verlag GmbH & Co. KGaA (ред.). Hydroquinone. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a13_499. doi:10.1002/14356007.a13_499. ISBN 978-3-527-30673-2.
- ↑ а б в г д е Ластухін Ю. О., Воронов С. А. Органічна хімія : підручник. — Вид. 3-тє, стереотипне. — Львів : Центр Європи, 2006. — ISBN 966-7022-19-6.
- ↑ Pino, Piero; Braca, Giuseppe; Sbrana, Glauco (1964). Preparation of hydroquinone US3355503 A (PDF). Lonza Ag. Архів оригіналу (PDF) за 18 квітня 2016. Процитовано 13 червня 2022.
- ↑ а б в г Нейланд, О.Я. (1990). Органическая химия (російська) . Москва: Высшая школа. с. 325-326. ISBN 5-06-001471-1.
| Це незавершена стаття про органічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |
| |||||||||||





![{\displaystyle {\ce {C6H5OH + H2O2 ->[Fe(II)/Co(II)]HO-C6H4-OH + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e5d8eea988dd0cbc422babbb3fb646c71706ea31)




![{\displaystyle {\ce {HSO3-C6H4-SO3H + 2NaOH ->[t]HO-C6H4-OH + 2NaHSO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d19a1937d628027c0f16f471a273f915aed2245)


