ДНК-зв'язувальні білки
Ця стаття є сирим перекладом з іншої мови. Можливо, вона створена за допомогою машинного перекладу або перекладачем, який недостатньо володіє обома мовами. (квітень 2016) |

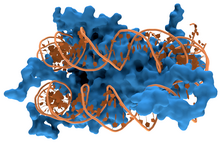


ДНК-зв’язуючі білки [3][4][5] - це Білки, які утворені з ДНК-зв’язуючих доменів, а отже мають специфічну чи загальну спорідненість до одно- або двониткових ДНК. ДНК-зв’язуючі білки, які є сайт-специфічними, в основному взаємодіють із великою борозенкою B-ДНКа, тому що вона експонує більше функціональних груп, які ідентифікуютьпару основ. Однак відомі і до малої борозни ДНК-зв’язуючі ліганди, такі як Нетропсин,[6] Дістаміцин, Hoechst 33258, Пентамідин, ДАФІ(4.6-диамідо-2-фенол-індол) та інші.[7]
ДНК-зв’язуючі Білки включають Фактори транскрипції які є генними модуляторами процесу транскрипції, різні Полімерази, Нуклеази які розрізають молекули ДНК, та Гістони які беруть участь в компресії хромосом і транскрипції в клітинному ядрі. ДНК-зв’язуючі протеїни можуть містити такі домени, як цинковий палець, «спіраль-петля-спіраль», «лейцинова застібка» (одні з багатьох), що сприяють зв’язуванні молекули до нуклеотиду.
Структурні білки, що зв’язують ДНК є добре вивченими прикладами неспецифічної ДНК-білкової взаємодії. В самій хромосомі ДНК зберігається в комплексі зі структурними білками. Ці білки впорядковують ДНК в компактну структуру під назвою Хроматин. В еукаріотів в цих структурах ДНК зв’язується з комплексом невеликих основних білківГістони, коли ж у прокаріотів залучається значна кількість протеїнів.[8][9] Гістони створюють диско-подібний комплекс під Нуклеосома, який містить два повні витки дво-ланцюгової ДНК, намотаної на її поверхні. Ці не-специфічні взаємодії формуються за рахунок основних груп в гістонах, створюючи іонні зв’язки з кислотними вуглеводно-фосфатними залишками хребта ДНК, і є, таким чином, значною мірою, незалежні від послідовності основ ДНК.[10] Хімічні модифікація цих амінокислотних залишків включає Метилювання, Фосфорилювання та Ацетилювання.[11] Ці хімічні модифікації змінюють міцність взаємодії між гістонами і ДНК, роблячи ДНК більш чи менш доступною для факторів транскрипції і змінюючи рівень транскрипції.[12] Інші не-специфічні ДНК-зв’язуючі протеїни в хроматині містять включають високо-мобільні ггрупи білків, які приєднюються, щоб натягнути чи деформувати ДНК.[13] Ці протеїни є важливими в згинанні масивів нуклеосом і впорядкування їх в більші структури, щоб утворити хромосоми.[14]
Серед ДНК-зв’язуючих білків є окрема група молекул, які специфічно зв’язують одно-ниткові молекули ДНК. В людей, реплікативний протеїн А(RPA eng.) є найбільш вивчений член цієї родини білків. Він використовується в процесі де розділяється подвійна спіраль, включаючи ДНК реплікацію, рекомбінацію і ДНК репарацію.[15] Швидше за все дані білки стабілізують одно-ниткові ДНК і захищають їх від утворення шпильок чи деградації нуклеазами.
На противагу, інші білки задіяні в зв’язуванні специфічних послідовностей. Найбільш інтенисивно вивчаються різні Фактори транскрипції, які є білками, що регулюють. Кожен транскрипційний фактор зв’язкується до однієї специфічної множини ДНК послідовностей і активує чи інгібує транскрипцію генів, які містять дані послідовності біля своїх промоуторів. Фактори транскрипції роблять це двома шляхами. По-перше, вони можуть приєднюватися до РНА-полімерази відповідальної за транскрипцію або прямо, або через інший медіаторний білок, це змінює локацію полімерази, і вона наближається до промотора, і дозволяє їй розпочати процес тракнскрипції.[16] Або ж, фактор транскрипції може зв’язувати Ферменти, що модифікують гістони біля промоторної ділянки; і це змінить рівень доступності ДНК матриці для полімерази.[17]
Так як ці ДНК-цілі можуть опинитися будь-де в людському геномі, зміна в активностьі одного типу фактора транксрипці може вплинути на тисячі генів.[18] Як наслідок, ці білки є часто мішенею для Трансдукції сигналу, процесу що контролює відповідь на зміну зовнішнього середовища чи диференціювання клітині їх розвиток. Специфічність цих факторів транскрипції взаємодії з ДНК походить від того, білки створють декілька контактів з гранями основ ДНК, що й дозволяє ім «прочитати»ДНК послідовність. Більшість цих взаємодій відбувають у великій борозенці, де основи є більше доступні.[19] Математичний опис білок-ДНК зв’язування враховує спеціфічність послідовності, конкурентність та кооперацію в процесі зв’язування білків різних типів, і зазвичай здійснюється з допомогою біофізичного.[20]
- ↑ Created from PDB 1LMB [Архівовано 6 січня 2008 у Wayback Machine.]
- ↑ Created from PDB 1RVA [Архівовано 6 січня 2008 у Wayback Machine.]
- ↑ Travers, A. A. (1993). DNA-protein interactions. London: Springer. ISBN 978-0-412-25990-6.
- ↑ Pabo CO, Sauer RT (1984). Protein-DNA recognition. Annu. Rev. Biochem. 53 (1): 293—321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ↑ Dickerson R.E. (1983). The DNA helix and how it is read. Sci Am. 249 (6): 94—111. doi:10.1038/scientificamerican1283-94.
- ↑ Zimmer C, Wähnert U (1986). Nonintercalating DNA-binding ligands: specificity of the interaction and their use as tools in biophysical, biochemical and biological investigations of the genetic material. Prog. Biophys. Mol. Biol. 47 (1): 31—112. doi:10.1016/0079-6107(86)90005-2. PMID 2422697.
- ↑ Dervan PB (April 1986). Design of sequence-specific DNA-binding molecules. Science. 232 (4749): 464—71. doi:10.1126/science.2421408. PMID 2421408.
- ↑ Sandman K, Pereira S, Reeve J (1998). Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome. Cell Mol Life Sci. 54 (12): 1350—64. doi:10.1007/s000180050259. PMID 9893710.
- ↑ Dame RT (2005). The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin. Mol. Microbiol. 56 (4): 858—70. doi:10.1111/j.1365-2958.2005.04598.x. PMID 15853876.
- ↑ Luger K, Mäder A, Richmond R, Sargent D, Richmond T (1997). Crystal structure of the nucleosome core particle at 2.8 A resolution. Nature. 389 (6648): 251—60. doi:10.1038/38444. PMID 9305837.
- ↑ Jenuwein T, Allis C (2001). Translating the histone code. Science. 293 (5532): 1074—80. doi:10.1126/science.1063127. PMID 11498575.
- ↑ Ito T (2003). Nucleosome assembly and remodelling. Curr Top Microbiol Immunol. 274: 1—22. doi:10.1007/978-3-642-55747-7_1. PMID 12596902.
- ↑ Thomas J (2001). HMG1 and 2: architectural DNA-binding proteins. Biochem Soc Trans. 29 (Pt 4): 395—401. doi:10.1042/BST0290395. PMID 11497996.
- ↑ Grosschedl R, Giese K, Pagel J (1994). HMG domain proteins: architectural elements in the assembly of nucleoprotein structures. Trends Genet. 10 (3): 94—100. doi:10.1016/0168-9525(94)90232-1. PMID 8178371.
- ↑ Iftode C, Daniely Y, Borowiec J (1999). Replication protein A (RPA): the eukaryotic SSB. Crit Rev Biochem Mol Biol. 34 (3): 141—80. doi:10.1080/10409239991209255. PMID 10473346.
- ↑ Myers L, Kornberg R (2000). Mediator of transcriptional regulation. Annu Rev Biochem. 69 (1): 729—49. doi:10.1146/annurev.biochem.69.1.729. PMID 10966474.
- ↑ Spiegelman B, Heinrich R (2004). Biological control throughs regulated transcriptional coactivators. Cell. 119 (2): 157—67. doi:10.1016/j.cell.2004.09.037. PMID 15479634.
- ↑ Li Z, Van Calcar S, Qu C, Cavenee W, Zhang M, Ren B (2003). A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells. Proc Natl Acad Sci USA. 100 (14): 8164—9. doi:10.1073/pnas.1332764100. PMC 166200. PMID 12808131.
- ↑ Pabo C, Sauer R (1984). Protein-DNA recognition. Annu Rev Biochem. 53 (1): 293—321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ↑ Teif V.B., Rippe K. (2010). Statistical-mechanical lattice models for protein-DNA binding in chromatin. Journal of Physics: Condensed Matter. arXiv:1004.5514.
- Abalone [Архівовано 7 березня 2010 у Wayback Machine.] tool for modeling DNA-ligand interactions.
- DBD database of predicted transcription factors [Архівовано 4 грудня 2008 у Wayback Machine.] Uses a curated set of DNA-binding domains to predict transcription factors in all completely sequenced genomes
- MeSH DNA-Binding+Proteins
| Це незавершена стаття з молекулярної біології. Ви можете допомогти проєкту, виправивши або дописавши її. |