Комплементарність (молекулярна біологія)
Комплементарність — чітка відповідність нуклеотидів між молекулами ДНК.
- Ця стаття обговорює загальний принцип комплементарності. Див. також статтю Комплементарна ДНК.
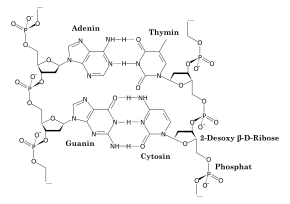
Комплементарність (у молекулярній біології і генетиці) — взаємна відповідність молекул біополімерів або їх фрагментів, що забезпечує утворення зв'язків між просторово взаємодоповнюючими (комплементарними) фрагментами молекул або їх структурних фрагментів унаслідок супрамолекулярних взаємодій (утворення водневих зв'язків, гідрофобних взаємодій, електростатичних взаємодій заряджених функціональних груп тощо).
Взаємодія комплементарних фрагментів або біополімерів не супроводжується утворенням ковалентного хімічного зв'язку між комплементарними фрагментами, проте через просторову взаємну відповідність комплементарних фрагментів приводить до утворення великої кількості відносно слабких зв'язків (водневих і ван-дер-ваальсівських) з чималою сумарною енергією, що приводить до утворення стійких молекулярних комплексів.
Разом з тим, слід зазначити, що механізм каталітичної активності ферментів визначається комплементарністю ферменту і перехідного стану або проміжного продукту каталізуємої реакції — і в цьому випадку може відбуватися оборотне утворення хімічного зв'язку.

Ліворуч — пари комплементарних нуклеотидів (водневі зв'язки позначені рисками), праворуч — два зв'язані комплементарні фрагменти ДНК, створюючих вторинну структуру; орієнтація комплементарних ланцюжків ДНК (напрями 5-3 дезоксирібозофосфатних ланцюжків) протилежні.
У разі нуклеїнових кислот — як оліго- так і полінуклеотидів — азотисті основи нуклеотидів здатні унаслідок утворення водневих зв'язків формувати парні комплекси аденін—тімін (або урацил в РНК) і гуанін—цитозин при взаємодії ланцюжків нуклеїнових кислот (тобто А-Т і Г-Ц або A-T і G-C). Така взаємодія грає ключову роль у ряді фундаментальних процесів зберігання і передачі генетичній інформації: реплікації ДНК, що забезпечує передачу генетичній інформації при клітинному поділі, транскрипції ДНК в РНК при синтезі білків, кодуванні ДНК генів, зберіганні генетичної інформації в дволанцюжковій ДНК і процесах репарації (ремонту) ДНК при її пошкодженні.
Комплементарне зв'язування багатьох ферментів і субстрату є ключовим фактором в механізмі ферментатівної активності і, на відмінність від описаних вище ситуацій з утворенням хімічно незв'язаних комплексів, може приводити до ініціації хімічної реакції — у разі зв'язку ферменту з субстратом комплементарність відносно невисока, проте при високій комплементарності до перехідного реакційного стану субстрату відбувається стабілізація цього стану, що приводить до ефекту каталітичної активності ферментів: така стабілізація перехідного стану еквівалентна зниженню енергії активації і, відповідно, різкому збільшенню швидкості реакції.
- Reverse complement tool [Архівовано 6 Листопада 2015 у Wayback Machine.]
- Reverse Complement App @ DNA.UTAH.EDU [Архівовано 22 Травня 2014 у Wayback Machine.]
| Це незавершена стаття з молекулярної біології. Ви можете допомогти проєкту, виправивши або дописавши її. |