Редагування РНК: відмінності між версіями
| [перевірена версія] | [перевірена версія] |
Немає опису редагування |
|||
| Рядок 1: | Рядок 1: | ||
'''Редагування РНК''' ({{lang-en|RNA editing, RNAe}}) — спрямована зміна окремих [[нуклеотид]]ів у [[РНК]] після [[транскрипція (біологія)|транскрипції]]<ref name=balance/>; клітинні процеси, що ведуть до модифікації РНК, яка не пов'язана із послідовністю матриці [[ДНК]] (чи РНК), з якої зчитана модифікована РНК<ref>Gott JM, Emeson RB. Functions and mechanisms of RNA editing. Annu Rev Genet 2000;34:499-531. PubMed:11092837</ref>. Іншими словами, редагування РНК визначають як таку посттранскрипційну зміну РНК, яка не є [[сплайсинг|сплайсингом]], [[кеп]]уванням, [[поліаденілювання]]м або [[деградація РНК|деградацією]]. Результатом зміни нуклеотидів у РНК можуть бути зміни послідовності аміноксилот і функції білка; поява чи зникнення сайтів сплайсингу мРНК; зміна послідовностей [[тРНК]]; відміна пригнічення [[трансляція (біологія)|трансляції]] за допомогою [[мікроРНК]]. Коливання рівня редагування РНК спостерігаються при деяких нервових захворюваннях, онкологічних та інфекційних патологіях. |
'''Редагування РНК''' ({{lang-en|RNA editing, RNAe}}) — спрямована зміна окремих [[нуклеотид]]ів у [[РНК]] після [[транскрипція (біологія)|транскрипції]]<ref name=balance/>; клітинні процеси, що ведуть до модифікації РНК, яка не пов'язана із послідовністю матриці [[ДНК]] (чи РНК), з якої зчитана модифікована РНК<ref>Gott JM, Emeson RB. Functions and mechanisms of RNA editing. Annu Rev Genet 2000;34:499-531. PubMed:11092837</ref>. Іншими словами, редагування РНК визначають як таку посттранскрипційну зміну РНК, яка не є [[сплайсинг|сплайсингом]], [[кеп]]уванням, [[поліаденілювання]]м або [[деградація РНК|деградацією]]. Результатом зміни нуклеотидів у РНК можуть бути зміни послідовності аміноксилот і функції білка; поява чи зникнення сайтів сплайсингу мРНК; зміна послідовностей [[тРНК]]; відміна пригнічення [[трансляція (біологія)|трансляції]] за допомогою [[мікроРНК]]. Коливання рівня редагування РНК спостерігаються при деяких нервових захворюваннях, онкологічних та інфекційних патологіях. |
||
== Загальнобіологічне значення == |
|||
Редагування РНК є механізмом посттранскрипційних змін РНК. Цей процес на рівні з альтернативним сплайсінгом збільшує різноманіття білків, які кодуються в ДНК, а також дозволяє розширити функціональну активність некодуючих РНК. Роль редагування РНК залежить від поширення процесу в природі. Існують різні оцінки масштабу редагування. Одразу після відкриття редагування сприймалося як рідкісне явище, характерне для протист і рослин. Натомість російський історик науки Юрій Чайковський вважає цей процес та його виникнення центральним для розуміння біологічної еволюції нарівні з реплікацією, рекомбінацією та репарацією ДНК. <ref>{{cite book|url= |author=[[Чайковський Юрій Володимирович|Ю. В. Чайковский]] |title=Эволюция |place=М |publisher=Товарищество КМК |year=2003 |pages=}}</ref>. У 2010 році американська дослідниця Мінг'яо Лі заявила, що редагуванню у ссавців підлягають більше як 95% транскриптів <ref>http://www.nature.com/news/2010/101105/full/news.2010.586.html</ref><ref>{{cite journal| title=Widespread RNA and DNA Sequence Differences in the Human Transcriptome|author=Mingyao Li, Isabel X. Wang, Yun Li, Alan Bruzel, Allison L. Richards, Jonathan M. Toung, and Vivian G. Cheung| journal=Science | volume=333 | number=6038| pages=53-58| year=2011| publisher=|doi=10.1126/science.1207018| url=http://www.sciencemag.org/content/333/6038/53}}</ref>. Надалі така оцінка піддавалася критиці молекулярних біологів<ref>{{cite journal| title=Very Few RNA and DNA Sequence Differences in the Human Transcriptome|author=Schrider DR, Gout J-F, Hahn MW| journal=PLoS ONE| volume=6| number=10| pages=| year=2011| publisher=|doi=10.1371/journal.pone.0025842| url=http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0025842}}</ref>. Тим не менш, постійно зростає кількість виявлених випадків редагування РНК, що свідчить про непересічну роль механізму. Посилене редагування РНК у мозку та імунній системі ссавців вказує на те, що ця система регуляції роботи клітини забезпечує тонку настройку процесів, пов'язаних із пам'яттю, навчанням, імунною відповіддю<ref name=mrna/>. |
|||
== Історія відкриття == |
== Історія відкриття == |
||
| Рядок 19: | Рядок 22: | ||
Найбільш поширеними серед всіх груп евкаріотичних організмів є саме нуклеотидні заміни: |
Найбільш поширеними серед всіх груп евкаріотичних організмів є саме нуклеотидні заміни: |
||
* заміна А на І (або на Г) — найчастіше відбувається шляхом дезамінування аденозину (А) з утворенням [[інозин]]у (І), нуклеозиду, який містить мінорну азотисту основу [[гіпоксантин]], що розпізнається клітинними системами (трансляції, реплікації, репарації тощо) як гуанозин (Г); реакція здійснюється ферментами |
* заміна А на І (або на Г) — найчастіше відбувається шляхом [[дезамінування]] аденозину (А) з утворенням [[інозин]]у (І), нуклеозиду, який містить мінорну азотисту основу [[гіпоксантин]], що розпізнається клітинними системами (трансляції, реплікації, репарації тощо) як гуанозин (Г); реакція здійснюється ферментами аденозин-дезаміназами |
||
* заміна Ц на У — найчастіше відбувається шляхом дезамінування цитозину (Ц) з утворенням уридину (У); реакція здійснюється ферментами цитозин-дезаміназами |
* заміна Ц на У — найчастіше відбувається шляхом дезамінування цитозину (Ц) з утворенням уридину (У); реакція здійснюється ферментами цитозин-дезаміназами |
||
* заміни Г на А, У на Ц та деякі інші описані в літературі, але механізми для них не показані<ref name=balance/>. |
* заміни Г на А, У на Ц та деякі інші описані в літературі, але механізми для них не показані<ref name=balance/>. |
||
| Рядок 25: | Рядок 28: | ||
== Системи редагування == |
== Системи редагування == |
||
=== |
=== Аденозин-дезамінази РНК === |
||
{{main| |
{{main|Аденозин-дезамінази РНК}} |
||
[[Файл:Adenosinmonophosphat protoniert.svg|міні||200пкс|Аденозинмонофосфат]][[Файл:Inosinic acid.png|міні||200пкс|Інозинмонофосфат]][[Файл:Guanosinmonophosphat protoniert.svg|міні||200пкс|Гуанозинмонофосфат]] |
|||
Аденозинамінази РНК (ADAR) являють собою родину ферментів, які, взаємодіючи з дволанцюговою РНК, відщеплюють від аденозинового нуклеотиду NH<sup>2</sup>-групу та перетворюють його на інозин. За амінокислотною послідовністю і рентгенограмами білкових кристалів вони принципово відрізняються від інших аденозиндезаміназ (ADA), що відщеплюють аміногрупу від аденозинмонофосфату (АМФ). Деяку гомологію спостерігають між генами ADAR та цитозиндезаміназ, що може свідчити про їх походження від спільного предкового гену<ref name=exon/>. |
Аденозинамінази РНК (ADAR) являють собою родину ферментів, які, взаємодіючи з дволанцюговою РНК, відщеплюють від аденозинового нуклеотиду NH<sup>2</sup>-групу та перетворюють його на інозин. За амінокислотною послідовністю і рентгенограмами білкових кристалів вони принципово відрізняються від інших аденозиндезаміназ (ADA), що відщеплюють аміногрупу від аденозинмонофосфату (АМФ). Деяку гомологію спостерігають між генами ADAR та цитозиндезаміназ, що може свідчити про їх походження від спільного предкового гену<ref name=exon/>. |
||
Білки ADAR було відкрито в кінці 1980-х років при вивченні [[гіпермутагенез]]у [[вірус]]ів [[кір|корі]]. Було показано, що при персистуванні інфекції у мозку значна кількість вірусної РНК несла велику кількість замін У на Ц<ref>Cattaneo R, Schmid A, Eschle D, Baczko K, ter Meulen V, Billeter MA. Biased hypermutation and other genetic changes in defective measles viruses in human brain infections. Cell. 1988 Oct 21;55(2):255–265.</ref>. Пізніше дослідники звернули увагу, що такі заміни відповідають мутаціям у РНК-матриці А на Г, і співвіднесли цей факт із можливою заміною А на І<ref>Bass BL, Weintraub H, Cattaneo R, Billeter MA (1989) Biased hypermutation of viral RNA genomes could be due to unwinding/modification of double-stranded RNA. Cell 56: 331</ref> Надалі було показано, що така реакція дійсно має місце, виконується аденозиндезаміназою, що є інтерферон-залежною і дезамінує аденозини у дволанцюговій РНК ({{lang-en|DRADA, '''d'''s-'''R'''NA '''a'''denosine '''d'''es'''a'''minase}})<ref>Weier, H. U. G., George, C. X., Greulich, K. M., & Samuel, C. E. (1995). The interferon-inducible, double-stranded RNA-specific adenosine deaminase gene (DSRAD) maps to human chromosome 1q21. 1–21.2. Genomics, 30(2), 372-375.</ref>. |
Білки ADAR було відкрито в кінці 1980-х років при вивченні [[гіпермутагенез]]у [[вірус]]ів [[кір|корі]]. Було показано, що при персистуванні інфекції у мозку значна кількість вірусної РНК несла велику кількість замін У на Ц<ref>Cattaneo R, Schmid A, Eschle D, Baczko K, ter Meulen V, Billeter MA. Biased hypermutation and other genetic changes in defective measles viruses in human brain infections. Cell. 1988 Oct 21;55(2):255–265.</ref>. Пізніше дослідники звернули увагу, що такі заміни відповідають мутаціям у РНК-матриці А на Г, і співвіднесли цей факт із можливою заміною А на І<ref>Bass BL, Weintraub H, Cattaneo R, Billeter MA (1989) Biased hypermutation of viral RNA genomes could be due to unwinding/modification of double-stranded RNA. Cell 56: 331</ref> Надалі було показано, що така реакція дійсно має місце, виконується аденозиндезаміназою, що є інтерферон-залежною і дезамінує аденозини у дволанцюговій РНК ({{lang-en|DRADA, '''d'''s-'''R'''NA '''a'''denosine '''d'''es'''a'''minase}})<ref>Weier, H. U. G., George, C. X., Greulich, K. M., & Samuel, C. E. (1995). The interferon-inducible, double-stranded RNA-specific adenosine deaminase gene (DSRAD) maps to human chromosome 1q21. 1–21.2. Genomics, 30(2), 372-375.</ref>. |
||
=== Цитозин-дезамінази === |
|||
=== Цитозиндезамінази === |
|||
[[Файл:DesaminierungCtoU.png|міні|праворуч|200пкс|Реакція дезамінування цитозину]] |
|||
=== Редагування РНК у протист === |
=== Редагування РНК у протист === |
||
Вставки і видалення нуклеотидів у кінетопластид відбуваються майже в усіх мітохондріальних транскриптах. Видаляються і вставляються уридинові залишки з пре-мРНК, що регулюєтся короткими ведучими РНК, які є комплементарними до вже відредагованої мРНК. Спеціальний мультибілковий комплекс розрізає пре-мРНК і вставляє або видаляє уридини в залежності від комплементарної послідовності |
Вставки і видалення нуклеотидів у кінетопластид відбуваються майже в усіх мітохондріальних транскриптах. Видаляються і вставляються уридинові залишки з пре-мРНК, що регулюєтся короткими ведучими РНК, які є комплементарними до вже відредагованої мРНК. Спеціальний мультибілковий комплекс розрізає пре-мРНК і вставляє або видаляє уридини в залежності від комплементарної послідовності гідової РНК. |
||
Інший тип вставок нуклеотидів спостерігають у мітохондріях [[слизовик]]а ''[[Physarum polycephalum]]''. Редагування у цьому випадку призводить до вставки додаткових цитозинів під час транскрипції. |
Інший тип вставок нуклеотидів спостерігають у мітохондріях [[слизовик]]а ''[[Physarum polycephalum]]''. Редагування у цьому випадку призводить до вставки додаткових цитозинів під час транскрипції. |
||
| Рядок 44: | Рядок 50: | ||
=== Точкові заміни в екзонах === |
=== Точкові заміни в екзонах === |
||
На 2013 рік відомо кілька десятків випадків редагування РНК А на І в екзонах мРНК тварин, зокрема ссавців<ref name=exon/>. Найбільший рівень редагування спостерігається у мРНК іонних каналів і рецепторів мозку, рецепторів імунної системи, білків цитоскелету, РНК-зв'язуючих білків<ref name=mrna/>. |
|||
=== Редагування повторів === |
=== Редагування повторів === |
||
| Рядок 73: | Рядок 80: | ||
=== Онкологічні захворювання === |
=== Онкологічні захворювання === |
||
Роль редагування РНК при [[рак (хвороба)|онкологічних захворюваннях]] є нез'ясованою. Вважається, що помилкова зміна нуклеотидів у мРНК і мікроРНК може призводити до інактивації [[супресор|супресорів]] пухлин або до активації [[протоонкогени|протоонкогенів]]. |
|||
Порушення редагування мРНК спостерігаються при деяких типах раку. Загальний рівень редагування РНК знижується, особливо при [[астроцитома]]х та [[гліома]]х. При [[гострий мієлоїдний лейкоз|гострому мієлоїдному лейкозі]] виявлено неправильне редагування мРНК, що викликає неканонічний сплайсинг та утворення нефункціонального білку тирозинової кінази PTPN6. При дослідженні [[рак молочної залози|раку молочної залози]] виявлено групу нових сайтів редагування мРНК, хоча ці сайти редагувалися і в нормальних клітинах. |
|||
Також виявлено вплив замін А на І у мікроРНК, наприклад, зменшення редагування мікроРНК-376 спостерігалося при [[рак підшлункової залози|раку підшлункової залози]], а мікроРНК-142 - при [[лейкемія|лейкемії]]<ref name=balance/>. |
|||
=== Інфекційні захворювання === |
=== Інфекційні захворювання === |
||
Білки ADAR1 і APOBEC є активними регуляторами антивірусного імунітету. Вони активуються інтерфероном та здатні редагувати як РНК так і ДНК вірусів, блокуючи їх розмноження ще з цитоплазми. Вірогідно, аденозин-дезамінази є також супресорами антивірусної відповіді, тому деякі віруси здатні використовувати ADAR1 для блокування апоптозу й імунної відповіді, зокрема [[ВІЛ]], [[кір|вірус кору]], вірус [[везикулярний стоматит|везикулярного стоматиту]]<ref name=balance/>. |
|||
== Редагування РНК і еволюція == |
== Редагування РНК і еволюція == |
||
| Рядок 85: | Рядок 98: | ||
<ref name=balance>{{cite journal| title= Molecular diversity through RNA editing: a balancing act | author=Farajollahi, Sanaz and Maas, Stefan | journal=Trends in Genetics | volume=26| number=5 |pages=221-230 | year= 2010 |publisher= Elsevier |URL = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2865426/}}</ref> |
<ref name=balance>{{cite journal| title= Molecular diversity through RNA editing: a balancing act | author=Farajollahi, Sanaz and Maas, Stefan | journal=Trends in Genetics | volume=26| number=5 |pages=221-230 | year= 2010 |publisher= Elsevier |URL = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2865426/}}</ref> |
||
<ref name=oposs>{{cite journal| title=RNA editing changes the identity of a mitochondrial tRNA in marsupials.|author=Börner, GV and Mörl, M and Janke, Axel and Pääbo, S| journal=The EMBO journal | volume=15 | number=21| pages=5949| year=1996| publisher=Nature Publishing Group}}</ref> |
<ref name=oposs>{{cite journal| title=RNA editing changes the identity of a mitochondrial tRNA in marsupials.|author=Börner, GV and Mörl, M and Janke, Axel and Pääbo, S| journal=The EMBO journal | volume=15 | number=21| pages=5949| year=1996| publisher=Nature Publishing Group}}</ref> |
||
<ref name=exon>Gommans, |
<ref name=exon> {{Citation | last = Willemijn M. Gommans, Dylan E. Dupuis, Jill E. McCane, Nicholas E. Tatalias, Stefan Maas | first = | contribution = Diversifying Exon Code through A-to-I RNA Editing | year = 2008 | title = DNA RNA Editing | editor-last = Smith, H. | editor-first = | volume = | pages = 3-30 | place = | publisher = Wiley & Sons, Inc | id = }}</ref> |
||
<ref name=mrna>{{cite journal| title=Proteome diversification by adenosine to inosine RNA-editing|author=Pullirsch D, Jantsch MF| journal=RNA Biol | volume=7 | number=| pages=1-8| year=2010| publisher=}}</ref> |
|||
}} |
}} |
||
== Інформація українською == |
== Інформація українською == |
||
* {{cite book|url=http://www.biol.univ.kiev.ua/public/pidruch/MolBiol_sivolob.pdf |author=[[Сиволоб Андрій Володимирович|А. В. Сиволоб]] |title=Молекулярна біологія |place=К |publisher=Видавничо-поліграфічний центр «Київський університет» |year=2008 |pages=194}} |
|||
* http://www.franko.lviv.ua/faculty/biologh/wis/38/1/5/5.pdf |
* http://www.franko.lviv.ua/faculty/biologh/wis/38/1/5/5.pdf |
||
* http://nauka.in.ua/news/short/article_detail/7314 |
* http://nauka.in.ua/news/short/article_detail/7314 |
||
Версія за 23:54, 29 вересня 2013
Редагування РНК (англ. RNA editing, RNAe) — спрямована зміна окремих нуклеотидів у РНК після транскрипції[1]; клітинні процеси, що ведуть до модифікації РНК, яка не пов'язана із послідовністю матриці ДНК (чи РНК), з якої зчитана модифікована РНК[2]. Іншими словами, редагування РНК визначають як таку посттранскрипційну зміну РНК, яка не є сплайсингом, кепуванням, поліаденілюванням або деградацією. Результатом зміни нуклеотидів у РНК можуть бути зміни послідовності аміноксилот і функції білка; поява чи зникнення сайтів сплайсингу мРНК; зміна послідовностей тРНК; відміна пригнічення трансляції за допомогою мікроРНК. Коливання рівня редагування РНК спостерігаються при деяких нервових захворюваннях, онкологічних та інфекційних патологіях.
Загальнобіологічне значення
Редагування РНК є механізмом посттранскрипційних змін РНК. Цей процес на рівні з альтернативним сплайсінгом збільшує різноманіття білків, які кодуються в ДНК, а також дозволяє розширити функціональну активність некодуючих РНК. Роль редагування РНК залежить від поширення процесу в природі. Існують різні оцінки масштабу редагування. Одразу після відкриття редагування сприймалося як рідкісне явище, характерне для протист і рослин. Натомість російський історик науки Юрій Чайковський вважає цей процес та його виникнення центральним для розуміння біологічної еволюції нарівні з реплікацією, рекомбінацією та репарацією ДНК. [3]. У 2010 році американська дослідниця Мінг'яо Лі заявила, що редагуванню у ссавців підлягають більше як 95% транскриптів [4][5]. Надалі така оцінка піддавалася критиці молекулярних біологів[6]. Тим не менш, постійно зростає кількість виявлених випадків редагування РНК, що свідчить про непересічну роль механізму. Посилене редагування РНК у мозку та імунній системі ссавців вказує на те, що ця система регуляції роботи клітини забезпечує тонку настройку процесів, пов'язаних із пам'яттю, навчанням, імунною відповіддю[7].
Історія відкриття

У 1986 році голандська група біохіміків під керівництвом професора Жака ван Бома[8] з Лейденського університету опублікувала у журналі Cell дослідження мітохондріальних РНК одного з видів трипаносом[9]. Дослідники виявили, що білок цитохром-оксидази ІІ відрізняється від передбачуваного продукту свого гену, починаючи з 170ого амінокислотного залишку. Оскільки цей ген є висококонсервативним між різними видами трипаносом, вчені припустили, що він є функціонально важливим. Виявилось, що мРНК, яка зчитується з цього гену, має 4 додатково вставлені урацилові нуклеотиди, що й зсувало рамку зчитування триплетного коду. Голандські дослідники постулювали, що ці нуклеотиди вставляються після або під час транскрипції і є наслідком невідомого процесу, який вони назвали «редагуванням РНК».
Мітохондрії кінетопластид є унікальними органелами, тому голандці були дуже обережні в екстраполяції свого відкриття на інші організми. Надалі виявилось, що більшість мітохондріальних мРНК трипаносом підлягають редагуванню із вставлянням чи видаленням урацилів.
Але вже 1987 року подібне явище було виявлено у людини. Група американських вчених з Техасу досліджувала білок аполіпопротеїн B, що існує у двох формах: ApoB-100 і ApoB-48[10]. Перша ізоформа співпадала за амінокислотною послідовністю із теоретично передбаченої з нуклеотидів гену ApoB, тоді як інша, менша за розміром, мала антигенні властивості N-кінцевої ділянки першої, хоча сильно відрізнялася за функцією. Більша форма ApoB-100 синтезується у печінці і відповідає за обмін ліпідів, перебуваючи у складі ліпопротеїдів великої і низької щільності у плазмі крові. Менша форма ApoB-48 секретується клітинами тонкого кишечнику. Аналіз мРНК у печінці і кишечнику виявив наявність повних транскриптів гену ApoB, але у кишечнику в 6457 положенні цитозин був замінений на урацил. Така заміна перетворювала кодон ЦАА, що кодує амінокислоту глутамін, на триплет УАА, що є одним зі стоп-кодонів. Це призводило до припинення на цьому місці трансляції білку й утворення вкороченої молекули ApoB-48. Автори дослідження не знали про роботу голандських біохіміків на трипаносомах, тому висунули гіпотезу про відкриття унікального механізму зміни транскрипції. В подальшому було описано цілу систему дезамінування цитозинів у мРНК після транскрипції.
Третьою історичною віхою, що дозволила створити цілісне уявлення про процес редагування РНК, стала опублікована 1991 року в журналі Cell наукова праця німецької групи нейробіологів з Гейдельберзького університету, які досліджували глутаматні рецептори[11]. Електрофізіологічні експерименти показали, що існує два функціональних типи глутаматних рецепторів у мозку ссавців: такі, які пропускають лише іони натрію, та проникні як для іонів натрію, так і для кальцію. Селективність AMPA- і каїнатних глутаматних рецепторів забезпечується залишком аргініну або глутаміну у локусі на другому трансмембранному сегменті пептидного ланцюга. Дослідники виявили наявність як аргінінового, так і глутамінового кодону в мРНК глутаматних рецепторів, тоді як їхні гени містять лише триплети глутаміну. Ця заміна являла собою появу гуанінового нуклеотиду замість аденінового, тобто А змінювалося на Г. Неспівпадіння між геномною ДНК і мРНК було пояснено саме явищем редагування РНК, до якого німецькі науковці вперше включили і нуклеотидні вставки у мітохондріях трипаносом, і появу стоп-кодону у аполіпопротеїні B. Це відкриття дало поштовх для дослідження системи аденін-дезаміназ і всього різноманіття механізмів редагування РНК.
Типи редагування
До відкриття нових сайтів редагування призводить накопичення інформації про послідовності ДНК і кДНК живих організмів. Все кращі методи секвенування ДНК дозволяють отримати послідовність нуклеотидів, що містить мінімум помилок, а порівняння сиквенсу геномної ДНК і мРНК дає змогу знайти неспівпадіння між цими послідовностями. У передгеномну еру такі неспівпадіння пояснювали методичними помилками, але нові підходи «глибокого» багаторазового читання геномів і транскриптомів зводять можливі похибки до мінімуму. Таким чином, дослідження редагування РНК відбувається спочатку за результатом редагування у РНК, а вже потім вивчаються механізми редагування. Тому для деяких типів редагування досі не описано молекулярних систем.
За якістю змін у послідовності РНК розрізняють такі типи редагування:
- вставки (інсерції) нуклеотидів
- видалення (делеції) нуклеотидів
- заміни нуклеотидів, що не призводять до зсуву рамки зчитування та не впливають на кількість нуклеотидів у РНК
Найбільш поширеними серед всіх груп евкаріотичних організмів є саме нуклеотидні заміни:
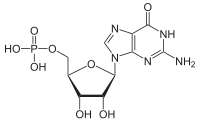
- заміна А на І (або на Г) — найчастіше відбувається шляхом дезамінування аденозину (А) з утворенням інозину (І), нуклеозиду, який містить мінорну азотисту основу гіпоксантин, що розпізнається клітинними системами (трансляції, реплікації, репарації тощо) як гуанозин (Г); реакція здійснюється ферментами аденозин-дезаміназами
- заміна Ц на У — найчастіше відбувається шляхом дезамінування цитозину (Ц) з утворенням уридину (У); реакція здійснюється ферментами цитозин-дезаміназами
- заміни Г на А, У на Ц та деякі інші описані в літературі, але механізми для них не показані[1].
Системи редагування
Аденозин-дезамінази РНК


Аденозинамінази РНК (ADAR) являють собою родину ферментів, які, взаємодіючи з дволанцюговою РНК, відщеплюють від аденозинового нуклеотиду NH2-групу та перетворюють його на інозин. За амінокислотною послідовністю і рентгенограмами білкових кристалів вони принципово відрізняються від інших аденозиндезаміназ (ADA), що відщеплюють аміногрупу від аденозинмонофосфату (АМФ). Деяку гомологію спостерігають між генами ADAR та цитозиндезаміназ, що може свідчити про їх походження від спільного предкового гену[12].
Білки ADAR було відкрито в кінці 1980-х років при вивченні гіпермутагенезу вірусів корі. Було показано, що при персистуванні інфекції у мозку значна кількість вірусної РНК несла велику кількість замін У на Ц[13]. Пізніше дослідники звернули увагу, що такі заміни відповідають мутаціям у РНК-матриці А на Г, і співвіднесли цей факт із можливою заміною А на І[14] Надалі було показано, що така реакція дійсно має місце, виконується аденозиндезаміназою, що є інтерферон-залежною і дезамінує аденозини у дволанцюговій РНК (англ. DRADA, ds-RNA adenosine desaminase)[15].
Цитозин-дезамінази

Редагування РНК у протист
Вставки і видалення нуклеотидів у кінетопластид відбуваються майже в усіх мітохондріальних транскриптах. Видаляються і вставляються уридинові залишки з пре-мРНК, що регулюєтся короткими ведучими РНК, які є комплементарними до вже відредагованої мРНК. Спеціальний мультибілковий комплекс розрізає пре-мРНК і вставляє або видаляє уридини в залежності від комплементарної послідовності гідової РНК.
Інший тип вставок нуклеотидів спостерігають у мітохондріях слизовика Physarum polycephalum. Редагування у цьому випадку призводить до вставки додаткових цитозинів під час транскрипції.
Редагування У на Ц
Процес, характерний здебільшого для мітохондрій і хлоропластів антоцеротовидних мохів і папоротей. Крім того, задокументовано подібні випадки у РНК-транскриптів, що кодують бомбезин-подібні нейропептиди у амфібій, гені WT1 ссавців. Механізми такої заміни невідомі, але припускають, що він може бути подібним до реакції, яка каталізується ферментом ссавців ЦТФ-синтазою, піридоксин-залежним ензимом, що грає ключову роль у метаболізмі нуклеотидів, переносячи аміногрупу з глутаміну до УТФ для синтезу ЦТФ.
Мішені редагування
Точкові заміни в екзонах
На 2013 рік відомо кілька десятків випадків редагування РНК А на І в екзонах мРНК тварин, зокрема ссавців[12]. Найбільший рівень редагування спостерігається у мРНК іонних каналів і рецепторів мозку, рецепторів імунної системи, білків цитоскелету, РНК-зв'язуючих білків[7].
Редагування повторів
МікроРНК
Транспортні РНК
Транспортні РНК мають цілий набір змінених нуклеотидів із мінорними азотистими основами у складі (таких нуклеотидів у тРНК зустрічається 79 типів). Редагування тРНК замінює нуклеотиди в антикодоні на каноничні плюс інозин. Такі заміни показані для Acanthamoeba, Spizellomyces, слизовиків, сумчастих, наземних рослин, равликів, восьминогів, лейшманій, бактерій. Наприклад, у опосума редагування антикодону «аспартатної» тРНК у мітохондріях призводить до її здатності приєднувати гліцин[16]. Редагування створює також необхідні елементи для утворення вторинної, третинної і четвертинної структури тРНК, включаючи петлі і спарені нуклеотиди шпильок. Це здійснюється за рахунок як вставок/видалень, так і шляхом заміни нуклетидів.
Для дезамінування аденозину у тРНК існує окрема підродина ферментів ADAT, аденозиндезаміназ транспортних РНК.
Еволюція систем редагування
Згідно з сучасними уявленнями, системи редагування РНК мають поліфілетичне походження.[17]. Білки родин ADAR і AID/APOBEC вірогідно походять від предкового білку з родини ADAT, який виконував функцію редагування тРНК.
Редагування РНК і патологія
Нервові захворювання
Онкологічні захворювання
Роль редагування РНК при онкологічних захворюваннях є нез'ясованою. Вважається, що помилкова зміна нуклеотидів у мРНК і мікроРНК може призводити до інактивації супресорів пухлин або до активації протоонкогенів.
Порушення редагування мРНК спостерігаються при деяких типах раку. Загальний рівень редагування РНК знижується, особливо при астроцитомах та гліомах. При гострому мієлоїдному лейкозі виявлено неправильне редагування мРНК, що викликає неканонічний сплайсинг та утворення нефункціонального білку тирозинової кінази PTPN6. При дослідженні раку молочної залози виявлено групу нових сайтів редагування мРНК, хоча ці сайти редагувалися і в нормальних клітинах.
Також виявлено вплив замін А на І у мікроРНК, наприклад, зменшення редагування мікроРНК-376 спостерігалося при раку підшлункової залози, а мікроРНК-142 - при лейкемії[1].
Інфекційні захворювання
Білки ADAR1 і APOBEC є активними регуляторами антивірусного імунітету. Вони активуються інтерфероном та здатні редагувати як РНК так і ДНК вірусів, блокуючи їх розмноження ще з цитоплазми. Вірогідно, аденозин-дезамінази є також супресорами антивірусної відповіді, тому деякі віруси здатні використовувати ADAR1 для блокування апоптозу й імунної відповіді, зокрема ВІЛ, вірус кору, вірус везикулярного стоматиту[1].
Редагування РНК і еволюція
Джерела
- ↑ а б в г Farajollahi, Sanaz and Maas, Stefan (2010). Molecular diversity through RNA editing: a balancing act. Trends in Genetics. Elsevier. 26 (5): 221—230.
- ↑ Gott JM, Emeson RB. Functions and mechanisms of RNA editing. Annu Rev Genet 2000;34:499-531. PubMed:11092837
- ↑ Ю. В. Чайковский (2003). Эволюция. М: Товарищество КМК.
- ↑ http://www.nature.com/news/2010/101105/full/news.2010.586.html
- ↑ Mingyao Li, Isabel X. Wang, Yun Li, Alan Bruzel, Allison L. Richards, Jonathan M. Toung, and Vivian G. Cheung (2011). Widespread RNA and DNA Sequence Differences in the Human Transcriptome. Science. 333 (6038): 53—58. doi:10.1126/science.1207018.
- ↑ Schrider DR, Gout J-F, Hahn MW (2011). Very Few RNA and DNA Sequence Differences in the Human Transcriptome. PLoS ONE. 6 (10). doi:10.1371/journal.pone.0025842.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Pullirsch D, Jantsch MF (2010). Proteome diversification by adenosine to inosine RNA-editing. RNA Biol. 7: 1—8.
- ↑ http://www.research.leiden.edu/famous/boom.html
- ↑ Rob Benne, Janny Van Den Burg, Just P.J. Brakenhoff, Paul Sloof, Jacques H. Van Boom, Marijke C. Tromp, Major transcript of the frameshifted coxll gene from trypanosome mitochondria contains four nucleotides that are not encoded in the DNA, Cell, Volume 46, Issue 6, 12 September 1986, Pages 819–826, ISSN 0092-8674, http://dx.doi.org/10.1016/0092-8674(86)90063-2.
- ↑ Chen, SH and Habib, G and Yang, CY and Gu, ZW and Lee, BR and Weng, SA and Silberman and Cai, SJ and Deslypere, JP and Rosseneu, M and et, al. (1987). Apolipoprotein B-48 is the product of a messenger RNA with an organ-specific in-frame stop codon. Science. 238 (4825): 363—366. arXiv:http://www.sciencemag.org/content/238/4825/363.full.pdf. doi:10.1126/science.3659919.
{{cite journal}}: Перевірте значення|arxiv=(довідка) - ↑ Bernd Sommer and Martin Köhler and Rolf Sprengel and Peter H. Seeburg (1991). RNA editing in brain controls a determinant of ion flow in glutamate-gated channels. Cell. 67 (1): 11—19. doi:http://dx.doi.org/10.1016/0092-8674(91)90568-J. ISSN 0092-8674.
{{cite journal}}: Перевірте значення|doi=(довідка) - ↑ а б Willemijn M. Gommans, Dylan E. Dupuis, Jill E. McCane, Nicholas E. Tatalias, Stefan Maas (2008), Diversifying Exon Code through A-to-I RNA Editing, у Smith, H. (ред.), DNA RNA Editing, Wiley & Sons, Inc, с. 3—30
- ↑ Cattaneo R, Schmid A, Eschle D, Baczko K, ter Meulen V, Billeter MA. Biased hypermutation and other genetic changes in defective measles viruses in human brain infections. Cell. 1988 Oct 21;55(2):255–265.
- ↑ Bass BL, Weintraub H, Cattaneo R, Billeter MA (1989) Biased hypermutation of viral RNA genomes could be due to unwinding/modification of double-stranded RNA. Cell 56: 331
- ↑ Weier, H. U. G., George, C. X., Greulich, K. M., & Samuel, C. E. (1995). The interferon-inducible, double-stranded RNA-specific adenosine deaminase gene (DSRAD) maps to human chromosome 1q21. 1–21.2. Genomics, 30(2), 372-375.
- ↑ Börner, GV and Mörl, M and Janke, Axel and Pääbo, S (1996). RNA editing changes the identity of a mitochondrial tRNA in marsupials. The EMBO journal. Nature Publishing Group. 15 (21): 5949.
- ↑ Gray, Michael W. (2012). Evolutionary Origin of RNA Editing. Biochemistry. 51 (26): 5235—5242. arXiv:http://pubs.acs.org/doi/pdf/10.1021/bi300419r. doi:10.1021/bi300419r.
{{cite journal}}: Перевірте значення|arxiv=(довідка)
Інформація українською
- А. В. Сиволоб (2008). Молекулярна біологія (PDF). К: Видавничо-поліграфічний центр «Київський університет». с. 194.
- http://www.franko.lviv.ua/faculty/biologh/wis/38/1/5/5.pdf
- http://nauka.in.ua/news/short/article_detail/7314
- http://castme.org/novnauk/7477-mikrornk-tezh-piddayutsya-redaguvannyu