Користувач:Aryl Halide/Тетразол
| 1H-тетразол | |
 | |
| Загальні | |
|---|---|
| Фізичні властивості | |
| Молярна маса | 70.05 г/моль |
| Термічні властивості | |
Тетразоли — це клас синтетичних органічних гетероциклічних сполук, що складаються з 5-членного кільця з чотирьох атомів азоту та одного атома вуглецю. Назва тетразол також відноситься до вихідної сполуки з формулою CH2N4, з якої можуть бути складені три ізомери.
Структура та зв'язки[ред. | ред. код]
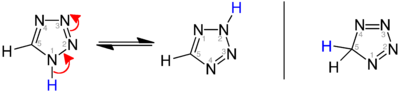
Існують три ізомери вихідного тетразолу, що відрізняються положенням подвійних зв’язків: 1H-, 2H- і 5H-тетразол. 1H- і 2H-ізомери є таутомерами, рівновага яких лежить на стороні 1H-тетразолу в твердій фазі.[1] [2] [3] У газовій фазі домінує 2H-тетразол. [2] [4] [5] Ці ізомери можна вважати ароматичними з 6 π-електронами, тоді як 5H-ізомер неароматичний.
Синтез[ред. | ред. код]
1H-тетразол вперше був отриманий реакцією безводної гідразойної кислоти та ціаністого водню під тиском. Обробка органічних нітрилів азидом натрію в присутності йоду або бісульфату натрію на основі кремнезему як гетерогенного каталізатора забезпечує вигідний синтез 5-заміщених 1H-тетразолів. Іншим методом є дезамінування 5-амінотетразолу, який може бути комерційно придбаний або отриманий у свою чергу з аміногуанідину.[6] [7]
2-Арил-2Н-тетразоли синтезуються реакцією [3+2] циклоприєднання між арилдіазонієм і триметилсилілдіазометаном.[8]
Існує кілька фармацевтичних засобів, які є тетразолами. Тетразоли можуть діяти як біоізостери для карбоксилатних груп, оскільки вони мають подібний рКа і депротонуються при фізіологічному рН. Блокатори рецепторів ангіотензину II, такі як лозартан і кандесартан, часто є тетразолами. Добре відомим тетразолом є диметил тіазоліл дифеніл тетразолій бромід (МТТ). Цей тетразол використовується в аналізі МТТ для кількісної оцінки дихальної активності культури живих клітин, хоча зазвичай він вбиває клітини в процесі. Деякі тетразоли також можна використовувати в аналізах ДНК.[9] Дослідження показують, що VT-1161 і VT-1129 є потенційно потужними протигрибковими препаратами, оскільки вони порушують ферментативну функцію грибків, але не ферменти людини.[10][11]
Деякі похідні тетразолу з високою енергією були досліджені як високоефективні вибухові речовини як заміна тротилу, а також для використання у високоефективних складах твердого ракетного палива.[12][13] До них відносяться азидотетразоляти азотистих основ.
Інші тетразоли використовуються через їх вибухові або горючі властивості, такі як сам тетразол і 5-амінотетразол, які іноді використовуються як компонент газогенераторів в автомобільних подушках безпеки . Енергетичні матеріали на основі тетразолу виробляють високотемпературні, нетоксичні продукти реакції, такі як вода та газоподібний азот, [14] і мають високу швидкість горіння та відносну стабільність, [15] всі з яких є бажаними властивостями. Енергія делокалізації в тетразолі дорівнює 209 кДж/моль.
Споріднені гетероцикли[ред. | ред. код]
- Триазоли, аналоги з трьома атомами азоту
- Пентазол, аналог з п'ятьма атомами азоту (суворо кажучи, неорганічний гомоцикл, а не гетероцикл)
- Оксатетразол
- Тіатетразол
[[Категорія:Азоли]] [[Категорія:Нітрогеновмісні гетероциклічні сполуки]] [[Категорія:Сторінки, які використовують складаний список з background та text-align у titlestyle]]
- ↑ Goddard, R.; Heinemann, O.; Krüger, C. (15 травня 1997). α-1H-1,2,3,4-Tetrazole. Acta Crystallographica Section C (англ.). 53 (5): 590—592. doi:10.1107/S0108270197000772. ISSN 0108-2701.
- ↑ а б Kiselev, Vitaly G.; Cheblakov, Pavel B.; Gritsan, Nina P. (10 березня 2011). Tautomerism and Thermal Decomposition of Tetrazole: High-Level ab Initio Study. The Journal of Physical Chemistry A. 115 (9): 1743—1753. Bibcode:2011JPCA..115.1743K. doi:10.1021/jp112374t. ISSN 1089-5639. PMID 21322546.
- ↑ Razynska, A.; Tempczyk, A.; Malinski, E.; Szafranek, J.; Grzonka, Z.; Hermann, P.: in J. Chem.
- ↑ Wong, Ming Wah; Leung-Toung, Regis; Wentrup, Curt (1 березня 1993). Tautomeric equilibrium and hydrogen shifts of tetrazole in the gas phase and in solution. Journal of the American Chemical Society. 115 (6): 2465—2472. doi:10.1021/ja00059a048. ISSN 0002-7863.
- ↑ Rażyńska, Anna; Tempczyk, Anna; Maliński, Edmund; Szafranek, Janusz; Grzonka, Zbigniew; Hermann, Peter (1 січня 1983). Application of mass spectrometry to the study of prototropic equilibria in 5-substituted tetrazoles in the gas phase; experimental evidence and theoretical considerations. Journal of the Chemical Society, Perkin Transactions 2 (англ.) (3): 379—383. doi:10.1039/P29830000379. ISSN 1364-5471.
- ↑ Henry, Ronald A.; Finnegan, William G. (1 січня 1954). An Improved Procedure for the Deamination of 5-Aminotetrazole. Journal of the American Chemical Society. 76 (1): 290—291. doi:10.1021/ja01630a086. ISSN 0002-7863.
- ↑ Kurzer, F.; Godfrey, L. E. A. (1963). Syntheses of Heterocyclic Compounds from Aminoguanidine. Angewandte Chemie International Edition in English (англ.). 2 (8): 459—476. doi:10.1002/anie.196304591. ISSN 1521-3773.
- ↑ Patouret, Remi; Kamenecka, Theodore M. (6 квітня 2016). Synthesis of 2-aryl-2H-tetrazoles via a regioselective [3+2] cycloaddition reaction. Tetrahedron Letters. 57 (14): 1597—1599. doi:10.1016/j.tetlet.2016.02.102. PMC 4810784. PMID 27041776.
- ↑ S Berner; K Mühlegger; H Seliger (Feb 11, 1989). Studies on the role of tetrazole in the activation of phosphoramidites. Nucleic Acids Res. 17 (3): 853—864. doi:10.1093/nar/17.3.853. PMC 331708. PMID 2922273.
- ↑ Warrilow, A. G. S.; Hull, C. M.; Parker, J. E.; Garvey, E. P.; Hoekstra, W. J.; Moore, W. R.; Schotzinger, R. J.; Kelly, D. E.; Kelly, S. L. (December 2014). The Clinical Candidate VT-1161 Is a Highly Potent Inhibitor of Candida albicans CYP51 but Fails To Bind the Human Enzyme. Antimicrobial Agents and Chemotherapy. 58 (12): 7121—7127. doi:10.1128/AAC.03707-14. PMC 4249504. PMID 25224009.
- ↑ Lockhart, Shawn R.; Fothergill, Annette W.; Iqbal, Naureen; Bolden, Carol B.; Grossman, Nina T.; Garvey, Edward P.; Brand, Stephen R.; Hoekstra, William J.; Schotzinger, Robert J. (April 2016). The Investigational Fungal Cyp51 Inhibitor VT-1129 Demonstrates Potent Activity against Cryptococcus neoformans and Cryptococcus gattii. Antimicrobial Agents and Chemotherapy. 60 (4): 2528—2531. doi:10.1128/AAC.02770-15. PMC 4808209. PMID 26787697.
- ↑ Greener explosives show promise. Chemistry World. 2 October 2008.
- ↑ Niko Fischer, Konstantin Karaghiosoff, Thomas M. Klapötke and Jörg Stierstorfer (April 2010). New Energetic Materials featuring Tetrazoles and Nitramines – Synthesis, Characterization and Properties. Zeitschrift für Anorganische und Allgemeine Chemie. 636 (5): 735—749. doi:10.1002/zaac.200900521.
- ↑ Tore Brinck, Thomas M. Klapötke and Jörg Stierstorfer (2014). Energetic Tetrazole N-oxides. Energetic Tetrazole N -oxides. с. 133—178. doi:10.1002/9781118676448.ch06. ISBN 9781118676448.
{{cite book}}: Проігноровано|journal=(довідка) - ↑ Nicholas Piekiel; Michael R. Zachariah (2012). Decomposition of Aminotetrazole Based Energetic Materials under High Heating Rate Conditions. J. Phys. Chem. A. 116 (6): 1519—1526. Bibcode:2012JPCA..116.1519P. doi:10.1021/jp203957t. PMID 22214278.