Оксид арсену(III)
| Оксид арсену(III) Білий миш'як | |
|---|---|

| |
| Ідентифікатори | |
| Номер CAS | 1327-53-3 |
| Номер EINECS | 215-481-4 |
| DrugBank | 01169 |
| KEGG | D02106 |
| Назва MeSH | D01.075.038 і D01.650.550.125 |
| ChEBI | 30621 |
| RTECS | CG3325000 |
| Код ATC | L01XX27 |
| SMILES | O=[As]O[As]=O[1] |
| InChI | InChI=1S/As2O3/c3-1-5-2-4 |
| Номер Гмеліна | 35185 |
| Властивості | |
| Молекулярна формула | As2O3 |
| Молярна маса | 197.841 |
| Густина | 3.74 |
| Небезпеки | |
| ГДК (Україна) | 0.01 мг/м³ |
| ЛД50 | 14,6 мг/кг (пацюки, орально) |
| Головні небезпеки | надзвичайно токсичний |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Оксид арсену(III) — неорганічна сполука з хімічною формулою As2O3, що є цінною хімічною сировиною для отримання інших похідних арсену, зокрема арсеновмісних органічних сполук.
Валовий обсяг виробництва в світі — 50 000 т/рік[2] . Однак безпека його застосування в багатьох галузях сумнівна через високу токсичність.
Отримання і властивості[ред. | ред. код]
Оксид арсену(III) можна отримати багатьма способами, зокрема окисленням (горінням) арсену і його похідних на повітрі. Показова реакція розкладу аурипігменту, сульфіду арсену :
Більшість, однак, є побічним продуктом інших виробництв — золотодобування й отримання міді, де він виділяється під час прожарення на повітрі, що призводило до численних масових отруєнь[3]. Нині інтенсивний видобуток арсенових руд ведеться тільки в Китаї[2].
Оксид миш'яку(III) є амфотерним оксидом, його розчин має слабокислу реакцію. У лужних розчинах утворює арсеніти, в концентрованій хлоридній кислоті дає хлорид арсену(III).
Тільки деякі окислювачі — озон, пероксид водню, нітратна кислота — здатні перетворити його на оксид арсену(V) As2O5 або — при зниженні концентрації — арсин (AsH3), залежно від умов реакції.
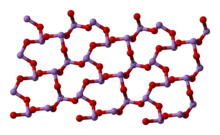
Структура[ред. | ред. код]
У рідкому й газоподібному (до 800 °C) станах має формулу As4O6 (у формі димеру) і ізоструктурний P4O6. При нагріванні понад 800 °C As4O6 розпадається на молекули As2O3, схожий за будовою з N2O3. У твердому стані співіснують три поліморфних форми: кубічний молекулярний As4O6 і дві полімерні форми. Полімери, що утворюють при охолодженні монокристали, нагадують пірамідальну структуру AsO3 зі спільними атомами кисню.[4]

|

|
|
(кубічна) |
(моноклінна) |
(моноклінна) |
Використання[ред. | ред. код]
Оксид арсену(III) використовується для виготовлення кольорового скла, також застосовується в лісохімії й електротехніці напівпровідників[2], отримання чистого арсену та його сполук, таких як какодилат натрію і арсенід натрію.
У сполуці з ацетатом міді(II)[2] триоксид утворює барвник — паризьку зелень, яку нині не використовують через надзвичайну токсичність.
Застосування в медицині[ред. | ред. код]
Використовується з найдавніших часів у китайській медицині[5], а також (від XIX століття) в гомеопатії. У конвенційній медицині триоксид арсену використовують для лікування злоякісних пухлин, таких як лейкемія, проте, зважаючи на високі ризики його застосування, перевагу надають іншим препаратам[6][7][8].
Також триоксид арсену успішно лікує автоімунні захворювання[9], взаємодіє з ферментом тіоредоксинова редуктаза[10].
Виявлення в природі[ред. | ред. код]
As2O3 міститься в арсеноліті й клаудетиті.
Токсикологія[ред. | ред. код]

Оксид арсену(III) отруйний. Токсичність триоксиду стала легендарною і широко описана в літературі[11][12][13].
В Австрії жили «миш'якоїди», які одержували дози, що в багато разів перевищують смертельну, без особливої шкоди для здоров'я. Вважається, що миш'як підвищує працездатність, особливо під час роботи на великих висотах[14][15][16].
ГДК для неорганічних сполук арсену, включно з As2O3, становить 0.01 мг/м³.
Напівлетальна доза — 19,1 мг/кг.
Примітки[ред. | ред. код]
- ↑ MFCD00003433
- ↑ а б в г Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf «Arsenic and Arsenic Compounds» in Ullmann's Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim.(англ.)
- ↑ Giant Mine - Northwest Territories Region - Indian and Northern Affairs Canada. Архів оригіналу за 2 квітня 2012. Процитовано 28 серпня 2007.(англ.)
- ↑ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Marcel Gielen, Edward R. T. Tiekink. Metallotherapeutic Drugs and Metal-Based Diagnostic Agents. — Wiley, 2005. — С. 298.
- ↑ Steven L. Soignet et al. United States Multicenter Study of Arsenic Trioxide in Relapsed Acute Promyelocytic Leukemia // Journal of Clinical Oncology[en] : journal. — 2001. — Vol. 19, no. 18 (5 May). — P. 3852—3860.
- ↑ Antman, K. H. Introduction: The history of arsenic trioxide in cancer therapy // Oncologist : journal. — 2001. — Vol. 6(Suppl. 2), no. 1—2 (5 May). — P. 2006.
- ↑ Jun Zhu, Zhu Chen, Valérie Lallemand-Breitenbach, Hugues de Thé "How Acute Promyelocytic Leukaemia Revived Arsenic, " Nature Reviews Cancer 2002, volume 2, 1-9.
- ↑ Bobé Pierre, Bonardelle Danielle, Benihoud Karim, Opolon Paule, Chelbi-Alix Mounira. Arsenic trioxide: A promising novel therapeutic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice // Blood[en] : journal. — American Society of Hematology[en], 2006. — Vol. 108, no. 13 (5 May). — P. 3967—3975..
- ↑ Lu J., Chew E. H., Holmgren A. Targeting thioredoxin reductase is a basis for cancer therapy by arsenic trioxide // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — Vol. 104, no. 30 (5 May). — P. 12288—12293. — DOI:. — PMID 17640917 .
- ↑ Stanton v Benzler 9716830. U.S. 9th Circuit Court of Appeals. 17 червня 1998. Архів оригіналу за 2 квітня 2012. Процитовано 9 червня 2008.
(...) convicted by a jury of first degree murder for poisoning her ex-husband. Her ex-husband's body was found with traces of arsenic trioxide in it.
- ↑ Emsley, John. Arsenic // The Elements of Murder: A History of Poison. — Oxford University Press, 2006. — С. 93—197. — ISBN 9780192806000.
- ↑ Madame Bovary by Flaubert
- ↑ Arsenic Eaters — New York Times July 26, 1885. Архів оригіналу за 6 листопада 2012. Процитовано 13 липня 2021.
- ↑ Richard M. Allesch. Arsenik. Seine Geschichte in Österreich. 54. Band. Klagenfurt: Kleinmayr 1959.
- ↑ G. Przygoda, J. Feldmann, W. R. Cullen. The arsenic eaters of Styria: a different picture of people who were chronically exposed to arsenic // Applied Organometallic Chemistry[en] : journal. — 2001. — Vol. 15, no. 6 (5 May). — P. 457—462. — DOI:.
Посилання[ред. | ред. код]
- Solubility of As2O3 in water as function of temperature
- Case Studies in Environmental Medicine: Arsenic Toxicity [Архівовано 8 травня 2020 у Wayback Machine.]
- IARC Monograph — Arsenic and Arsenic Compounds
- International Chemical Safety Card 0378 [Архівовано 30 вересня 2007 у Wayback Machine.]
- NIOSH Pocket Guide to Chemical Hazards [Архівовано 11 травня 2017 у Wayback Machine.]
- NTP Report on Carcinogens — Inorganic Arsenic Compounds [Архівовано 11 листопада 2005 у Wayback Machine.]
- Use of Arsenic Trioxide in Multiple Myeloma Treatment
- The use of Arsenic trioxide in medicine [Архівовано 12 квітня 2006 у Wayback Machine.] .
- Institute of Chemistry Austria, speciallised on arsenic and various arsenic compounds
|


