Правила Кана – Інґольда – Прелога
Правила Ка́на – І́нґольда – Пре́лога (також правила старшинства Кана – Інґольда – Прелога, правила КІП, або RS-номенклатура; англ. Cahn–Ingold–Prelog priority rules, CIP rules, RS nomenclature) — номенклатурна система правил, що слугує для однозначного опису просторової орієнтації замісників на хіральному центрі або подвійному зв'язку.[1] Ця система була вперше запропонована Робертом Сіднеєм Каном[en], Крістофером Келком Інґольдом[en] і Владіміром Прелогом у 1966 році,[2] а потім дороблена Владіміром Прелогом та Гюнтером Хельмхеном[de] у 1982 році.[3] У 1974 році ці правила були включені до рекомендацій ІЮПАК.[4]
Найпершим кроком є пошук хіральних центрів. Найпоширенішими в хімії є хіральні центри, що мають чотири замісники; зазвичай вони виникають на атомах вуглецю, але також можуть існувати на атомах азоту, сірки, кремнію й фосфору. При цьому вільні електронні пари теж вважаються заступниками.
Кожен хіральний центр розглядається окремо. Метою цього кроку є нумерація заступників за старшинством в порядку 1–4, що відбувається згідно наступних правил:
- Атоми, безпосередньо пов'язані з хіральним центром (їх називають атомами першої сфери), нумеруються в порядку спадання їхнього масового числа: замісник з найвищим масовим числом вважається найстаршим і отримує порядковий номер 1, замісник із наступним за величиною масовим числом отримує номер 2 і т. д. Під уживанням терміну «масове число» також мається на увазі, що у випадку ізотопів одного елемента (наприклад, водень, дейтерій і тритій) ізотоп з більшою кількістю нейтронів отримує вище старшинство. Вільні електронні пари отримують фіктивне атомне число 0 і тому завжди мають найнижче старшинство.
- Якщо два або більше атомів з першої сфери є ідентичними, то вони замінюються списком усіх атомів, пов'язаних із ними (т. зв. атоми другої сфери). Замісник першої сфери, що пов'язаний із атомами другої сфери з найбільшим сумарним масовим числом, отримує найвище старшинство (приклад: бічний ланцюг є старшим за ланцюг ).
- Якщо атоми другої сфери теж однакові, то розглядаються атоми третьої сфери і т. д. Так робиться, доки не буде знайдено першу відміну у замісниках.
- Якщо розподіл за старшинством виявився неможливим навіть при розгляді атомів останньої сферри (наприклад, якщо закінчився ланцюг замісника або якщо у випадку циклічної молекули атом останньої сфери виявився атомом першої сфери) — тоді беруться до уваги наступні фактори:
- Якщо в молекулі присутні подвійні зв’язки, то ізомер (Z) є старшим за ізомер (Е).
- Якщо замісники містять хіральний центр, то дескриптор (R) є старшим за дескриптор (S).
- Якщо замісники містять декілька хіральних центрів, то пара ідентичних дескрипторів (напр. (SS)) є старшою за пару різних (напр. (RS)).
- У випадку наявності центрів псевдохіральності, (r) посідає старшинство над (s) (докладніше: див. нижче).

Для визначення дескриптора хірального центру останній споглядають так, щоб замісник з порядковим номером 4 «дивився» геть від спостерігача; при такій відносній орієнтації інші три замісника мають «дивитись» на спостерігача. Наступним кроком є відлік замісників за зростаючим порядковим номером. Якщо номери 1–2–3 розташовані за годинниковою стрілкою, то хіральний центр позначається дескриптором (R) (від лат. rectus); якщо ж вони розташовані проти годинникової стрілки, то хіральний центр отримує дескриптор (S) (від лат. sinister).
Слід зауважити, що номенклатура RS не є еквівалентною номенклатурі (+/-), тому внаслідок такого теоретичного аналізу неможливо розрахувати напрямок і величину питомого обертання відповідного енантіомера молекули.

Подвійні й потрійні зв’язки на атомах розглядаються таким чином, ніби відповідний атом наступної сфери присутній двічі або тричі (т. зв. фантомні атоми, або атоми-дублікати). Однак, фантомні атоми за замовчуванням не пов'язані з атомами наступної сфери. Також слід зазначити, що подвійні зв’язки між двома гетероатомами, з яких принаймні один є елементом третього періоду або вище, за домовленістю розглядаються як одинарні зв’язки (наприклад, тлумачиться як ).
Якщо атоми наступної сфери утворюють кон'юговану систему (наприклад, (гетеро)ароматичні системи), то масове число фантомного атома визначається як середнє значення масових чисел всіх атомів, з якими може бути утворено подвійний зв'язок в рамках мезомерії.[5]

У випадку призначення дескриптора хіральному центру на карбоциклі розгляд кожної гілки циклу проходить незалежно одна від одної; так робиться до моменту досягнення вихідного атома (або ж атома першої сфери тіє ж гілки), який тепер розглядається лише як фантом — тобто, є кінцевим.[5]
Існують випадки, коли єдиною відмінністю між двома замісниками на певному атомі є лише їхня стереохімічна конфігурація (тобто, наприклад, один замісник має хіральний центр з дескриптором (R), а інший — такий же хіральний центр, але з дескриптором (S). У такому випадку — оскільки (R) > (S) — визначення дескриптора для цього атома теж відбувається стандартним способом, але такий дескриптор називається псевдохіральним і підписується як (r) або (s) (малі літери замість звичних великих).[6]

Для встановлення старшинства серед замісників на подвійному зв'язку використовується той же алгоритм, що наведений вище.
- Якщо два заступники з найвищими старшинствами знаходяться на одній стороні подвійного зв'язку, то останній отримує дескриптор (Z) (від нім. zusammen — «разом»).
- Якщо ці заступники знаходяться по різні сторони подвійного зв'язку, то йому присвоюється дескриптор (E) (від нім. entgegen — «навпроти»).
Часто (Z)-стереомери також є цис-діастереомерами, у той час як (E)-стереомери часто є транс-діастереомерами. Однак, не слід ототожнювати ці дві номенклатурні системи: (E)/(Z)-номенклатура позначає абсолютну конфігурацію замісників на подвійному зв'язку, у той час як цис-/транс-номенклатура описує відносну конфігурацію певних двох замісників. Саме тому остання система на сьогодні поширена загалом лише серед циклічних алкенів, а для загального використання рекомендуєтьться вживання системи (E)/(Z).[7]
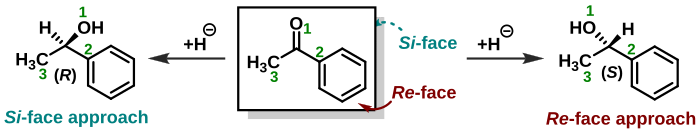
Правила КІП також можуть бути певним чином застосовані для опису реакцій на ахіральних молекулах, в результаті яких виникають хіральні продукти. Так, найвідомішим прикладом застосування є реакції карбонільних сполук з нуклеофілами (напр. BH4-, CN-, літій- або магнійорганічні сполуки): атом вуглецю у вихідній карбонільній сполуці має гібридизацію sp2, яка перетворюється на sp3 в похідній молекулі спирту. Якщо вихідною сполукою є, наприклад, ацетон, то похідний спирт є теж ахіральним. Однак, якщо замісники на карбонільній групі різні, то реакція нуклеофільного приєднання призведе до одного з двох (або ж суміші обидвох) енантіомерів. Така карбонільна сполука вважається прохіральною й має дві різні сторони (площини), з яких нуклеофіл може атакувати. За визначенням, ці сторони позначаються як:
- Площина Re (англ. Re-face): рахунок від найстаршого замісника (у цьому випадку це карбонільна група) до найменшого перебігає за годинниковою стрілкою;
- Площина Si (англ. Si-face): протилежна їй площина.
Відповідно, нуклеофільне приєднання може відбуватись як атака з площини Re (англ. Re face approach), або як атака з площини Si (англ. Si face approach). Абсолютна стереохімічна конфігурація продукту реакції заледить від конкретних замісників, а також від уживаного нуклеофілу й має бути визначена за правилами КІП.[8]
- ↑ March, Jerry; Michael B., Smith (2007). March's advanced organic chemistry : reactions, mechanisms, and structure (вид. 6.). Hoboken, NJ: Wiley-Interscience. с. 155–162. ISBN 978-0-471-72091-1.
- ↑ Cahn, R. S.; Ingold, Christopher; Prelog, V. (21 квітня 1966). Spezifikation der molekularen Chiralität. Angewandte Chemie (нім.). Т. 78, № 8. с. 413—447. doi:10.1002/ange.19660780803.
- ↑ Prelog, Vladimir; Helmchen, Günter (16 січня 2006). Grundlagen des CIP-Systems und Vorschläge für eine Revision. Angewandte Chemie (англ.). Т. 94, № 8. с. 614—631. doi:10.1002/ange.19820940805.
- ↑ Cross, L.C; Klyne, W. (1974). Rules for the Nomenclature of Organic Chemistry: Section E: Stereochemistry (Recommendations 1974) (PDF). ISBN 978-0-08-021019-3. Архів оригіналу (PDF) за 7 квітня 2016.
- ↑ а б Hellwich, Karl-Heinz. Stereochemie Grundbegriffe. ISBN 9783540717072. OCLC 196473498.
- ↑ Nič, Miloslav; Jirát, Jiří; Košata, Bedřich; Jenkins, Aubrey; McNaught, Alan, ред. (12 червня 2009). pseudo-asymmetric carbon atom. IUPAC Compendium of Chemical Terminology (англ.) (вид. 2.1.0). Research Triagle Park, NC: IUPAC. doi:10.1351/goldbook.p04921. ISBN 978-0-9678550-9-7.
- ↑ Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry. Oxford University Press, 2001, ISBN 978-0-19-850346-0, S. 487.
- ↑ Moss, G. P. (1 січня 1996). Basic terminology of stereochemistry (IUPAC Recommendations 1996). Pure and Applied Chemistry (нім.). Т. 68, № 12. с. 2193—2222. doi:10.1351/pac199668122193. ISSN 1365-3075. Процитовано 16 лютого 2021.



