Координаційна геометрія
Термін координаційна геометрія може бути застосований в пов'язаних розділах структурної хімії, кристалографії, фізики твердого тіла тощо. Частіше він перекривається терміном координаційний поліедр.
Координаційна геометрія певного атома — це форма просторового розташування атомів, сусідніх із обраним.
В координаційній хімії неорганічних сполук це форма просторового розташування тих атомів лігандів, які безпосередньо приєднані до центрального атома в комплексній частинці. Таке розташування залежить від кількості та типу приєднаних лігандів, а також від властивостей центрального атома, зазвичай атома металу. Кількість атомів, приєднаних до центрального (тобто число вершин координаційного поліедра), називають координаційним числом.
Форма просторового розташування може бути описана як поліедр, вершини якого є центрами координованих (приєднаних) атомів лігандів.[1]
Координаційні властивості металу часто змінюються із його ступенем окиснення. Кількість координаційних зв'язків (координаційне число) може набувати значень від 2 аж до 20 (приміром, у Th(η5-C5H5)4).[2]
Одною з найпоширеніших координаційних геометрій є октаедрична, в якій шість лігандів, приєднані до металу, розташовані симетрично й утворюють октаедр, якщо їх з'єднати подумки лініями один із одним. Іншими поширеними координаційними геометріями є тетраедрична та плоско-квадратна.
Просторову будову комплексних частинок із центральним атомом, який належить до головної підгрупи, можна передбачити за допомогою теорії Гілеспі, а відносну стійкість та певні деталі електронної будови комплексів перехідних металів можна спрогнозувати за допомогою теорії кристалічного поля.
В кристалічній структурі координаційна геометрія певного атома є формою просторового розташування координованих із ним атомів, а визначення координованих атомів залежить від застосовуваної моделі зв'язку.[1] Приміром, в іонному кристалі хлориду натрію кожен катіон натрію має шість найближчих сусідів — аніонів хлору — в октаедричній координації, а кожен аніон хлору так само октаедрично координований шістьма катіонами натрію. В кристалічній структурі металів із об'ємноцентрованою кубічною ґраткою (англ. body centred cubic, bcc) кожен атом має вісім найближчих сусідів у кубічному розташуванні, із гранецентрованою кубічною ґраткою (англ. face centered cubic, fcc) — дванадцять найближчих сусідів в кубооктаедричному розташуванні.
Нижче подано впорядковані в таблицю координаційні геометрії, відомі зі структурної хімії молекулярних частинок чи кристалів.
| Координаційне число | Геометрія | Приклад молекулярної частинки | Приклад у кристалі | |
|---|---|---|---|---|
| 2 | лінійна | Ag(CN)− 2 у KAg(CN)2[3] |
Ag у ціаніді срібла[en], Au в AuI[2] | |
| 3 | плоска тригональна | 
|
HgI− 3[2] |
O в TiO2, структура рутилу[3] |
| 4 | тетраедрична | 
|
CoCl2− 4[2] |
Zn та S у сульфіді цинку[en], Si у діоксиді кремнію[3] |
| 4 | плоско-квадратна | 
|
AgF− 4[2] |
CuO[3] |
| 5 | тригонально-біпірамідальна | 
|
SnCl− 5[3] |
|
| 5 | квадратно-пірамідальна | 
|
InCl2− 5 у (NEt4)2InCl5[2] |
|
| 6 | октаедрична | 
|
Fe(H 2O)2+ 6[2] |
Na та Cl у NaCl[3] |
| 6 | тригонально-призматична | 
|
W(CH3)6[4] | As у NiAs, Mo у MoS2[en][3] |
| 7 | пентагонально-біпірамідальна | 
|
ZrF3− 7 у (NH4)3ZrF7[3] |
Pa у PaCl5 |
| 7 | октаедр зі шляпкою | 
|
MoF− 7[5] |
La у α-La2O3 |
| 7 | тригональна призма зі шляпкою | 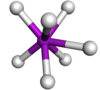
|
TaF2− 7 у K2TaF7[3] |
|
| 8 | квадратно-антипризматична | 
|
TaF3− 8 у Na3TaF8[3] Zr(H 2O)4+ 8 аквакомплекс[6] |
Йодид торію(IV)[3] |
| 8 | додекаедрична (хоча така назва застосовується, точна назва «бісдисфеноїд»)[3] |

|
Mo(CN)4− 8 у K4[Mo(CN)8]·2H2O[3] |
Zr in K2ZrF6[3] |
| 8 | тригональна призма з двома шляпками | 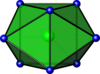
|
ZrF4− 8[7] |
PuBr3[3] |
| 8 | кубічна | Хлорид цезію, фторид кальцію | ||
| 8 | гексагонально-біпірамідальна | 
|
N у Li3N[en][3] | |
| 8 | октаедрична з двома шляпками | Ni у NiAs; 6 сусідніх As + 2 шляпки Ni[8] | ||
| 8 | тригональна призма з двома шляпками | Ca у CaFe2O4[3] | ||
| 9 | тригональна призма з трьома шляпками | 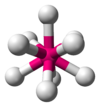
|
[ReH 9]2− у K 2ReH 9[2] Th(H 2O)4+ 9 аквакомплекс[6] |
SrCl2·6H2O, Th у RbTh3F13[3] |
| 9 | квадратна антипризма зі шляпкою | 
|
[Th(трополонат)4(H2O)][2] | La у LaTe2[3] |
| 10 | квадратна антипризма з двома шляпками | Th(C 2O 4)2− 4[2] |
||
| 11 | Th у [ThIV(NO3)4(H2O)3] (бідентатний NO− 3)[2] |
|||
| 12 | ікосаедрична | 
|
Th в іоні Th(NO 3)2− 6 у Mg[Th(NO3)6]·8H2O[3] | |
| 12 | кубооктаедрична | 
|
ZrIV(η3−(BH4)4) | атоми металу в fcc структурі, приміром, Ca[3] |
| 12 | антикубооктаедрична | 
|
атоми металу в гексагональній (англ. hcp) структурі, приміром, Sc[3] | |
| 12 | гексагональна антипризма з двома шляпками | U(BH4)4[2] |
IUPAC ввела символ поліедру в номенклатурі неорганічних сполук з 2005 року для опису координаційної геометрії атома у структурі.[9]
Міжнародна спілка кристалографії (IUCr) запропонувала вказувати цей символ верхнім індексом у квадратних дужках всередині хімічної формули. Приміром, CaF2 буде позначено як Ca[8cb]F2[4t], де [8cb] означає 8 сусідів у кубічному розташуванні, а [4t] — 4 сусіди в тетраедричному розташуванні. Еквівалентні позначення за IUPAC пишуться як CU−8 та T−4 відповідно.[1]
Позначення IUPAC застосовуються для комплексів та молекулярних частинок, а позначення IUCr — для кристалів.
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. — Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- ↑ а б в J. Lima-de-Faria; E. Hellner; F. Liebau; E. Makovicky; E. Parthé (1990). Report of the International Union of Crystallography Commission on Crystallographic Nomenclature Subcommittee on the Nomenclature of Inorganic Structure Types (PDF). Acta Crystallogr. A. 46: 1—11. doi:10.1107/S0108767389008834. Архів оригіналу (PDF) за 20 січня 2022. Процитовано 3 квітня 2022.
- ↑ а б в г д е ж и к л м н Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (вид. 2nd). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ а б в г д е ж и к л м н п р с т у ф х ц ш щ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (вид. 2nd). Prentice Hall. ISBN 978-0-13-039913-7.
- ↑ Kaupp, Martin (2001). "Non-VSEPR" Structures and Bonding in d(0) Systems. Angew Chem Int Ed Engl. 40 (1): 3534—3565. doi:10.1002/1521-3773(20011001)40:19<3534::AID-ANIE3534>3.0.CO;2-#.
- ↑ а б Persson, Ingmar (2010). Hydrated metal ions in aqueous solution: How regular are their structures?. Pure and Applied Chemistry. 82 (10): 1901—1917. doi:10.1351/PAC-CON-09-10-22. ISSN 0033-4545.
- ↑ Jeremy K. Burdett; Roald Hoffmann; Robert C. Fay (1978). Eight-Coordination. Inorganic Chemistry. 17 (9): 2553—2568. doi:10.1021/ic50187a041.
- ↑ David G. Pettifor, Bonding and Structure of Molecules and Solids, 1995, Oxford University Press,ISBN 0-19-851786-6
- ↑ NOMENCLATURE OF INORGANIC CHEMISTRY IUPAC Recommendations 2005 ed. N. G. Connelly et al. RSC Publishing http://www.chem.qmul.ac.uk/iupac/bioinorg/ [Архівовано 2 вересня 2017 у Wayback Machine.]