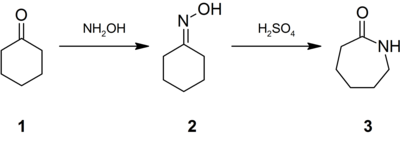Сульфат амонію
| Сульфат амонію | |
|---|---|

| |
| Ідентифікатори | |
| Номер CAS | 7783-20-2 |
| Номер EINECS | 231-984-1 |
| KEGG | D08853 |
| Назва MeSH | D01.625.062.374 і D01.875.800.800.850.050 |
| ChEBI | 62946 |
| SMILES | [NH4+].[NH4+].[O-]S(=O)(=O)[O-] |
| InChI | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
| Номер Бельштейна | 11343144 |
| Властивості | |
| Молекулярна формула | (NH4)2SO4 |
| Молярна маса | 132,141 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 1,77 г/см³[1] |
| Тпл | 280 °C (розкл.)[1] 513±2 °C (у вакуумі) |
| Розчинність (вода) | 76,4 г/100 г H2O[1] |
| Термохімія | |
| Теплоємність, c p |
1423 Дж/(г·K) |
| Небезпеки | |
| NFPA 704 | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Амо́ній сульфа́т, сульфат амонію — амонієва сіль сульфатної кислоти складу (NH4)2SO4. За звичайних умов є білими, гігроскопічними кристалами.
Основною сферою застосування сульфату амонію є сільське господарство — як азот- та сірковмісне добриво. Також використовується у виробництві персульфатів та антипіренів.

У природі сульфат амонію може знаходитися у вигляді мінералу масканьїту. Він кристалізується на вулканічних фумаролах та на джерелах термальних вод.[2]
Сульфат амонію є білими, ортогональними кристалами. Добре розчиняється у воді, не утворюючи гідратів. При 0 °C його розчинність складає 70,6 г на 100 г води та 103,8 г при 100 °C. Не розчиняється в етанолі та ацетоні.
Температура Кюрі 566 °C
Сульфат амонію зазвичай синтезується кількома шляхами:
- з аміаку та сульфатної кислоти;
- із коксового газу;
- як побічний продукт органічних синтезів;
- із гіпсу;
- із сульфату міді (домашні або лабораторні умови).

Даний метод нині є промисловим способом отримання сульфату амонію.
Газуватий аміак впорскується до концентрованої (понад 70 %) сульфатної кислоти і в результаті утворюються кристали солі розміром 0,5—3 мм:
Взаємодія аміаку і кислоти є екзотермічною, але утворене тепло не відводять — воно необхідне для випаровування зайвої води і підтримування стабільно високої концентрації кислоти.
Масштаби отримання сульфату амонію з коксового газу останніми десятиліттями суттєво зменшуються через модернізацію металургійних підприємств та впровадження безвідходних технологій виробництва.
Коксовий газ, що утворюється в результаті коксування кам'яного вугілля, є сумішшю оксидів вуглецю, водню, метану та, найголовніше, аміаку. Неочищений коксовий газ пропускається крізь сульфатну кислоту з утворенням солі сульфату амонію. Такий продукт має значну кількість домішок у вигляді органічних смол.
Застосовується також непрямий метод: аміак виділяється із водного шару коксівного конденсату під дією вапна і далі пропускається крізь сульфатну кислоту.
Значні кількості сульфату амонію отримують як побічний продукт синтезу капролактаму. Взаємодією циклогексанону з гідроксиламіном синтезують оксим (2), який в олеумі або концентрованій H2SO4 зазнає перегрупування Бекмана із утворенням капролактаму (3).
У реакційній суміші, після охолодження, капролактам перебуває у формі монозаміщеного сульфату. Його витісняють додаванням аміаку, в результаті чого утворюється капролактам та сульфат амонію як побічний продукт.
Через дефіцит сульфатної кислоти у часи Першої світової війни, науковцями BASF був розроблений метод отримання сульфату амонію з гіпсу. Дрібно помелений гіпс змішують із розчином карбонату амонію:
Взаємодію проводять протягом кількох годин у резервуарах із перемішуванням, а потім фільтрують на вакуум-фільтрах. Карбонат кальцію добре виділяється із суміші завдяки його малій розчинності.
Також можна проводити взаємодію шляхом пропускання газуватих аміаку та оксиду вуглецю крізь суспензії гіпсу:
Утворюється в розчині при осадженні гідроксиду міді(II) (світло-блакитний осад) з розчину сульфату міді (мідного купоросу) аміаком або його водним розчином (нашатирним спиртом) на відкритому повітрі чи під витяжкою:
Розчин треба помішувати до зникнення інтенсивного темно-синього забарвлення аміачного комплексного іону міді [Cu(NH3)4]2+, який утворюється при надлишку аміаку, а аміак додавати до повного осадження міді.
При нагрівання на повітрі сульфат амонію починає розкладатися при температурі понад 100 °C, а у вакуумі — при 513 °C.
При вищих температурах, більше 300 °C, можуть також виділятися незначні кількості N2, SO2, SO3, H2O.
У розчинах сполука добре дисоціює із частковим гідролізом, утворюючи кисле середовище:
При взаємодії твердого (NH4)2SO4 з концентрованою сульфатною кислотою утворюється монозаміщений сульфат:
Сульфат амонію вступає в реакції обміну з лугами та деякими солями:
При нагріванні окиснюється сильними окисниками до вільного азоту:
При електролізі розчину солі в концентрованій сульфатній кислоті, утворюється персульфат амонію:
- (на платиновому або платинованому аноді утворюється персульфат, а на катоді — водень).

Практично увесь синтезований сульфат амонію застосовується як добриво. Окрім значного вмісту в сполуці азоту, в ній також присутня важлива для аграріїв сірка.
У менших масштабах сіль використовується для виробництва персульфатів, антипіренів. Також застосовується у фотографії, текстильній та скляній промисловостях.
- ↑ а б в За тиску 101,3 кПа
- ↑ Mineralogy Database — Mascagnite [Архівовано 19 січня 2013 у Wayback Machine.] (англ.)
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Weston C. W., Papcun J. R., Dery M. Ammonium compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 2. — P. 367—368. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Zapp K. H. Ammonium compounds // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 11—14. — DOI: (англ.)
- Ritz J., Fuchs H., Moran W. C. Caprolactam // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 4—5. — DOI: (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)