Антитіла
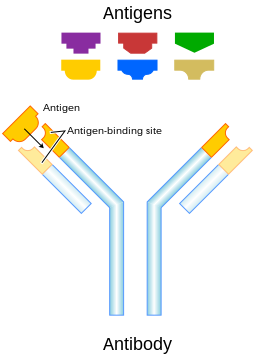
Антитіла́, або імуноглобулі́ни (Ig) (також рідше протитіла[1][2]) — білкові сполуки, які організм хребетних тварин виробляє у відповідь на антигени, чужорідні речовини, які потрапляють до крові, лімфи або тканин організму, з метою знищити або нейтралізувати потенційно небезпечні з них — бактерії, віруси, отрути та деякі інші речовини. Імуноглобуліни містяться в сироватці крові і утворюють групу близьких за структурою глікопротеїнів.
Класифікація[ред. | ред. код]

Відомо 5 класів імуноглобулінів людини: G, М, A, D, Е (IgG, IgM, IgA, IgD і IgE).
Найповніше вивчені імуноглобуліни класу G (IgG), вони ж є і найпоширенішими.
Імуноглобулін IgG має підкласи: IG1, IG2, IG3 і IG4 знайдені в сироватці крові в різних концентраціях. Їхні молекули побудовані з двох ідентичних легких (молекулярна маса 22000 Да) і двох ідентичних важких (молекулярна маса 55 000-70 000 Да) поліпептидних ланцюжків, скріплених дисульфідними зв'язками. При розщеплюванні протеолітичними ферментами (наприклад, папаїном) молекула імуноглобуліну розпадається на три частини: два однакові фрагменти (позначаються Fab), кожен з яких зберігає здібність до пов'язання з антигеном, і фрагмент (позначається Fc), що сприяє проходженню молекули імуноглобуліну через біологічні мембрани. Всі три фрагменти сполучені короткими гнучкими ділянками, розташованими в середині важкого ланцюжка.
Гнучкість дозволяє молекулам імуноглобулінів оптимально приєднуватися до антигенів, що мають різну просторову будову. Ділянки молекули, відповідальні за зв'язування з антигеном (активний центр), утворені N-кінцевими (несуть на кінці аміногрупу -NH2) відрізками важких і легких ланцюжків. Послідовність амінокислот в цих відрізках специфічна для кожного IgG і називається варіабельною ділянкою, в інших частинах ланцюжків вона майже не варіює. Варіабельна ділянка формується завдяки V(D)J-рекомбінації та соматичному гіпермутагенезі лімфоцитів[3].
Інші класи імуноглобулінів (реагіни) відрізняються будовою важких ланцюжків. IgM — еволюційно найдавніші імуноглобуліни; вони синтезуються на перших стадіях імунної реакції. Їхні молекули складаються з 5 мономерних субодиниць, кожна з яких нагадує молекулу IgG.
Головною функцією IgA є захист від вірусної інфекції, особливо на слизових оболонках дихальних шляхів. Частково вони беруть участь у знешкодженні бактеріальних токсинів. IgA мають два підкласи: IgA1 і IgA2. IgA1 найчисленніші у плазмі крові, становлять до 10 % від усіх імуноглобулінів організму. Для IgA2 характерне накопичення у різних секретах (зокрема слину, молозиво, кишковий сік), де вони існують в полімерній формі[4][5].
Антитіла, що беруть участь в алергічних реакціях, належать до IgE.
Імуноглобуліни синтезуються лімфатичними клітинами. При деяких ураженнях цих клітин в крові та сечі накопичується велика кількість так званих мієломних імуноглобулінів, які, на відміну від імуноглобулінів здорового організму, однорідні за складом.
За характером впливу на антиген розрізняють:
- аглютиніни — антитіла, що зумовлюють аглютинацію мікроорганізмів;
- лізини та опсоніни — антитіла, що сприяють їхньому руйнуванню;
- преципітини — антитіла, що осаджують білкові речовини у розчинах; антитоксини та інші.
Фрагмент антитіла, який складається з одного мономерного варіабельного домену, називається нанотіло.
Застосування в медицині[ред. | ред. код]


Антитіла використовують для верифікації типу клітин, їхніх органел та навіть молекул. Антитіла широко використовують з діагностичною метою в медицині: на принципі реакції антиген-антитіло засновані методи імуносцинтиграфії, імуногістохімії, вестерн-блоту тощо.
Для лікування або профілактики деяких інфекційних хвороб (наприклад, правець, сказ тощо) застосовують лікувальні алогенні чи гетерогенні імуноглобуліни, які отримують введенням деяких збудників або токсинів донорам — людям або тваринам, спричиняючи, таким чином, в них імунну реакцію, яка призводить до вироблення антитіл. Після цього у них беруть кров, яку очищують від баласту, і готують стерильний розчин, що містить велику кількість захисних антитіл.
Див. також[ред. | ред. код]
- Поліклональні антитіла
- Імунітет
- Імунологія
- Імуногенетика
- Фагоцитоз
- Сироватка крові
- Антиген
- Антигени лейкоцитів людини (HLA)
- Імунна реакція
- Імунний фактор
Примітки[ред. | ред. код]
- ↑ Словник української мови Академічний тлумачний словник (1970—1980). Протитіла [1] [Архівовано 13 січня 2022 у Wayback Machine.]
- ↑ Павло Содомора, Володимир Мартин Львівський національний медичний університет імені Данила Галицького ГРЕКО-ЛАТИНСЬКІ ПРЕФІКСИ ТА ЇХ ВІДОБРАЖЕННЯ В УКРАЇНСЬКІЙ ФІЛОСОФСЬКІЙ ТА МЕДИЧНІЙ ТЕРМІНОЛОГІЇ. 2011. Стор. 119 [2] [Архівовано 22 січня 2022 у Wayback Machine.]
- ↑ Eugene V. Koonin & Mart Krupovic (March 2015). Evolution of adaptive immunity from transposable elements combined with innate immune systems. Nature reviews. Genetics. 16 (3): 184—192. doi:10.1038/nrg3859. PMID 25488578.
- ↑ Snoeck V., Peters I. R., Cox E. The IgA system: a comparison of structure and function in different species. (англ.) // Veterinary Research. — 2006. — May (vol. 37, no. 3). — P. 455—467. — doi:10.1051/vetres:2006010. — PMID 16611558. (англ.)
- ↑ Mantis NJ, Rol N, Corthésy B (November 2011). «Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut». Mucosal Immunology. 4 (6): 603–11. doi:10.1038/mi.2011.41. PMC 3774538. PMID 21975936 (англ.)
Література[ред. | ред. код]
| Цей розділ потребує доповнення. (вересень 2019) |
- Гауровиц Ф., Иммунохимия и биосинтез антител, пер. с англ., М., 1969
- Незлин Р. С., Биохимия антител, М., 1966
- Портер Р., Структура антител, в сборнике: Молекулы и клетки, в. 4, пер. с англ., М., 1969
- Kabat Е. A., Structural concepts in immunology and immunochemistry, N. Y., 1968.
Посилання[ред. | ред. код]
- Аутоантитіла [Архівовано 10 січня 2021 у Wayback Machine.] // Фармацевтична енциклопедія
- СИРОВАТКИ ІМУННІ
| |||||||||||||||||||||||||
|
| Це незавершена стаття з імунології. Ви можете допомогти проєкту, виправивши або дописавши її. |