Озонова діра


Озонова діра — локальне падіння концентрації озону в стратосфері на 10—40 %. Пов'язано це з дією фреонів, зменшенням кількості кисню при запусках космічних кораблів та польотами реактивних літаків. Чітко виявляється при надмірно низьких температурах. Загальноприйнята в науковому середовищі теорія, за якою в другій половині XX століття зростання дії антропогенного чинника у вигляді виділення хлор- і бромвмісних фреонів (CFC) призвело до значного зменшення озонового шару[1]. Згідно з іншою гіпотезою, процес утворення «озонових дір» значною мірою є природним і не пов'язаний винятково зі шкідливою дією людської цивілізації[2].
Історія[ред. | ред. код]
Озонова діра діаметром понад 1 000 км вперше була відкрита 1985 року в Південній півкулі над Антарктидою групою вчених Британської антарктичної експедиції, Джо Фарманом, Браяном Гардінером і Джоном Шенкліном[3]. Вона з'являлася у серпні і до грудня або січня зникала. Завдяки глобальній боротьбі з викидами фреонів (Монреальський протокол), антарктична озонова діра з 1989 року стабільно зменшується на 0,8 %, що виведе локальний рівень атмосферного озону на показники 1980 року приблизно до 2075 року[4]. Проте, за даними Європейського космічного агентства (ESA), 16 вересня 2023 року розмір діри над Антарктидою досяг свого історичного максимуму та становив вже 26 млн кв. км, що еквівалентно розмірам Північної Америки[5][6]. Озонова діра над Антарктидою у 2023 році, як повідомляється в матеріалі Live Science, стала однією з найбільших за своїм розміром за весь час спостереження[7][8] і продовжує поглиблюватися[9]. В той же час, над Північною півкулею Землі в Арктиці утворилася інша озонова діра, але значно менших розмірів.
Механізм утворення[ред. | ред. код]
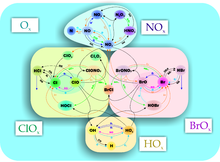
Механізм синтезу, а також розпаду (фотоліз) озону, запропонував Сідней Чепман 1930 року, а тому його названо його ім'ям. Реакції утворення озону:
• 3О2 + hν → 2О + 2О2 → 2О3
Фотоліз молекулярного кисню відбувається в стратосфері під впливом ультрафіолетового випромінювання з довжиною хвилі 175—200 нм і до 242 нм.
• О3 + hν → О2 + О
• О3 + O → 2О2
Озон витрачається в реакціях фотолізу і взаємодії з атомарним киснем: До зменшення концентрації озону в атмосфері веде сукупність чинників, головним з яких є руйнування молекул озону в реакціях з різними речовинами антропогенного і природного походження, відсутність сонячного випромінювання протягом полярної зими, особливо стійкий полярний вихор, який перешкоджає проникненню озону з приполярних широт, і утворення полярних стратосферних хмар (ПСХ), поверхню частинок якого каталізують реакції розпаду озону. Ці чинники особливо характерні для Антарктики, в Арктиці полярний вихор набагато слабший: через відсутність континентальної поверхні температура на декілька градусів вища, ніж в Антарктиці, а ПСХ менш поширені, до того ж мають тенденцію до розпаду на початку осені. Молекули озону (O3) хімічно дуже активні і можуть реагувати з багатьма неорганічними та органічними сполуками. Основними речовинами, що руйнують молекули озону, є:
- прості речовини (водень (H2), атоми кисню (O), хлору (Cl), брому (Br)),
- неорганічні сполуки (хлороводень (HCl), монооксид азоту (NO)),
- органічні сполуки (метан (CH4), фторхлор- і фторбромфреони, які виділяють атоми (Cl) і (Br)).
На відміну від гідрофторфреонів (HFC), які розщеплюються до атомів фтору, які, у свою чергу, швидко реагують з водою (H2O) утворюючи стабільний фтороводень (H2F2). Таким чином, фтор (F) не бере участі в реакціях розпаду O3. Йод також не руйнує стратосферний озон, оскільки йодовмісні органічні речовини майже повністю витрачаються ще в тропосфері.
Залежно від ланцюга реакцій, окрім механізму Чепмана (кисневий цикл Ox), виокремлюють ще три цикли руйнування озону: галогеновий, азотний, водневий. Діяльність людини збільшила галогенову частку розкладу захисного шару Землі. Частка розкладу озону залежно від циклу руйнування[10]:
| Тиск (гПа) | азот | кисень | водень | галогени |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,11 | 0,25 |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Хлорний цикл ClOx[ред. | ред. код]

Хлорний цикл є різновидом галогенного циклу.
• CFCl3 + hν → CFCl2 + Cl
• Cl + O3 → ClO + O2
• ClO + O → Cl + O2
Азотний цикл NOx[ред. | ред. код]
Оксиди азоту грають важливу роль в реакціях руйнування озону в середній стратосфері. Не зважаючи на те, що азоту в атмосфері більше, ніж будь-якого іншого газу, утворення його оксидів безпосередньо з молекулярного азоту замале, оскільки молекула N2 дуже стабільна, фактично інертна. Для її розпаду потрібно багато енергії, наприклад розряд блискавки або дуже жорстке випромінювання, сонячні протони або галактичне випромінювання. В стратосфері цього немає, тому основним джерелом оксидів озота (NOx) є закис азоту (N2O), який утворюється на поверхні Землі і в океанах головним чином результатом діяльності бактерії. Людина теж вносить свій внесок — третина від всього закису азоту. Головною реакцією, за якою N2O перетворюється в NOx є наступна:
• N2O + O(1D) → NO + NO
Вона може протікати тільки вдень, тільки за наявності Сонця. Потім NO вступає в реакцію з озоном, водночас руйнуючи його, що приводить до утворення іншого оксиду азоту, NO2:
• О3 + NO → NO2 + О2
Ця реакція може протікати і вночі, тому концентрація двоокису азоту росте в темний час доби, оскільки вдень вона перетворюється назад по реакціях:
• NO2 + О → NO + О2
• NO2 + hν → NO + О
Третій оксид азоту, вже з трьома атомами кисню в молекулі, який знову таки реагує з озоном:
• NO2 + О3 → NO3 + О2
Він перетворюється назад в NO і NO2 через фотоліз:
• NO3 + hν → NO2 + O
• NO3 + hν → NO + О2
Тому знову таки його вночі більше, ніж вдень. Таким чином, оксиди азоту реагуючи з озоном збільшують число атомів кисню в своїх молекулах, а потім втрачають їх в реакціях з атомарним киснем або при фотолізі. Сумарно це приводить до загибелі озону. Процес цей ланцюговий і циклічний, оксиди азоту в ньому можуть розглядатися як каталізатори.
Водневий цикл HOx[ред. | ред. код]
Іншою важливою родиною речовин, що руйнують озон, є замісники OH- і HO23+, об'єднувані загальною формулою HOx. Їх можна розглядати як оксиди водню. Проте на відміну від звичайних оксидів вони дуже реакційнопотентні (не можуть існувати як речовина, оскільки володіють неподіленою електронною парою, тобто є замісниками). Якщо два такі замісники зустрінуться разом, то вони прореагують один з одним, рекомбінують, утворюючи зовсім іншу речовину, наприклад два HO- замісники дадуть перекис водню (H2O2). Основним джерелом утворення HOx є реакція водяної пари з сінглетним атомом кисню:
• Н2O + О(1D) → OH + OH
Ця реакція дуже схожа на реакцію в якій закис азоту N2O, реагуючи теж з сінглетним киснем дає дві молекули NO. Важлива реакція з метаном:
• СН4 + О(1D) → СН3 + OH
Аналогічні реакції:
• ОН + О3 → НО2 + О2
• НО2 + О → ОН + О2
• НО2 + О3 → ОН + 2О2
В них гинуть дві молекули озону і регенерується OH- замісник, цикл замикається. OH- далі знову вступає в реакцію з озоном. Повний хімічний механізм складається з сотень реакцій.
Наслідки[ред. | ред. код]

Ослаблення озонового шару посилює потік сонячної радіації на землю і викликає у людей зростання числа ракових утворень шкіри. Також від підвищеного рівня випромінювання страждають рослини і тварини.
Стан озонового шару в Україні[ред. | ред. код]
В Україні спостереження за станом озонового шару проводяться на чотирьох озонометричних станціях у Києві, Борисполі, Одесі, Львові (до 2014 року проводилось також на Кара-Дагу в Криму). За даними цих спостережень, протягом останніх 10 років загальний вміст озону в атмосфері був значно нижчим від кліматичної норми (аналогічна картина спостерігалася для всієї північної півкулі Землі в межах широт 40—60°). Для виявлення озонових аномалій аналізується відхилення значень загального вмісту озону в одиницях стандартного відхилення а. Якщо ці відхилення становлять від — 2,0 а до — 2,5 а, то це свідчить про критичну ситуацію, а коли перевищують значення –2,5 а, то констатується озонова аномалія («діра»). Протягом 2000 р. озонових аномалій над Україною не спостерігалося, проте було зафіксовано кілька випадків зменшення вмісту озону до критичних значень[джерело?].
Відновлення[ред. | ред. код]
Хоча людством були вжиті заходи з обмеженню викидів хлор- і бромвмісних фреонів шляхом переходу на інші речовини, наприклад фторвмісні фреони (CFC)[11], процес відновлення озонового шару триватиме декілька десятиріч. Перш за все це зумовлено величезним об'ємом вже накопичених в атмосфері фреонів, які мають час життя десятки і навіть сотні років. Тому затягування озонової діри не варто чекати раніше 2048 року[12].
Упередження стосовно озонової діри[ред. | ред. код]
Існує декілька поширених міфів стосовно утворення озонових дір. Незважаючи на свою ненауковість, вони почасти з'являються в ЗМІ[13] — іноді завдяки непоінформованості, іноді підтримувані прихильниками теорій змов. Нижче перераховано деякі з них.
Основними руйнівниками озону є фреони[ред. | ред. код]

Це твердження справедливе для середніх і високих широт. У високих широтах (де виникають озонові діри) хлорний цикл відповідальний лише за 15—25 % втрат озону в стратосфері. Необхідно відзначити, що 80 % хлору (Cl) має антропогенне походження[14]. Тобто втручання людини збільшує внесок хлорного циклу. У разі збереження тенденції щодо збільшення виробництва фреонів, яка була до вступу в дію Монреальського протоколу) (зростання 10 % на рік) 2050 року 30 %—50 % загальних втрат озону обумовлювалось би дією фреонів (CFC)[15]. До втручання людини процеси утворення озону і його руйнування перебували в рівновазі. Але фреони, що викидаються при людській діяльності, зсунули цю рівновагу у бік зменшення концентрації озону. Що ж до полярних озонових дір, то тут ситуація абсолютно інша. Механізм руйнування озону в принципі відрізняється від низьких широт, ключовою стадією є перетворення неактивних форм галогеновмісних речовин в оксиди, яке протікає на поверхні частинок ПСХ. В результаті практично весь озон руйнується в реакціях з галогенами[16]:
Фреони дуже важкі, щоб досягти стратосфери[ред. | ред. код]

Іноді стверджується, що оскільки молекули фреонів набагато важчі за азот (N2) і кисень (O2), то вони не можуть досягти стратосфери в значних кількостях. Проте атмосферні гази перемішуються повністю, а не розшаровуються або сортуються по вазі. Процеси вертикального переносу повітряних мас, конвекції і турбулентності повністю перемішують атмосферу нижче турбопаузи набагато швидше. Тому навіть такі важкі гази, як інертні або фреони (CFC), рівномірно розподіляються в атмосфері, досягаючи, зокрема, і стратосфери. Експериментальні вимірювання їх концентрацій в атмосфері підтверджують це, дивіться наприклад графік праворуч. Також вимірювання показують, що потрібно близько 5 років для того, щоб гази, що виділилися на поверхні Землі досягли стратосфери. Якби гази в атмосфері не перемішувалися, то такі важкі гази з її складу як аргон (Ar) і вуглекислий газ (CO2) утворювали б на поверхні Землі шар в декілька десятків метрів товщиною, що зробило б її нежилою. На щастя це не так. Криптон (Kr) з атомарною масою 84, і гелій (He) з атомарною масою 4, мають одну і ту ж відносну концентрацію, що біля поверхні, що на висоті 100 км. Звичайно, все вищенаведене вірне лише для газів, які порівняно стабільні, як фреони чи інертні. Речовини, які вступають в реакції, а також піддаються різному фізичному впливу, скажімо, розчиняються у воді, мають залежність концентрації від висоти.
Основні джерела галогенів природні, а не антропогенні[ред. | ред. код]


Є думка, що природні джерела галогенів, наприклад вулкани або океани, більш значущі для процесу руйнування озону, ніж діяльність людини. Не ставлячи під сумнів внесок природних джерел в загальний баланс галогенів, необхідно відзначити, що в основному вони не досягають стратосфери з огляду на те, що є водорозчинними (в основному хлорид-йони (Cl-) і хлороводень (HCl)) і вимиваються з атмосфери, випадаючи у вигляді дощів на землю. Також природні з'єднання менш стійкі, ніж фреони, наприклад метилхлорид (CH3Cl) має атмосферний час життя всього порядка року, в порівнянні з десятками і сотнями років для фреонів. Тому їх внесок в руйнування стратосферного озону досить малий. Навіть рідкісне за своєю силою виверження вулкана Пінатубо в червні 1991 року викликало падіння рівня озону не за рахунок галогенів, що вивільняються, а за рахунок утворення великої маси сірчанокислих аерозолів (SO42-), поверхня яких каталізувала реакції руйнування озону. На щастя, вже через три роки практично вся маса вулканічних аерозолів була видалена з атмосфери. Таким чином, виверження вулканів є порівняно короткостроковими чинниками дії на озоновий шар, на відміну від фреонів, які мають часи життя в десятки і сотні років[17].
Озонова діра повинна розташовуватися над джерелами фреонів[ред. | ред. код]
Багато хто не розуміє, чому озонова діра утворюється в Антарктиці, у той час як основні викиди фреонів відбуваються в Північній півкулі. Річ у тому, що фреони добре перемішані в тропосфері і стратосфері. З причини малої реакційної здатності вони практично не витрачаються в нижніх шарах атмосфери і мають термін життя в декілька років або навіть десятиріччя. Тому вони легко досягають верхніх шарів атмосфери. Антарктична «озонова діра» існує не постійно. Вона з'являється наприкінці зими — на початку весни. Причини, за якими озонова діра утворюються в Антарктиці, пов'язані з особливостями місцевого клімату. Низькі температури антарктичної зими приводять до утворення полярного вихору. Повітря усередині цього вихору рухається здебільшого замкнутими траєкторіями навколо Південного полюса. В цей час полярна область не освітлюється Сонцем, і там озон не утворюється. З настанням літа кількість озону збільшується і знову приходить до норми. Тобто коливання концентрації озону над Антарктикою — сезонні. Проте, якщо відстежити зміни усередненої протягом року концентрації озону і розміру озонової діри протягом останніх десятиріч, то є певна тенденція до падіння концентрації озону.
Озон руйнується тільки над Антарктикою[ред. | ред. код]

Це неправильно, бо рівень озону падає всюди. Це показують результати довготривалих вимірювань концентрації в різних точках планети. Ви можете подивитися на графік зміни концентрації озону над Аросою в Швейцарії праворуч.
Цікаві факти[ред. | ред. код]
Генеральна асамблея ООН спеціальною резолюцією № A/RES/49/114 в 1994 році оголосила 16 вересня щорічним Міжнародним днем охорони озонового шару (англ. International Day for the Preservation of the Ozone Layer).
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ Scientific Assessment of Ozone Depletion: 2006 : [арх. 30 січня 2018 року] // World Meteorological Organization. — Дата звернення: 30 січня 2018 року. — Цитата: «
These and other recent scientific findings strengthen the conclusion of the previous assessment that the weight of scientific evidence suggests that the observed middle- and high-latitude ozone losses are largely due to anthropogenic chlorine and bromine compounds.
Ці та інші нещодавно одержані наукові дані укріпили висновок попередніх оцінок в тому, що перевага на користь наукових доказів свідчить про те, що втрата озону в середніх і високих широтах загалом обумовлена антропогенними хлор- і бромвмісними сполуками (CFC)». - ↑ Новости науки за 27 декабря 1999 года // Знание — сила. — М., 1999. — Вип. 57 (декабрь).
- ↑ Farman, J. C.; Gardiner, B. G.; Shanklin, J. D. (1985). Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. Nature. 315 (6016): 207—210. Bibcode:1985Natur.315..207F. doi:10.1038/315207a0.
- ↑ Susan E. Strahan, Anne R. Douglass. Decline in Antarctic Ozone Depletion and Lower Stratospheric Chlorine Determined From Aura Microwave Limb Sounder Observations // Geophysical Research Letters. — 2018. — Vol. 45, iss. 1 (January). — P. 382–390. — DOI:.
- ↑ 'One of the biggest on record': Ozone hole bigger than North America opens above Antarctica. // By Harry Baker published October 10, 2023
- ↑ Розмір діри в озоновому шарі над Антарктидою наразі один із найбільших за всю історію. // Автор: Станіслав Ткацевіч. 06.10.2023
- ↑ 'One of the biggest on record': Ozone hole bigger than North America opens above Antarctica. // By Harry Baker published October 7, 2023
- ↑ Озонова діра над Антарктидою зросла до рекордних розмірів. // Автор: Наталья Веселова. 12.10.2023, 13:28
- ↑ Озонова діра над Антарктикою поглибшала. 25.11.2023, 15:39
- ↑ Andrew Dessler. «The Chemistry and Physics of Stratospheric Ozone» Academic Press. 2000
- ↑ Production, Sales, and Atmospheric Release of Fluorocarbons throught 2004 [Архівовано 28 вересня 2015 у Wayback Machine.] (англ.)
- ↑ Paul Newman. Recovery of the Antarctic Ozone Hole [Архівовано 3 жовтня 2006 у Wayback Machine.] (англ.)
- ↑ Підбірка ненаукових статей про проблему з коментарями спеціаліста (рос.)
- ↑ Osterman, G. B. & etc. Balloon-Borne Measurements of Stratospheric Radicals and their Precursors Implications for the Production and Loss of Ozone [Архівовано 2008-12-23 у Wayback Machine.] // Geophys. Res. Lett.. — 1997. — Т. 24. — № 9. — С. 1107—1110 (англ.)
- ↑ National Academy of Sciences. Halocarbons: Effects on Stratospheric Ozone. — 1976. Галогеновуглеводні: вплив на стратосферний озон (англ.)
- ↑ Stratospheric Ozone. An Electronic Textbok Підручник з дослідження стратосферного озону. (англ.)
- ↑ Myth: Volcanoes and the Oceans are Causing Ozone Depletion (англ.)
Література[ред. | ред. код]
- Корсак В. В., Коцаренко М. Я. Озонова діра — сигнал небезпеки. — К. : т-во «Знание», УРСР, 1990. — 48 с. — (Вдумливим, допитливим, кмітливим)
- И. К. Ларин. Химия озонового слоя и жизнь на Земле // Химия и жизнь — XXI век. — 2000. — № 7. — С. 10-15. (рос.)
- Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press — 2000. (англ.)
- Dotto, Lydia and Schiff, Harold. The Ozone War. Doubleday — 1978. ISBN 0-385-12927-0 (англ.)
- Roan, Sharon (1990). Ozone Crisis, the 15 Year Evolution of a Sudden Global Emergency. Wiley. ISBN 0-471-52823-4 (англ.)
- Cagin, Seth and Dray, Phillip. Between Earth and Sky: How CFCs Changed Our World and Endangered the Ozone Layer. Pantheon — 1993. ISBN 0-679-42052-5 (англ.)
- Benedick, Richard E. (1991). Ozone Diplomacy. Harvard University Press. ISBN 0-674-65001-8 (англ.)
- Litfin, Karen T. (1994). Ozone Discourses. Columbia University Press. ISBN 0-231-08137-5 (англ.)
- Newman, P. A., Kawa, S. R. and Nash, E. R. (2004). «On the size of the Antarctic ozone hole?». Geophysical Research Letters 31: L12814. (англ.)
- E. C. Weatherhead, S. B. Andersen (2006). «The search for signs of recovery of the ozone layer». Nature 441: 39-45. (англ.)
- Eike Roth. «Globale Umweltprobleme — Ursachen und Lösungsansätze», Friedmann Verlag, München — 2004. ISBN 3-933431-31-X (нім.)
- World Meteorological Organization, Scientific assessment of ozone depletion: 2002, Global Ozone Research and Monitoring Project — Report No. 47, 498pp., Geneva — 2003 ISBN 92-807-2261-1 (англ.)
- Martin Dameris, Thomas Peter, Ulrich Schmidt, Reinhard Zellner. «Das Ozonloch und seine Ursachen». Chemie in unserer Zeit 41(3), S. 152—168 (2007), ISSN 0009-2851 (нім.)
- А. Д. Данилов, И. Л. Кароль. «Атмосферный озон — сенсации и реальность». — Л. Гидрометиоиздат 1991. (рос.)
- Ф. С. Ортенберг, Ю. М. Трифонов. Озон: взгляд из космоса.9./90. М. Знание 1990. (рос.)
- Ш. Роун. «Озоновый кризис. Пятнадцатилетняя эволюция неожиданной глобальной опасности». — М. «Мир» 1993. (рос.)
- Э. Александров, Ю. А. Израэль, И. Л. Кароль, А. Х. Хргиан. «Озоновый щит Земли и его изменения». — СПб. Гидрометиоиздат 1992. (рос.)
- А. Д. Стрижевский. Свет. Природа и человек 4/92. (рос.)
- Г. Фелленберг. «Загрязнение природной среды». М. «Мир» 1997. (рос.)
Посилання[ред. | ред. код]
- «Діра» озонова // Словник-довідник з екології : навч.-метод. посіб. / уклад. О. Г. Лановенко, О. О. Остапішина. — Херсон : ПП Вишемирський В. С., 2013. — С. 70.
- The ozone hole. (англ.)
- Environmental Effects of Ozone Depletion: 1994 Assessment. (англ.)
- Scientific Assessment of Ozone Depletion 2002. (англ.)
- Fahey, D.W. & etc.: «Twenty Questions and Answers About the Ozone Layer 2002». Scientific Assesment of Ozone Depletion. (англ.)
- Assessment of Ozone Depletion 2006.[недоступне посилання з липня 2019] (англ.)
- Віденська конвенція про охорону озонового шару (рос.)
- Монреальський протокол (рос.)
- Озоновий шар Землі (рос.)