Правило Гюккеля
Правило Гюккеля (англ. Hückel's rule) — спосіб оцінки наявності ароматичних властивостей у циклічних органічних молекулах із циклічно кон'югованими π-зв'язками. Квантово-механічну основу для цього правила розробив німецький хімік Еріх Гюккель у 1931 році (див. метод Гюккеля).[1][2]
Правило
Моноциклічна плоска (або майже плоска) сполука, що має циклічно кон'югованих π-електронів (n = 0, 1, 2,..), має високу стабільність і називаєтьтся ароматичною.[3] Відповідно, плоска молекула з циклічно кон'югованими π-електронів є нестабільною й називається антиароматичною.
Теоретично, n може дорівнювати нулю або будь-якому цілому числу більше нуля, але практичні приклади відомі лише для значень n = 0 до приблизно n = 6.[4]
Ілюстрацією правила Гюккеля є цикл Фроста.
Приклади
Анулени
Класичними сполуками, на прикладі яких демонструється правило Гюккеля, є анулени. Нижче представлені приклади ануленів та їх відповідність до правила Гюккеля (n = 1 — 4):[5]

Найважливішим прикладом ароматичної сполуки є бензен, який має 6 π-електронів (n = 1).
Гетероароматичні сполуки
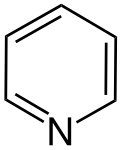
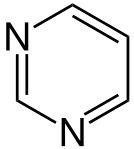
Гетероциклічні сполуки, що відповідають правилу Гюккеля, теж мають певні ароматичні властивості. При цьому слід поділяти між п'ятичленними й шестичленними гетероароматами. У випадку п'ятичленних гетероароматів (напр., пірол, фуран, тіофен) делокалізація π-електронів реалізується за участі орбіталі гетероатома з вільною електронною парою; ця електронна пара також бере участь в делокалізації, тому також рахується згідно правилу . У шестичленних гетероароматах (піридин, піримідин) гетероатом (у нейтральних гетероароматах це, зазвичай, Нітроген) утворює три зв'язки з атомами циклу, а його вільна електронна пара не бере участь у делокалізації.
Заряджені молекули
Ароматичні або антиароматичні властивості можуть проявляти не лише нейтральні молекули, але й іони циклічних полієнів; при цьому циклічна делокалізація реалізується за рахунок пустих p-орбіталей (у випадку карбокатіону) або p-орбіталей з вільною електронною парою (у випадку карбаніону). Тобто, вільні електронні пари також беруть участь в делокалізації, тому рахуються разом з π-електронами. Вільні p-орбіталі в карбокатіонах, таким чином, надають 0 електронів до делокалізації.
Найпростішим ароматичним іоном є циклопропеніл-катіон, що містить 2 π-електрона (n = 0):

Наступним у цьому списку йде циклопентадієніл-аніон (Cp-) (en), що має 6 делокалізованих π-електронів. Тропілій-катіон, до речі, теж має 6 π-електронів, але є семичленним циклом. Наступним ароматичним іоном є циклооктатетраєнід-діаніон (en1, en2), що має 10 π-електронів:
-
Циклопентадієніл-аніон
-
Тропілій-катіон
-
Циклооктатетраєніл-діаніон

Також відомі випадки гетероароматичних іонів, наприклад пірилій-катіон.
Звісно, ароматичні іони, хоч і вважаються ароматичними, є доволі реактивними, хоча тропілій-катіон можна кристалізувати разом із деякими аніонами (наприклад, бромід, йодид, перхлорат, тетрафлуороборат)[6][7][8]. Тим не менш, звичною сферою застосування ароматичних іонів є металоорганічна хімія, де ці іони використовуються в якості лігандів у металоценах:
-
Титаноцендіхлорид
-
Ураноцен
Обмеження й недоліки методу
Правило Гюкеля добре працює для моноциклічних сполук,[9] але є неточним у випадку конденсованих поліциклічних ароматів. Наприклад, нафталін та антрацен мають 10 та 14 π-електронів, а от ароматичні пірен (16 π-електронів) і коронен (24 π-електрона) вже не відповідають вимозі «». Альтернативно можна рахувати тільки ті електрони, що є моноциклічно кон'югованими (наприклад, тільки зовнішнє «кільце» коронену, яке має 18 π-електронів), але такий підхід можливий не в усіх випадках.
Однак, підхід «лічити тільки моноциклічно кон'юговані π-електрони» є дещо виправданим, що підтверджено теоретичними розрахунками.[10]
-
Моноциклічна делокалізація π-електронів у коронені спостерігається поміж зв'язків, що помічені червоним
-
Моноциклічна делокалізація π-електронів у порфіні спостерігається поміж зв'язків, що помічені червоним.
Див. також
Примітки
- ↑ Hückel, Erich (1931). Quantentheoretische Beiträge zum Benzolproblem I. Die Elektronenkonfiguration des Benzols und verwandter Verbindungen. Z. Phys. с. 70 (3–4): 204–86. doi:10.1007/BF01339530.
{{cite news}}: Перевірте значення|doi=(довідка) - ↑ Hückel, Erich (1938). Grundzüge der Theorie ungesättiger und aromatischer Verbindungen. Berlin: Verlag Chem. с. 77—85.
- ↑ A. D. McNaught A. Wilkinson (1997). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (англ.). Oxford: Blackwell Scientific Publications. doi:10.1351/goldbook. ISBN 0-9678550-9-8.
- ↑ March, Jerry (1985). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.) (англ.). New York: Wiley. ISBN 0-471-85472-7.
- ↑ Vollhardt, K. Peter C. (2003). Organic chemistry : structure and function (вид. 4th ed.). New York: W.H. Freeman and Co. ISBN 0-7167-4374-4. OCLC 49902193.
- ↑ Von E.Doering, W.; Knox, L. H. (1954-06). The Cycloheptatrienylium (Tropylium) Ion. Journal of the American Chemical Society (англ.). Т. 76, № 12. с. 3203—3206. doi:10.1021/ja01641a027. ISSN 0002-7863.
- ↑ Balaban, Alexandru T.; Oniciu, Daniela C.; Katritzky, Alan R. (2004-05). Aromaticity as a Cornerstone of Heterocyclic Chemistry. Chemical Reviews (англ.). Т. 104, № 5. с. 2777—2812. doi:10.1021/cr0306790. ISSN 0009-2665.
- ↑ Kitaigorodskii, A. I.; Struchkov, Yu. T.; Khotsyanova, T. L.; Vol'pin, M. E.; Kursanov, D. N. (1960-01). Crystal structures of tropylium perchlorate and iodide. Bulletin of the Academy of Sciences of the USSR Division of Chemical Science (англ.). Т. 9, № 1. с. 32—36. doi:10.1007/BF01178699. ISSN 0568-5230.
- ↑ Roberts, John D.; Streitwieser, Andrew, Jr.; Regan, Clare M. (1952). Small-Ring Compounds. X. Molecular Orbital Calculations of Properties of Some Small-Ring Hydrocarbons and Free Radicals. J. Am. Chem. Soc. 74 (18): 4579—82. doi:10.1021/ja01138a038.
- ↑ Geuenich, Daniel; Hess, Kirsten; Köhler, Felix; Herges, Rainer (2005-10). Anisotropy of the Induced Current Density (ACID), a General Method To Quantify and Visualize Electronic Delocalization. Chemical Reviews. Т. 105, № 10. с. 3758—3772. doi:10.1021/cr0300901. ISSN 0009-2665.
|